16.13: Formation d'ions complexes
Un genre de chimie acide-base de Lewis implique la formation d'un ion complexe (ou d'un complexe de coordination) comprenant un atome central, généralement un cation d'un métal de transition, entouré d'ions ou de molécules appelés ligands. Ces ligands peuvent être des molécules neutres comme H2O ou NH3, ou des ions comme CN− ou OH−. Souvent, les ligands agissent comme des bases de Lewis, donnant un doublet d'électrons à l'atome central. Ces types de réactions acide-base de Lewis sont des exemples d'une vaste sous-discipline appelée la chimie de coordination — le sujet d'un autre chapitre de ce texte.
La constante d'équilibre pour la réaction d'un ion métallique avec un ou plusieurs ligands pour former un complexe de coordination est appelée la constante de formation (Kf) (parfois appelée constante de stabilité). Par exemple, l'ion complexe [Cu(CN)2]− est produit par la réaction
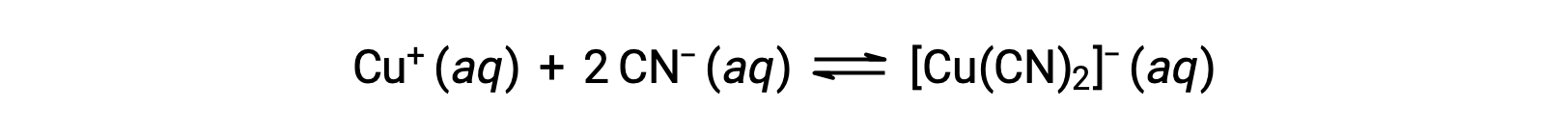
La constante de formation pour cette réaction est
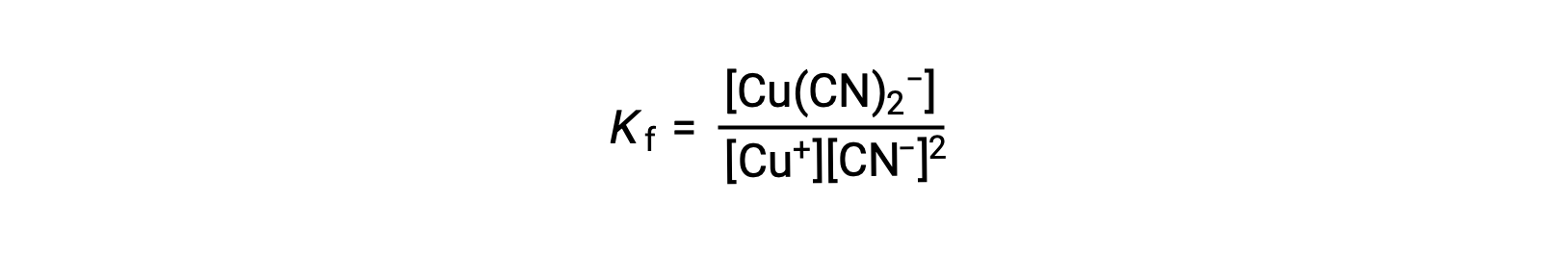
On peut aussi considérer la réaction inverse (décomposition de l'ion complexe), auquel cas la constante d'équilibre est une constante de dissociation (Kd). Selon la relation entre les constantes d'équilibre pour les réactions réciproques décrites, la constante de dissociation est l'inverse mathématique de la constante de formation, Kd = Kf−1.
À titre d'exemple de dissolution par la formation d'ions complexes, considérez ce qui se passe lorsque l'ammoniac aqueux est ajouté à un mélange de chlorure d'argent et d'eau. Le chlorure d'argent se dissout légèrement dans l'eau, ce qui donne une faible concentration d'Ag+ ([Ag+] = 1,3 × 10−55 M) :
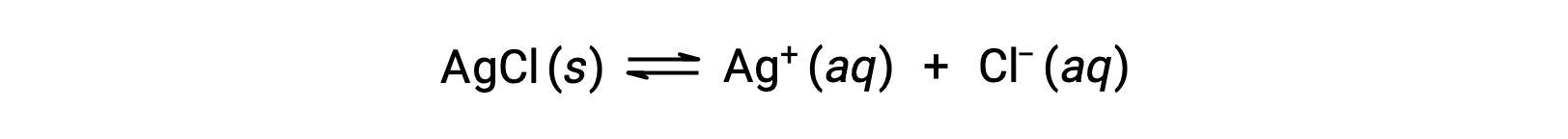
Cependant, si NH3 est présent dans l'eau, l'ion complexe, [Ag(NH3)2]+, peut se former suivant l'équation :
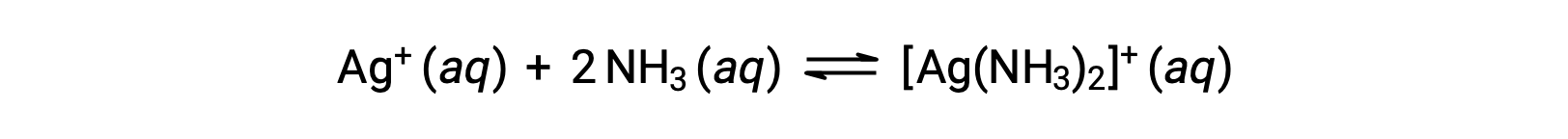
Ce texte est adapté de Openstax, Chimie 2e, Section 15.2 : Acides et bases de Lewis.


