17.5: 反应的标准熵值变化
熵是一种状态函数,因此化学反应的标准熵变化 (ΔS°rxn) 可以根据生成物和反应物之间的标准熵差异来计算。
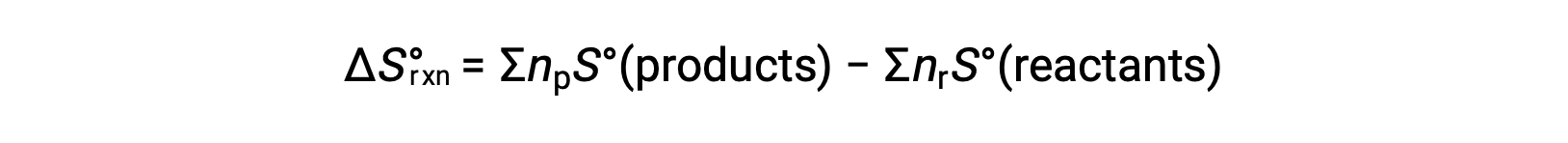
其中 np 和 nr 分别代表生成物和反应物平衡方程中的化学 - 大气系数。
例如,在室温下对以下反应进行 ΔS°rxn
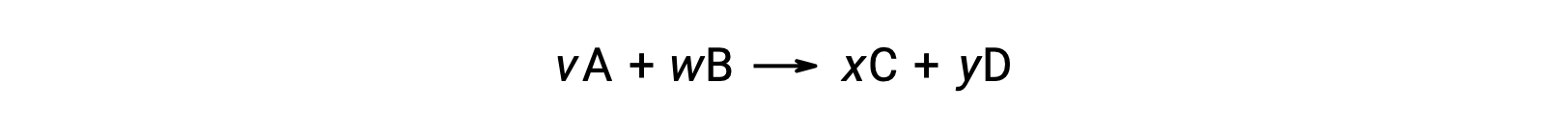
计算方法如下:
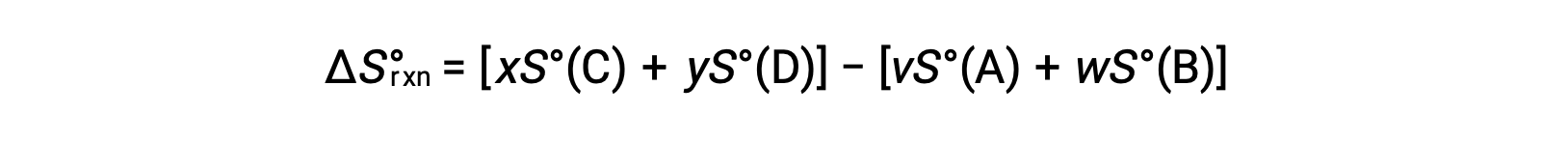
表中提供了标准托架的部分列表。
| S° (焦耳·/ 摩尔 K) | |
| C (s ,石墨) | 5.740) |
| C (s ,菱形) | 2.38. |
| CO (g) | 197.7 |
| 二氧化碳 (g) | 23.8. |
| 甲烷 (g) | 186.3 |
| C2H4(g) | 219.5 |
| C2H6 (g) | 229.5 |
| CH3OH (l) | 126.8 |
| C2H5OH (l) | 160.7. |
| H2 (g) | 130.57. |
| 高 (g) | 114.6. |
| 水 (g) | 188.71 |
| 水 (升) | 69.91. |
| HCI (g) | 186.8 |
| H2S (g) | 205.7 |
| 氧气 (g) | 205.03 |
ΔS° 的确定
考虑凝结 of Water ,其中 1 摩尔气态 H2O 变为 1 摩尔液态 H2O。
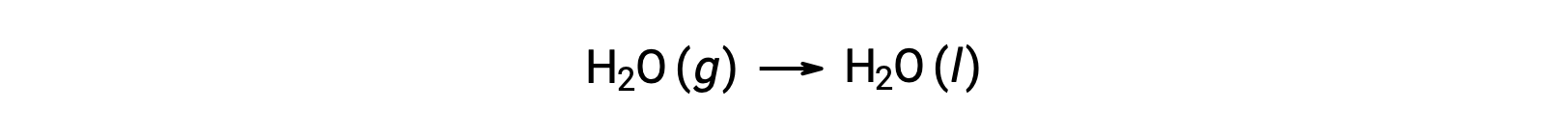
ΔS°反应的标准熵变化, n ü r rxn 是使用标准摩尔根托和化学计量系数计算的。
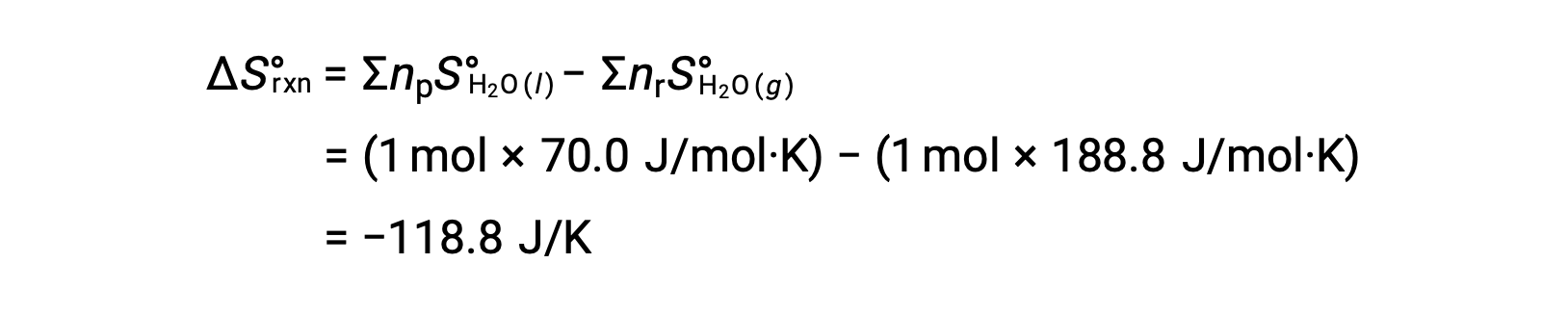
n ü ΔS°rxn 的值为负值,与此相变 (凝结) 的预期值相同。
第二个例子是,考虑甲醇的燃烧, CH3OH :
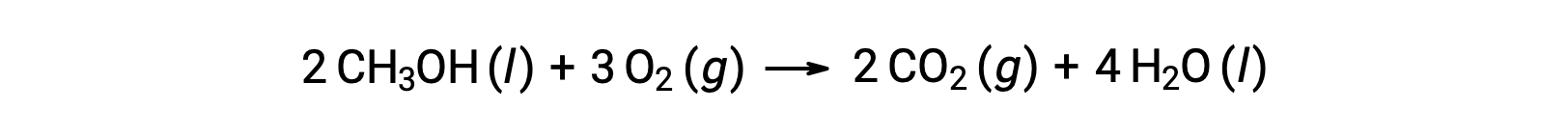
计算 反应的标准熵变化时遵循相同的程序:
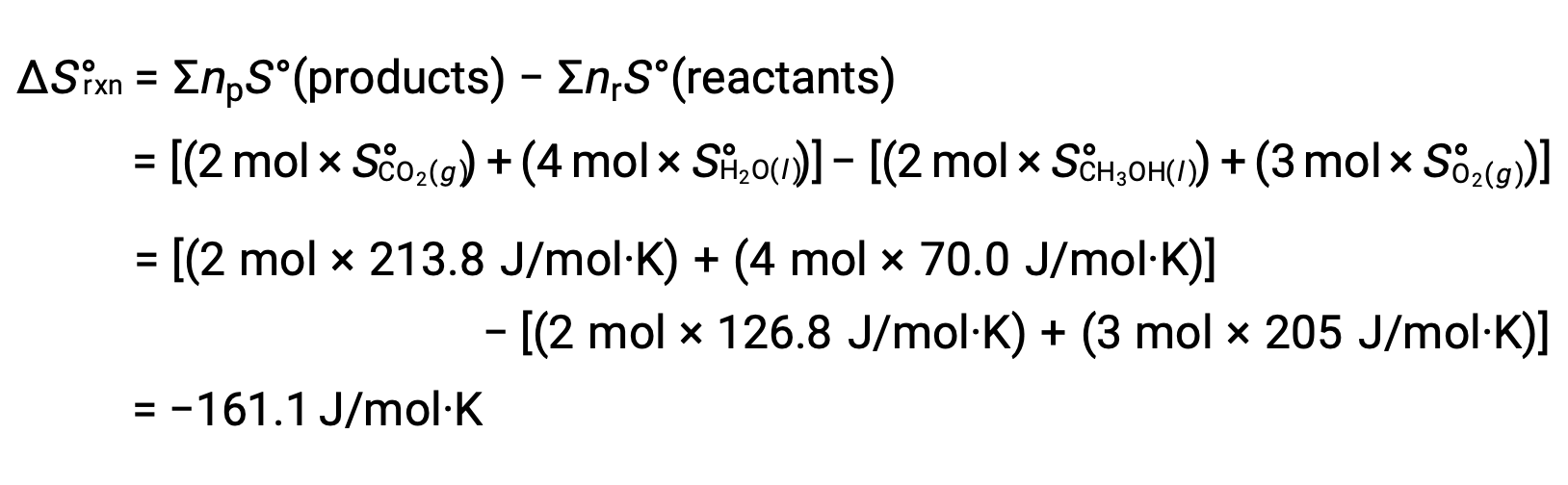
本文改编自 Openstax, 化学 2e, 第 16.2 章:热力学第二和第三定律。


