17.10: 自由エネルギー及び平衡
ある過程の自由エネルギー変化は、その過程の駆動力の指標と見なすことができます。負の値の ΔG はプロセスの順方向への駆動力を表し、正の値はプロセスの逆方向への駆動力を表します。ΔGrxnが0のとき、順方向と逆方向の駆動力は等しく、反応過程は両方向に同じ速度で進行する(反応系は平衡状態にある)。
反応商Qは系の質量作用を表し、その値は平衡に達するために反応が進行する方向を判断することに使用できることを思い出しましょう。Qが平衡定数Kよりも小さい場合、反応は平衡に達してQ=Kになるまで順方向に進行します。逆に、Q > Kの場合、平衡に達するまで逆方向に進行します。
非標準的な条件(1 bar以外の圧力、1 mol/L以外の濃度)で反応物と生成物が存在するプロセスの自由エネルギー変化は、次式に従って標準的な自由エネルギー変化と関連しています。
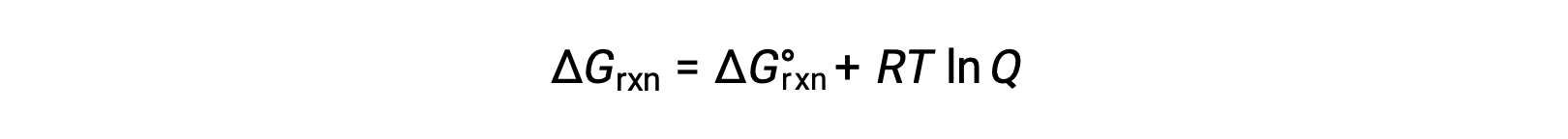
Rは気体定数(8.314 J/K mol)、Tはケルビン単位の絶対温度、Qは反応商です。気相平衡では、圧力に基づく反応商Qpが用いられます。凝縮相の平衡では、濃度に基づく反応商、Qcが用いられます。この式は、任意の条件下でのプロセスの自発性を予測するために使用することができます。
平衡状態にある系では、Q = K and ΔGrxn = 0であり、前の式は次のように書くことができます。
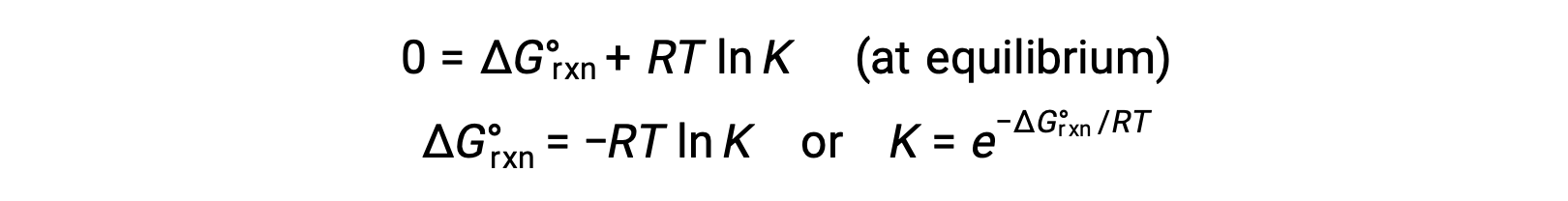
この式は、これらの2つの重要な熱力学的特性の間に便利な関係性を与え、標準自由エネルギー変化から平衡定数を導き出したり、逆に標準自由エネルギー変化から平衡定数を導き出すために使用することができます。標準自由エネルギー変化と平衡定数の関係を以下にまとめた。
K > 1の場合、 ΔGºrxn < 0となり、反応混合物中にて生成物の比率が大きくなります。
K < 1の場合、 ΔGºrxn > 0となり、反応混合物中にて反応物の比率が大きくなります。
K = 1の場合、 ΔGºrxn = 0となり、反応物と生成物が反応混合物中に等量存在します。
反応変化の標準自由エネルギーは、温度に依存します。
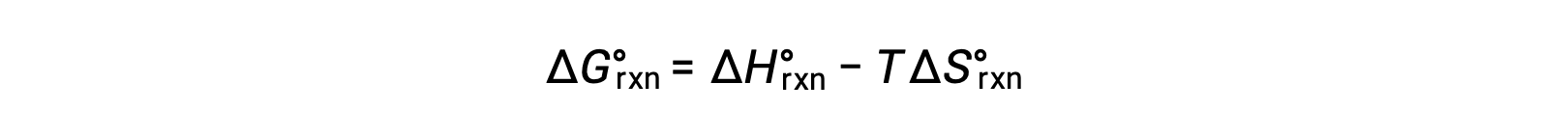
反応の標準自由エネルギー変化は、反応の平衡定数と関連しています。
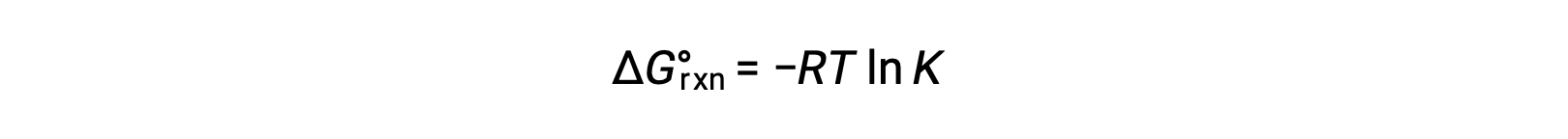
2つの式を組み合わせると、
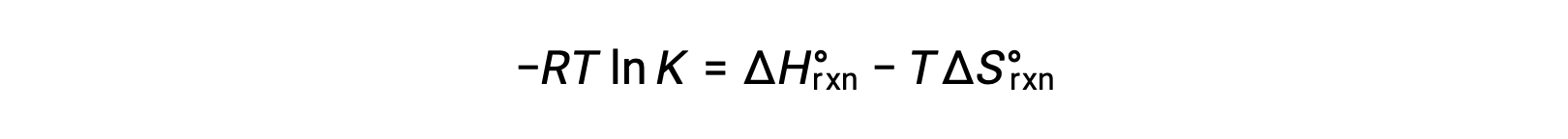
両辺をRTで割ると、次のようになります。

式を再整理すると、
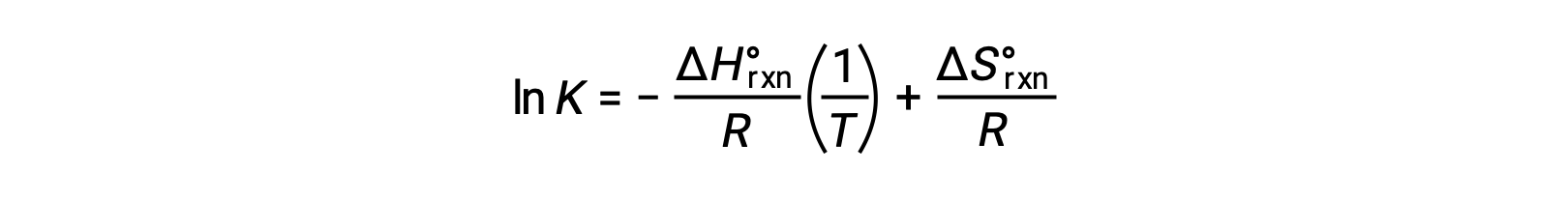
式は、直線y = mx + bの形をとります。ln Kを1/T に対してプロットすると、傾きが −ΔHºrxn/R、y切片が ΔSºrxn/Rとなる直線が得られます。また、この方程式は2点を用いた直線の式で表すこともできます。
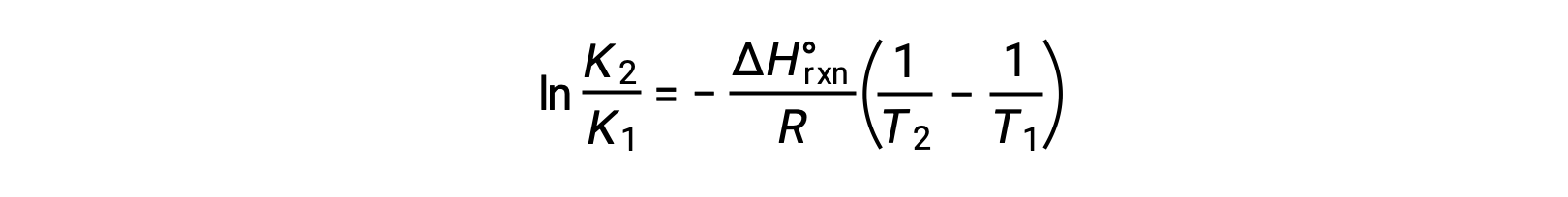
上記の文章は以下から引用しました。Openstax, Chemistry 2e, Chapter 16.4: Free Energy.


