17.10: Enthalpie libre et équilibre
La variation d'énergie libre pour un processus peut être considérée comme une mesure de sa force motrice. Une valeur négative de ΔG représente une force motrice pour le processus dans le sens direct, tandis qu'une valeur positive représente une force motrice pour le processus dans le sens inverse. Lorsque ΔGR est de zéro, les forces motrices directe et inverse sont égales et le processus se produit dans les deux sens à la même vitesse (le système est à l'équilibre).
Rappelez-vous que Q est la valeur numérique de l'expression d'action de masse pour le système, et que sa valeur peut être utilisée pour identifier le sens dans lequel une réaction se poursuivra afin d'atteindre l'équilibre. Lorsque Q est inférieur à la constante d'équilibre K, la réaction se poursuit dans le sens direct jusqu'à ce que l'équilibre soit atteint et que Q = K. Inversement, si Q > K, le processus se poursuit dans le sens inverse jusqu'à ce que l'équilibre soit atteint.
La variation d'énergie libre pour un processus qui se déroule avec des réactifs et des produits présents dans des conditions non standard (pressions autres que 1 bar ; concentrations autres que 1 M) est lié à la variation d'énergie libre standard selon cette équation :
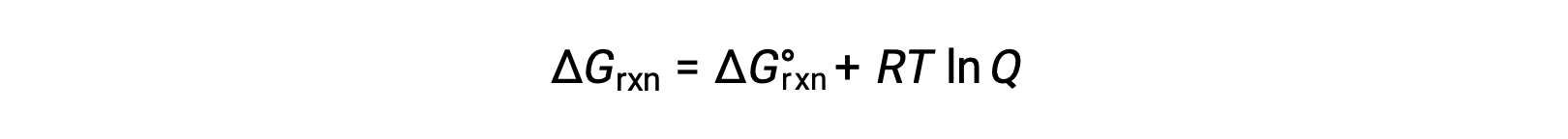
R est la constante des gaz (8,314 J/K mol), T est la température en Kelvin ou absolue et Q est le quotient réactionnel. Pour les équilibres en phase gazeuse, on utilise le quotient réactionnel basé sur la pression, Qp. Le quotient réactionnel basé sur la concentration, Qc, est utilisé pour les équilibres de phase condensée. Cette équation peut être utilisée pour prévoir la spontanéité d'un processus dans n'importe quel ensemble donné de conditions
Pour un système à l'équilibre, Q = K et ΔGR = 0, et l'équation précédente peut être écrite comme
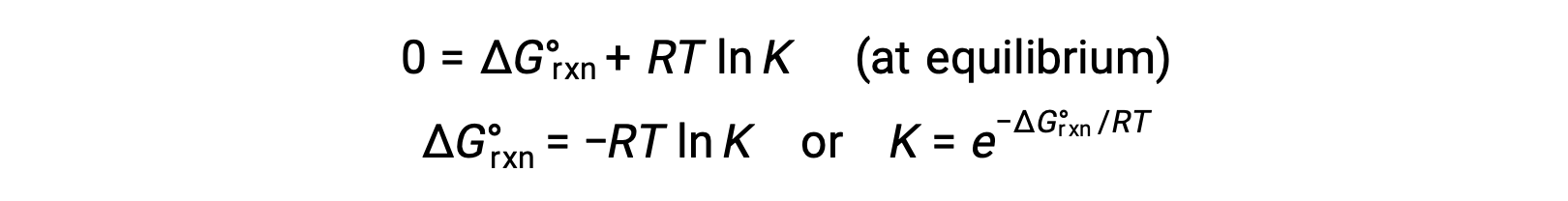
Cette forme de l'équation fournit un lien utile entre ces deux propriétés thermodynamiques essentielles, et elle peut être utilisée pour déduire des constantes d'équilibre à partir de variations d'énergie libre standard et vice versa. Les relations entre les variations d'énergie libre standard et les constantes d'équilibre sont résumées ci-dessous.
Si K > 1, ΔGºR < 0 et les produits sont plus abondants dans le mélange réactionnel.
Si K < 1, ΔGºR > 0 et les réactifs sont plus abondants dans le mélange réactionnel.
K = 1, ΔGºR = 0 et les réactifs et les produits sont abondants de façon comparable dans le mélange réactionnel.
La variation d'énergie libre standard d'une réaction dépend de la température :
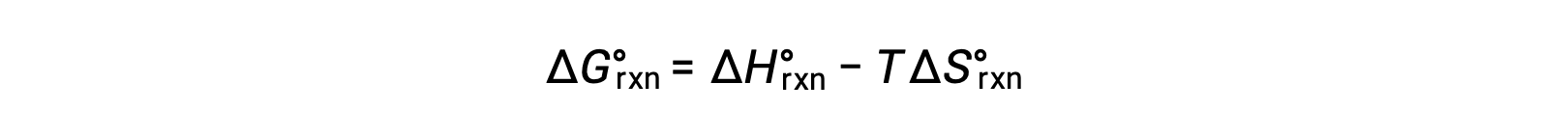
La variation d'énergie libre standard d'une réaction est lié à la constante d'équilibre d'une réaction :
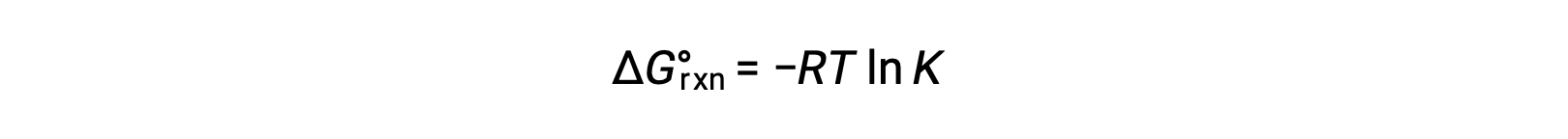
La combinaison des deux expressions :
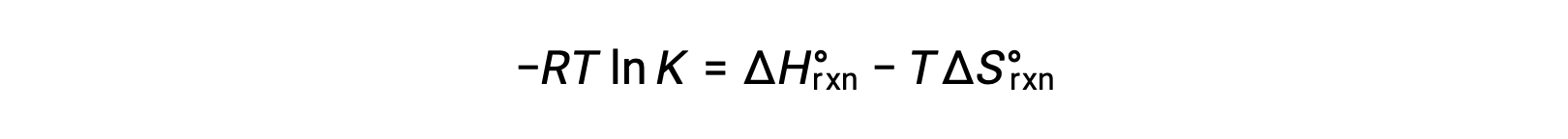
Diviser les deux côtés par RT donne

La réorganisation donne
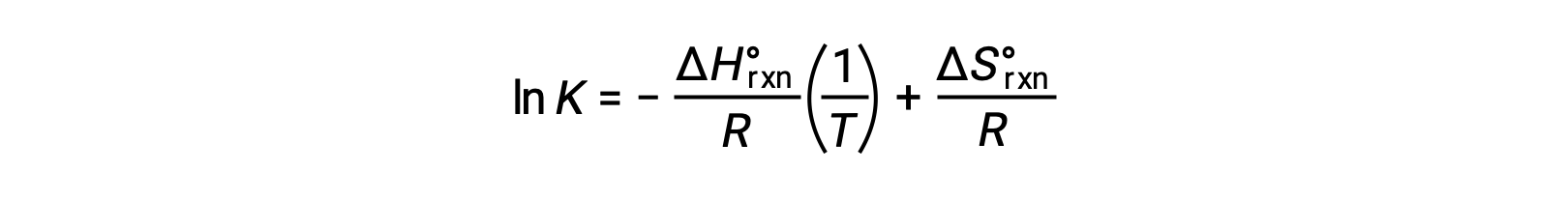
L'équation prend la forme d'une ligne droite y = mx + b. Un graphe de ln K tracé par rapport à de 1/T donne une ligne droite avec une pente de −ΔHºR/R et une ordonnée à l'origine de ΔSºR/R. L'équation peut également être exprimée sous la forme de deux points :
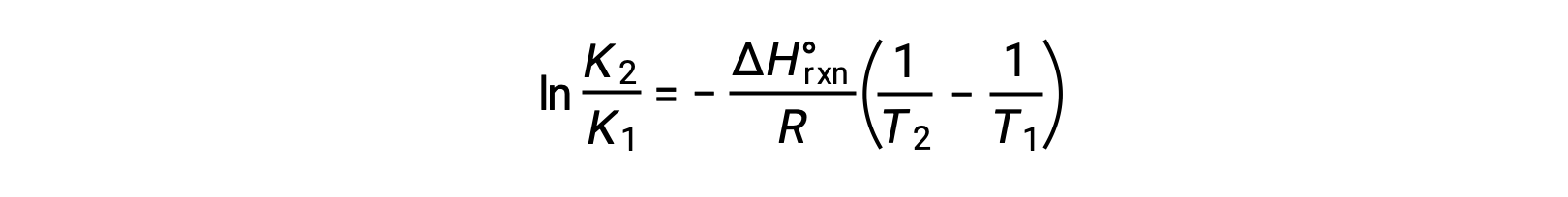
Ce texte est adapté de Openstax, Chimie 2e, Chapitre 16.4: Énergie libre.


