17.10: 自由能与平衡
一个过程的自由能变化可以看作是其驱动力的量度。 ΔG 的负值表示正向过程的驱动力,反向过程的正值表示反向驱动力的。 当 ΔGrxn 为零时,正向和反向驱动力相等,过程在同一率值 (系统处于平衡状态) 的两个方向发生。
请注意, Q 是系统的质量作用表达式的数值,其值可用于标识反应的进行方向,以实现平衡。 当 Q 小于平衡常数 K 时,反应将沿正向方向进行,直到达到平衡, Q = K。 相反,如果 Q > K ,过程将沿反向进行,直到达到平衡。
在非标准条件下 (压力不超过 1 巴;浓度不超过 1 M) ,反应物和生成物的过程的自由能变化与标准自由能变化有关,根据以下方程:
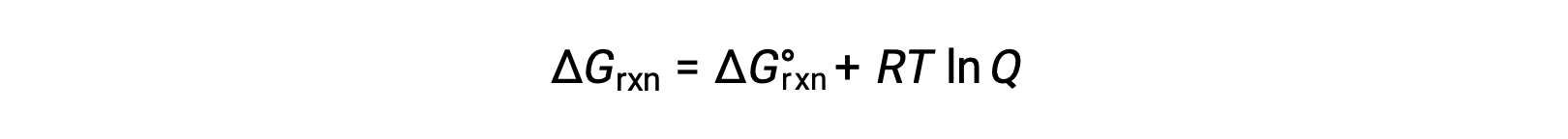
R 是气体常数 (8.314 J/K mol) , T 是开氏或绝对温度, Q 是反应商。 对于气相平衡,使用基于压力的反应商 Qp。 基于浓度的反应商 (QC) 用于凝相平衡。 此方程可用于预测过程在任何给定条件集下的自发性
对于平衡系统, Q = K 和 ΔGrxn = 0 ,之前的方程可能被写入为
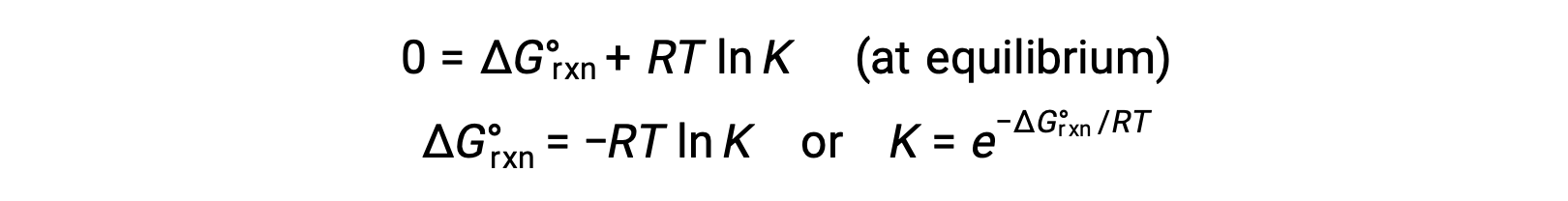
这种形式的方程提供了这两种基本热动力学性质之间的有用链接,它可用于从标准自由能变化导出平衡常数,反之亦然。 标准自由能变化和平衡常量之间的关系总结如下。
如果 K > 1 , ΔGºrxn < 0 且生成物在反应混合物中更丰富。
如果 K < 1 , ΔGºrxn > 0 和反应物在反应混合物中的浓度较高。
K = 1 , ΔGºrxn = 0 ,反应物和生成物在反应混合物中的含量相当大。
反应变化的标准自由能取决于温度:
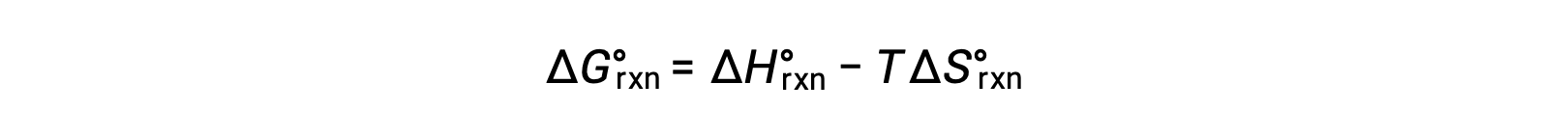
反应的标准自由能变化与反应的平衡常数相关:
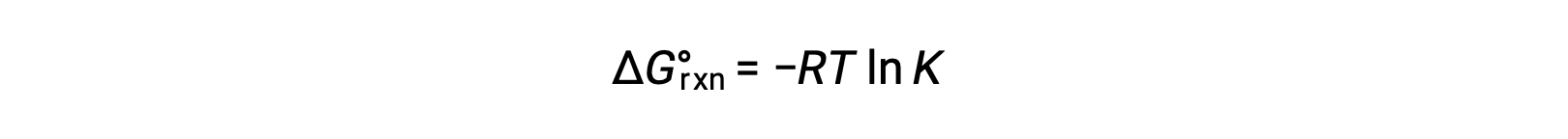
将两个表达式组合在一起:
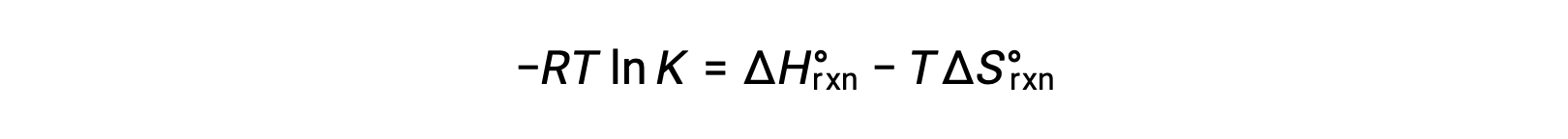
两侧除以 RT 给出

重新排列给出的结果
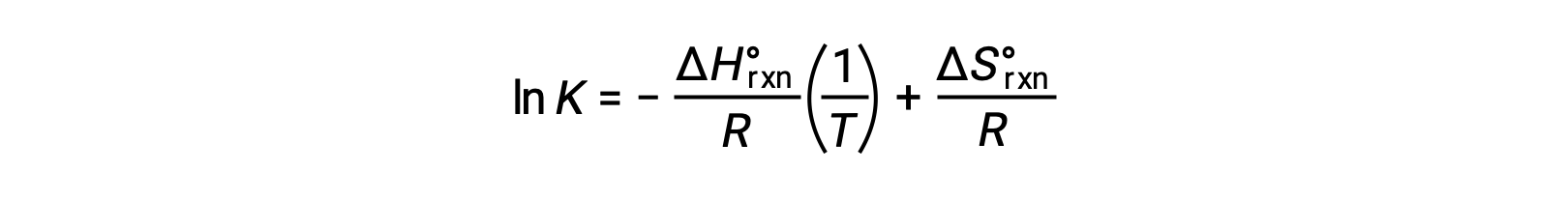
方程采用直线 y = mx + b. 的形式 用 1/T 绘制的 ln K 图解 产生一条斜率为 −ΔHºrxn º /R 的直线,并产生 ΔSºrxn º /R 的 y 截距 方程还可以两点形式表示:
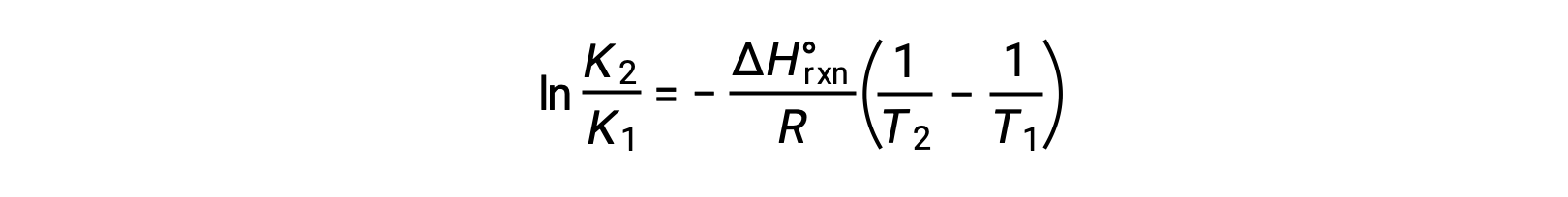
本文改编自 Openstax, 化学 2e, 第 16.4 章节:自由能。


