18.3: Voltaik / Galvanik Hücreler
Spontan Kimyasal Reaksiyonlar
Spontan redoks reaksiyonları doğada bol miktarda bulunur. Uzaktan kumandalarımıza güç veren tek kullanımlık bir AA pilde meydana gelen kimyasal reaksiyon, spontan bir redoks reaksiyonunun böyle bir örneğidir. Başka bir örnek, sarmal bakır telin sulu bir gümüş nitrat çözeltisine daldırılmasıdır. Reaksiyon, renksizden parlak maviye kademeli, görsel olarak etkileyici bir renk değişimi ve bakır tel üzerinde gri bir çökelti oluşumunu gösterir. Bu deneyde, bakır, çözeltiyi mavi yapan bakır iyonları oluşturmak için oksidasyona uğrar, Gümüş iyonları ise tel üzerinde gümüş bir çökelti oluşturmak üzere indirgenir.
Reaksiyon aşağıdaki gibi özetlenebilir:
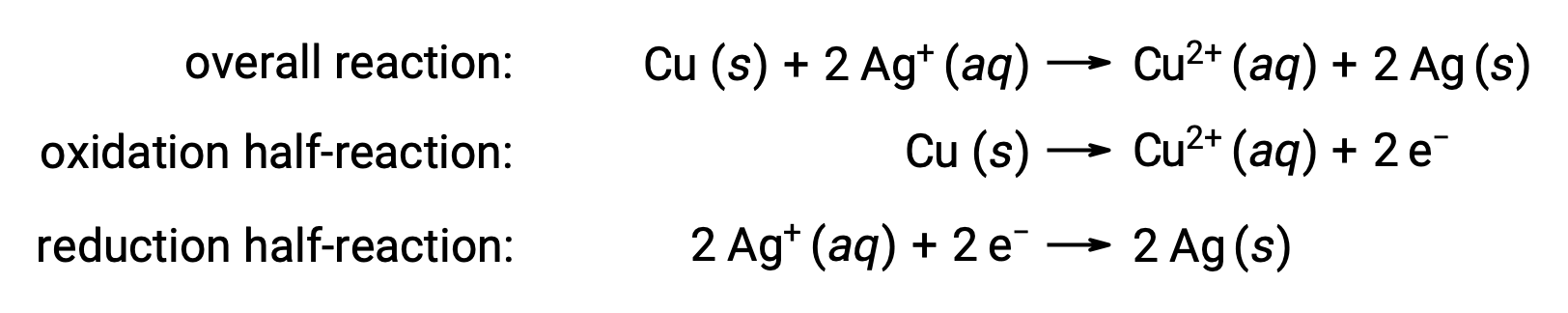
Burada, bakır telden sulu gümüş iyonlarına doğrudan ve kendiliğinden bir elektron transferi vardır.
Elektrokimyasal Hücreler ve Galvanik Hücreler
Bir cihazın bir redoks sisteminin tüm reaktanlarını ve ürünlerini içerdiğini, ancak reaktanların fiziksel temasını önlediğini varsayalım. Bu nedenle, elektronların doğrudan transferi önlenir; bunun yerine, dolaylı olarak ayrılmış reaktanlarla temas eden harici bir devre aracılığıyla gerçekleşir. Bu tip cihazlar genellikle elektrokimyasal hücreler olarak adlandırılırlar.
Bir elektrokimyasal hücre, reaksiyona giren atomlar arasında doğrudan temas olmadan bir redoks reaksiyonu ile bir elektrik akımının üretildiği bir cihazdır. Spontan bir redoks reaksiyonu nedeniyle bir akımın oluşturulduğu elektrokimyasal hücreler galvanik veya voltaik hücreler olarak bilinir (Luigi Galvani ve Alessandro Volta'dan sonra adlandırılmıştır).
Galvanik bir Hücrenin Bileşenleri
Bakır ve gümüş (I) arasındaki spontan reaksiyona dayanan bir galvanik hücre, Şekil 1'de tasvir edilmiştir. Tipik bir galvanik hücre, her biri tek bir reaktanın bir redoks konjugat çifti içeren iki yarım hücreden oluşur. Soldaki yarım hücre, katı bir bakır folyo ve sulu bir bakır nitrat çözeltisi biçiminde Cu (0) / Cu (II) çiftini içerir. Sağ yarım hücre, Ag(I) / Ag(0) çiftini katı gümüş folyo ve sulu bir gümüş nitrat çözeltisi içerir. Her yarım hücreye katı folyoda harici bir devre bağlanır, yani Cu ve Ag folyolarının her biri bir elektrot olarak işlev görür. Reaksiyon, her yarım hücre reaksiyon karışımı ile ilgili elektrot arasındaki arayüzde meydana gelir. Anot, oksidasyonun meydana geldiği elektrottur ve negatif bir yük taşır, katot ise indirgemenin meydana geldiği elektrottur ve pozitif bir yük taşır.
İki yarım hücre, potasyum klorür veya amonyum nitrat gibi inert bir elektrolitin bir jeli veya macununu içeren ters çevrilmiş bir U tüpü olan bir tuz köprüsü ile bağlanır. Tuz köprüsü, reaksiyonun şarj dengesini sağlarken reaksiyon karışımlarını ayrı tutmaya yardımcı olur. Bu hücredeki spontan reaksiyon, anot yarı hücresinde Cu+2 katyonları üretir ve katot yarı hücresinde Ag+ iyonlarını tüketir, bu da şarj dengesini koruyan tuz köprüsünden telafi edici bir inert iyon akışı ile sonuçlanır. Tuz köprüsü, anot ve katotta pozitif ve negatif iyonların birikmesini nötralize ederek reaksiyonun devam etmesini sağlayan bir inert iyon akışı sağlar. Bu nedenle, anot yarı hücresindeki artan Cu+2 konsantrasyonları, tuz köprüsünden bir NO3− akışı ile dengelenirken, katot yarı hücresine bir Na+ akışı, azalan Ag+ konsantrasyonunu telafi eder.
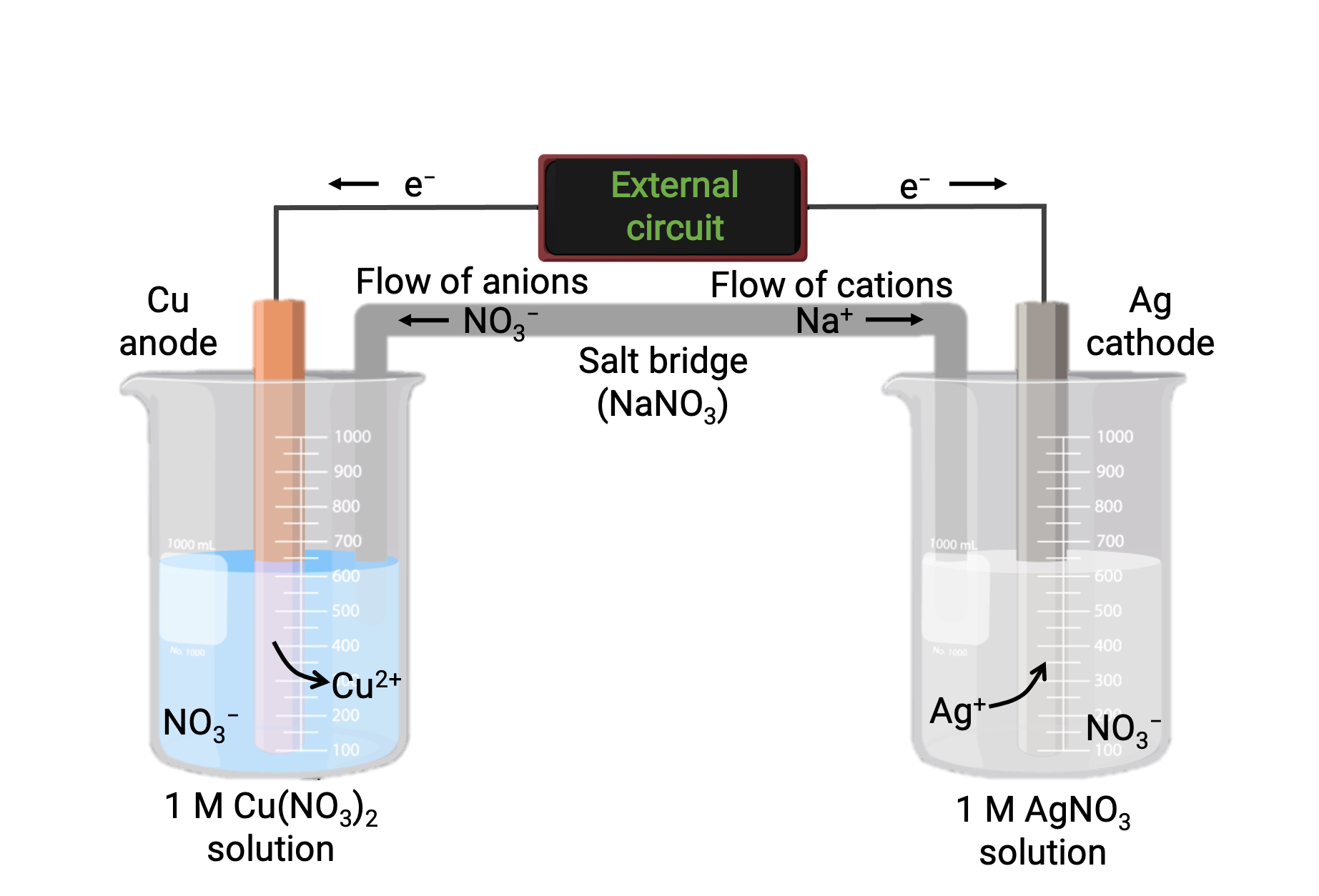
Şekil 1: : Bakır ve gümüş (I) iyonları arasındaki spontan reaksiyona dayanan galvanik bir hücre.
Hücre Şemaları veya Hücre Gösterimi Kullanarak Galvanik Hücrenin Temsil Edilmesi
Galvanik hücre, hücre şemaları veya hücre gösterimleri kullanılarak sembolik olarak temsil edilir.
• Hücre şemalarında, bileşen fazları arasındaki tüm arayüzler dikey paralel çizgilerle temsil edilir.
• Aynı aşamada iki veya daha fazla bileşen varsa, bunlar virgül kullanılarak gösterimde ayrılır.
• Anot şemanın solunda ve katot sağda temsil edilir.
• Çift dikey çizgi, iki yarı reaksiyon arasında bir tuz köprüsü veya gözenekli bir bölüm olduğunu gösterir.
• Kural olarak, şematik anot ile başlar ve soldan sağa doğru ilerler, hücre içinde karşılaşılan fazları ve arayüzleri tanımlar ve katot ile sona erer.
Örneğin, yukarıdaki galvanik hücre, bir tuz köprüsü vasıtasıyla katı bir gümüş katot olan daldırılmış sulu bir gümüş(I) nitrat çözeltisine bağlanan sulu bir bakır(II) nitrat içine daldırılmış katı bir bakır anottan oluşur. Bu ifadeyi yukarıdaki yönergeleri izleyerek sembolizme dönüştürmek şu hücre şemasını sağlar:
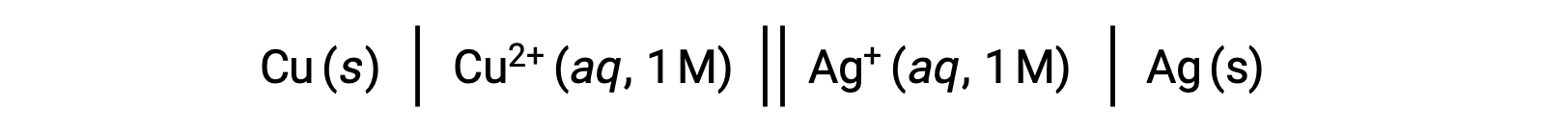
Bu metin bu kaynaktan uyarlanmıştır: Openstax, Chemistry 2e,17.2 Galvanic Cells.


