18.6: La Ecuación de Nernst
Condiciones de reacción no estándar
La interconexión entre los potenciales de celda estándar y varios parámetros termodinámicos tales como el cambio de energía libre estándar ΔG° y la constante de equilibrio K ha sido abordada previamente. Por ejemplo, una reacción redox que involucra iones zinc (II) y estaño (II) a una concentración de 1 M con Elºcelda = +0,291 V y ΔG° = −56,2 kJ es espontánea.
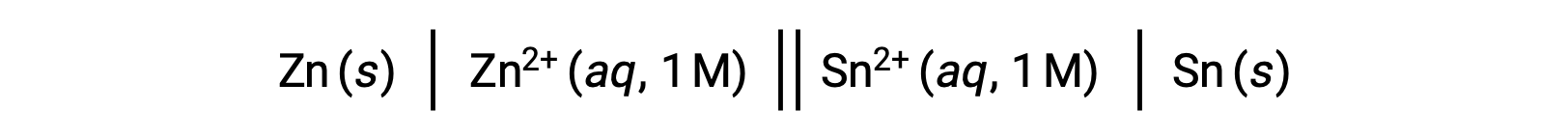
Sin embargo, la descarga de esta celda produce un cambio en la concentración de los reactantes y una disminución constante del potencial de celda. No obstante, en tal condición, las relaciones entre el potencial de celda y los parámetros termodinámicos no pueden establecerse fácilmente, ya que sólo se mantienen en condiciones estandarizadas de concentración, temperatura y presión (es decir, concentración de 1 M, 298 K o 25 °C y una presión de 1 atmósfera). Muchas reacciones redox de interés científico significativo ocurren bajo condiciones de estado no estándar, por ejemplo, diferentes concentraciones de reactantes en una celda galvánica o los gradientes de concentración que tienen lugar a través de las membranas biológicas. Por lo tanto, es importante calcular los potenciales de tales sistemas.
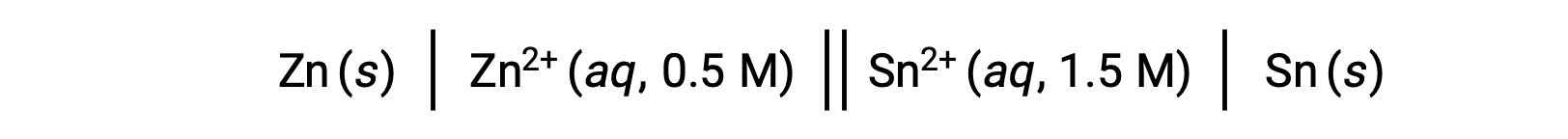
Cuando la concentración de iones zinc en la reacción es menor y la concentración de iones estaño es mayor en comparación con las condiciones estándar, la espontaneidad de la reacción redox puede predecirse cualitativamente usando el principio de Le Chatelier. Dada la mayor concentración de producto en relación al reactivo, la reacción tiene una mayor tendencia a proceder en la dirección que favorece la generación de los productos. Esto da como resultado un mayor valor de potencial de celda o Ecelda que el valor de E°celda.
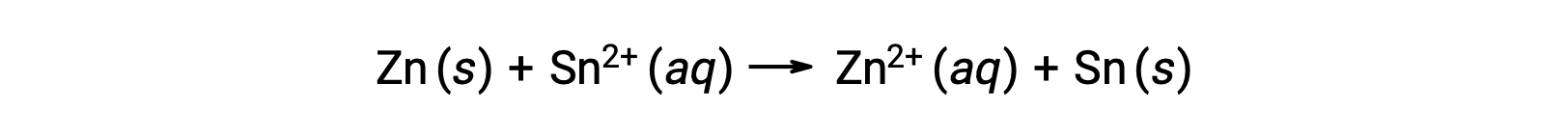
Esta reacción procede en la dirección de avance; sin embargo, el valor cuantitativo de este potencial de celda no puede determinarse fácilmente.
Obtención de la ecuación de Nernst para reacciones Redox que se producen en condiciones no estándar
La relación entre los valores de Ecelda y E°celda puede derivarse de la relación establecida previamente entre los cambios de energía libre en condiciones estándar y no estándar, que se da de la siguiente manera:
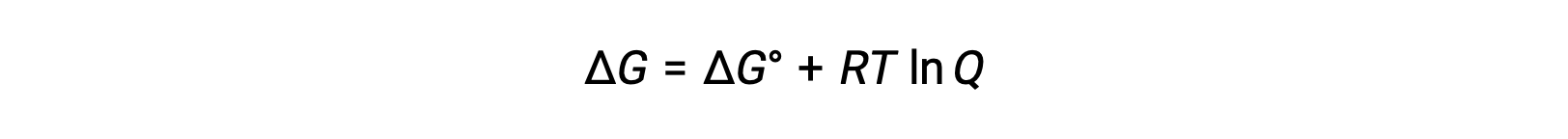
ΔG es el cambio en la energía libre, ΔG° es el cambio estándar en la energía libre, R es la constante de gas (valor = 8,314 J/mol∙K), y Q es el cociente de reacción, que explica el cambio en la energía libre debido a la diferencia en la composición de las mezclas de reacción. El valor de Q se omite si los reactivos son sólidos.
Al sustituir la ecuación que relaciona el cambio de energía libre con el potencial celular, se obtiene una ecuación modificada, conocida como la ecuación de Nernst.
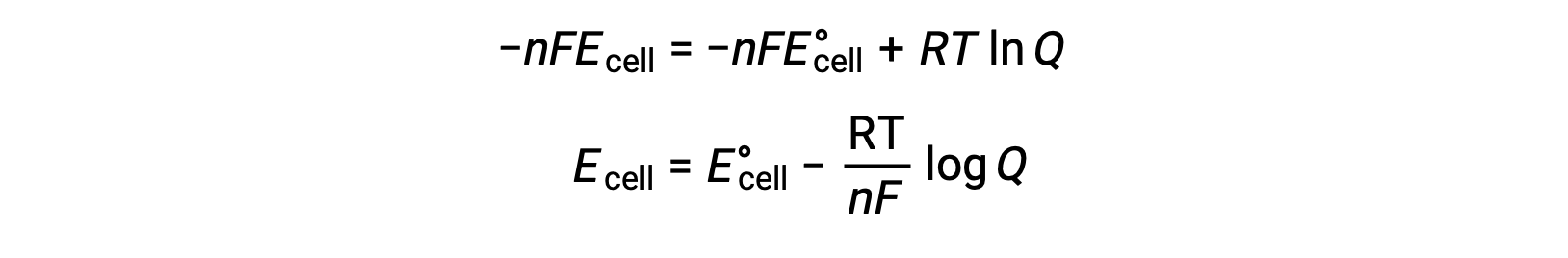
La ecuación de Nernst describe la variación en el potencial de un sistema redox (como una celda galvánica) a partir de su valor en estado estándar. Depende del número de electrones transferidos durante la reacción redox, n, la temperatura medida en kelvin, T y la composición de la mezcla de reacción dada como Q.
Una forma simplificada de la ecuación de Nernst para la mayoría del trabajo es aquella en la que se han incluido los valores de las constantes fundamentales (R y F) y un factor de conversión de logaritmos naturales a logaritmos de base 10:
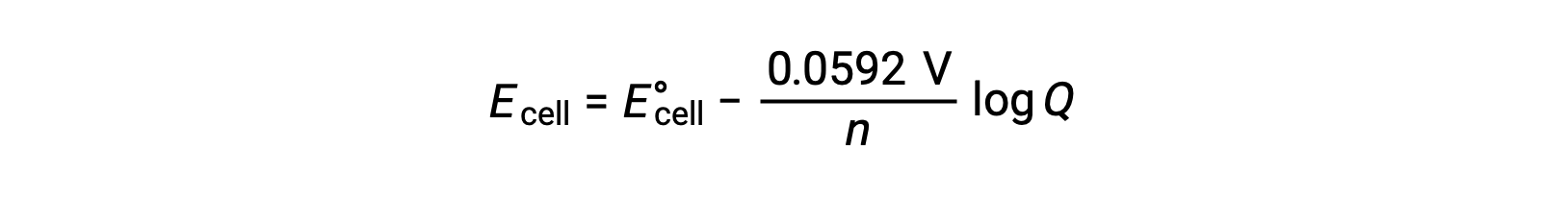
En condiciones de estado estándar, el valor del cociente de reacción Q es la unidad, cuyo logaritmo es cero. Esto se debe a la concentración igual de reactivos y productos en condiciones estándar. Aquí, Ecelda es igual a E°celda. Un valor de Q inferior a uno indica una mayor concentración de reactivos, desplazando el equilibrio de reacción hacia la derecha y, por lo tanto, produciendo un valor mayor de potencial de celda. Un valor de Q superior a uno indica una concentración de producto mayor, lo que dirige la reacción hacia la izquierda y un valor menor del potencial de celda. En equilibrio, el valor de Q es igual a K, y el potencial de celda se convierte en cero, es decir, la reacción no muestra ninguna tendencia a proceder en ninguna dirección. Esto explica por qué las baterías “mueren” en descarga continua: La disminución de la concentración de reactivos impulsa la reacción hacia el equilibrio y su potencial de celda disminuye constantemente hasta cero.
Este texto es adaptado deOpenstax, Química 2e, Sección 17.4: Potencial, Energía Libre y Equilibrio.


