18.6: Уравнение Нернста
Нестандартные условия реакции
Ранее исследовались взаимосвязи между стандартными потенциалами клеток и различными термодинамическими параметрами, такими как стандартный изменение свободной энергии ΔG° и константа равновесия K. Например, окислительно-восстановительные реакции, включающие ионы цинка(II) и олова(II) при концентрации 1 м с Эпкел = +0,291 в и ΔG° = -1 56.2 кДж, являются спонтанными.
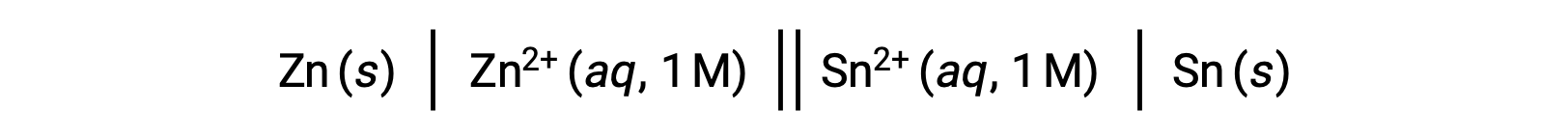
Однако при разрядке этой клетки происходит изменение концентрации реагент и постоянное снижение потенциала клетки. Однако при таком состоянии отношения между клеточной и термодинамической параметрами не могут быть легко установлены, так как они верны только при стандартных условиях концентрации, температуры и давления (т.е. концентрации 1 м, 298 к или 25 °C и давления 1 атмосферы). Многие окислительно-восстановительные реакции, представляющие значительный научный интерес, происходят в нестандартных условиях, например, при различных концентрациях реагент в гальванической ячейке или градиентах концентрации, возникающих в биологических мембранах. Следовательно, становится важным рассчитать потенциалы таких систем.
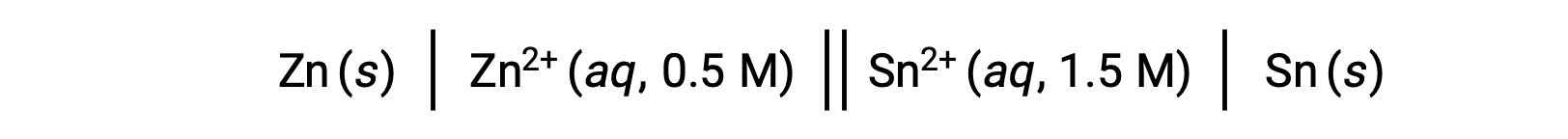
Когда концентрация ионов цинка в реакции меньше, а концентрация ионов олова выше, чем у стандартных условий, спонтанность окислительно-восстановительного действия можно качественно предсказать с помощью принципа Ле Чателье. Учитывая более высокую концентрацию продукта в реагент, реакция имеет более высокую тенденцию двигаться в направлении, благоприятствующее производству продуктов. Это приводит к более высокому значению потенциала ячейки или ячейки Ecell, чем значение ячейки E°.
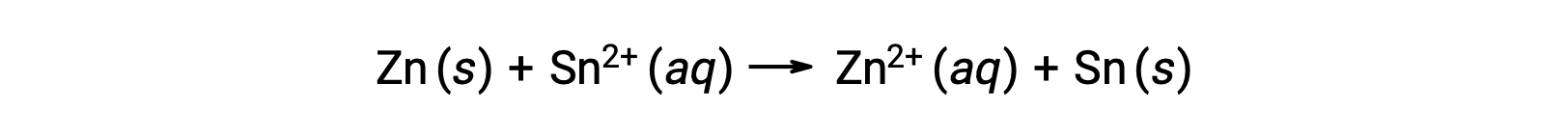
Эта реакция идет в прямом направлении, однако количественное значение этого клеточного потенциала трудно определить.
Вывод уравнения Нернста для редокс-реакций, возникающих в нестандартных условиях
Связь между значениями Экели E°CELL может быть получена из ранее установленной связи между свободными изменениями энергии в стандартных и нестандартных условиях, которая приводится ниже:
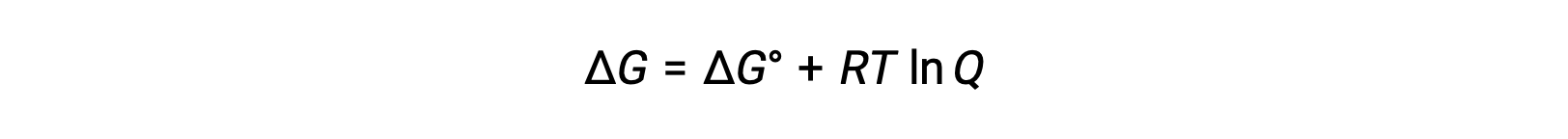
ΔG – это изменение свободной энергии, ΔG° – это стандартное изменение свободной энергии, R – постоянная газа (значение = 8.314 Дж/моль∙K), а Q – коэффициент реакции, который является причиной изменения свободной энергии из-за разницы в составе реакционных смесей. Значение Q не отображается, если реагенты является твердым.
При замещении уравнения, связанного изменение свободной энергии с клеточной потенциалом, получается модифицированное уравнение, известное как уравнение Нернста.
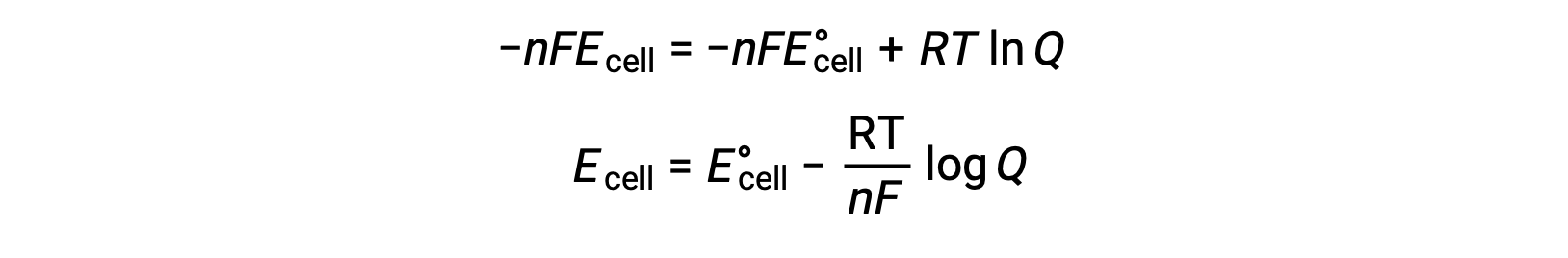
Уравнение Нернста описывает изменение потенциала окислительно-восстановительных систем (таких как гальваническая ячейка) от его стандартного значения состояния. Он зависит от количества электронов, передаваемых во время окислительно-восстановительных реакций, n, температуры, измеренной в кельвине, T, и состава реакционной смеси, заданного как Q
Упрощенная форма уравнения Нернста для большинства работ — это та, в которой были включены значения фундаментальных констант (R и F) и коэффициент, преобразующий из натурального логарифма в логарифмы Base-10:
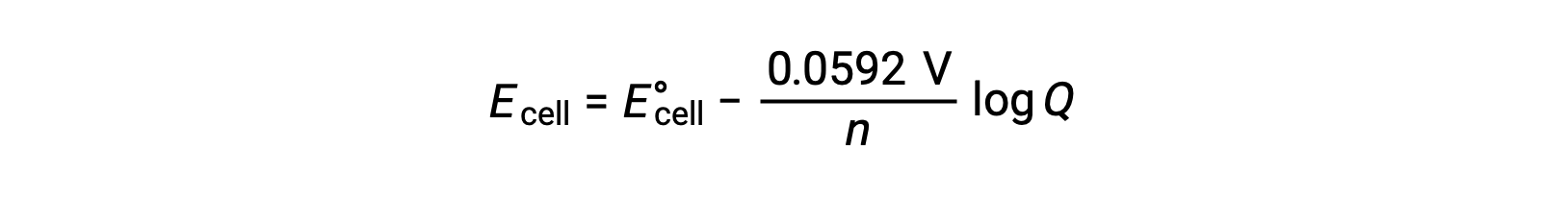
В стандартных условиях состояния значение коэффициента реакции Q является единице, логарифм которой равен нулю. Это связано с равной концентрацией реагенты и продуктов в стандартных государственных условиях. В этом случае Экелон равен E°cell. Значение Q меньше одного указывает на более высокую концентрацию реагенты, смещая равновесие реакции вправо и, таким образом, обеспечивая более высокое значение клеточного потенциала. Значение Q больше одного указывает на более высокую концентрацию продукта, приводя реакцию влево и более низкое значение клеточного потенциала. При равновесии значение Q равно K, а потенциал ячейки становится нулевым, т.е. реакция не показывает тенденции двигаться в любом направлении. Это объясняет, почему батареи “умирают” при непрерывной разрядке: Снижение концентрации реагент приводит к реакции на равновесие и ее потенциал клеток постоянно снижается до нуля.
Этот текст адаптирован изOpenstax, Химия 2е изд., раздел 17.4: Потенциал, свободная энергия и равновесие.


