18.7: 濃淡電池
濃淡電池とは、ほぼ同一の半反応を持つ2つの半電池を同じ電極で接続した電池の一種で、1つの酸化還元種の濃度が異なるだけです。したがって、濃淡電池の電位は、特定の酸化還元種の濃度差によってのみ決定されます。
次に示す電池を考える:
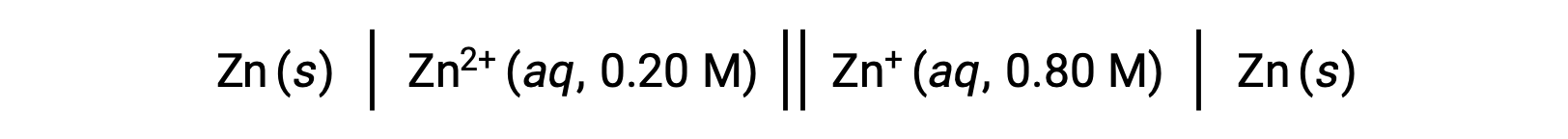
ネルンスト式を用いて、与えられた情報からこの濃淡電池の電極電位を計算することができます。

ネルンスト式に代入すると、次のようになります。
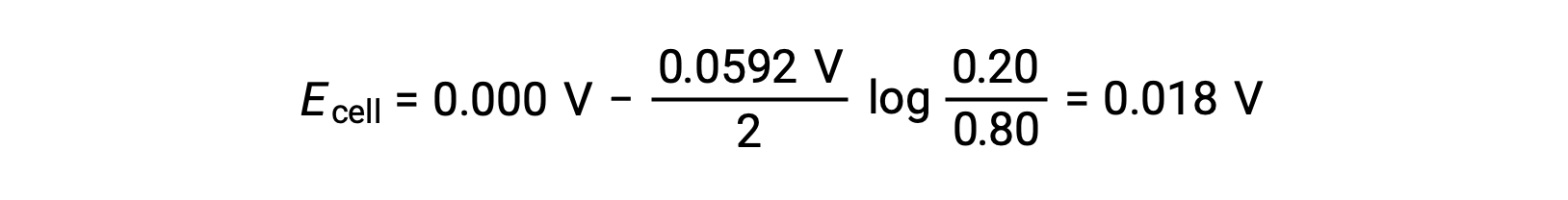
電極電位の値が正であることは、電池全体の反応が自発的であることを示しています。この自発的な反応は、カソードの亜鉛イオン濃度が下がり(亜鉛単体に還元される)、アノードの亜鉛イオン濃度が上がる(陽極の亜鉛が亜鉛イオンに酸化される)ことで起こります。Zn2+イオン濃度が高いカソードでは、亜鉛の還元に大きな駆動力が働く(Ecathode > Eanode)。
実験室のpHメーター、神経細胞膜のイオンチャンネル、人体の心筋細胞などは、濃淡電池の原理で動いています。
上記の文章は以下から引用しました。 Openstax,Chemistry 2e,Chapter 17.4: Potential, Free Energy, and Equilibrium.


