11.15: Centralização Reticular e Número de Coordenação
A estrutura de um sólido cristalino, quer se trate de um metal ou não, é melhor descrita considerando a sua unidade repetitiva mais simples, que é referida como a sua célula unitária. A célula unitária consiste em pontos reticulares que representam as localizações de átomos ou iões. A estrutura inteira consiste então nesta célula unitária que se repete em três dimensões. Os três tipos diferentes de células unitárias presentes no retículo cúbico estão ilustrados na Figura 1.
Tipos de Células Unitárias
Imagine um grande número de esferas idênticas e organizá-las uniformemente em um recipiente de tal forma que uma camada está diretamente acima das esferas da camada abaixo. Esse arranjo é chamado de estrutura cúbica simples, e a célula unitária é chamada de célula unitária cúbica simples ou célula cúbica primitiva. Em uma estrutura cúbica simples, as esferas não estão compactadas tão perto quanto poderiam estar, e “enchem” apenas aproximadamente 52% do volume do recipiente.
Um átomo neste tipo de arranjo entra em contacto apenas com os quatro vizinhos mais próximos da sua camada; um átomo diretamente acima dele na camada acima; e um átomo diretamente abaixo dele na camada abaixo. O número de outras partículas que cada partícula em um sólido cristalino contacta é conhecido como o seu número de coordenação. Para um átomo de polónio em uma matriz cúbica simples, o número de coordenação é, portanto, seis.
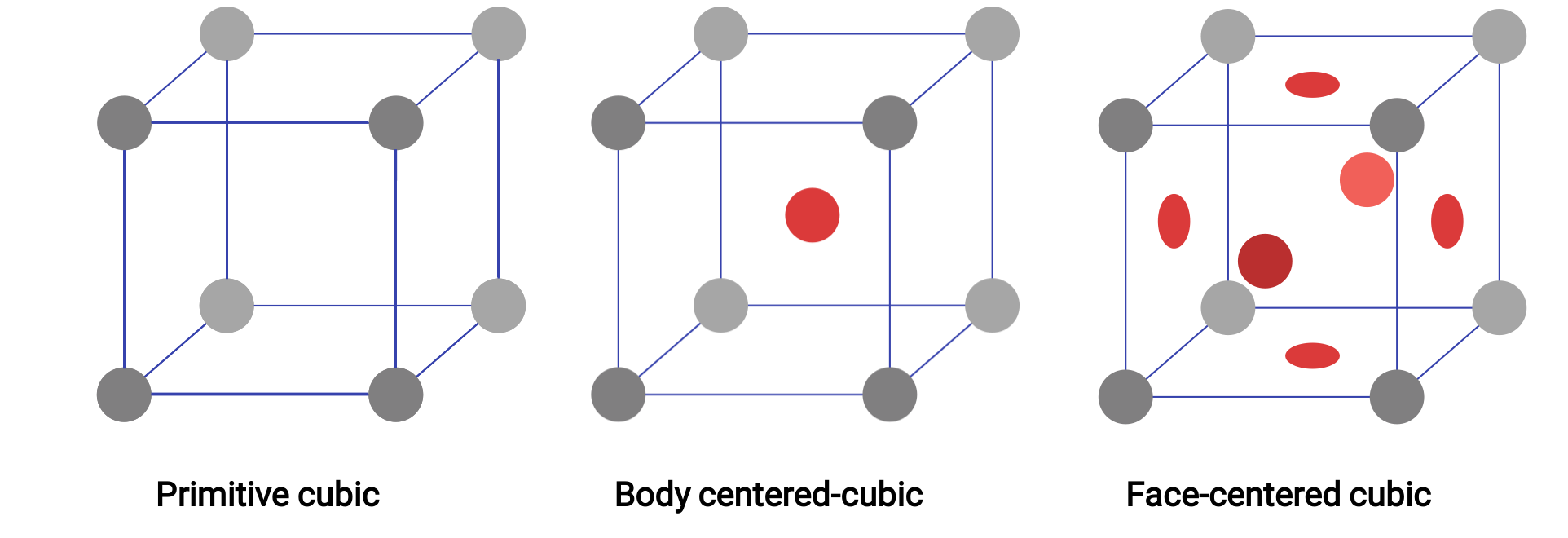
Figura 1. Três estruturas cristalinas reticulares diferentes exibidas pelos sistemas reticulares cúbicos.
Em um retículo cúbico primitivo, a célula unitária que se repete em todas as direções é um cubo definido pelos centros de oito átomos. Os átomos nos cantos adjacentes desta célula unitária entram em contacto entre si, pelo que uma célula unitária cúbica contém apenas as partes destes átomos que estão dentro dela. Uma vez que um átomo em um canto de uma célula unitária cúbica simples é contido por um total de oito células unitária, apenas um oitavo desse átomo está dentro de uma célula unitária específica. E como cada célula unitária cúbica simples tem um átomo em cada um dos seus oito “cantos”, há 8 × 1/8= 1 átomo dentro de uma célula unitária cúbica simples.
Alguns metais cristalizam em um arranjo que tem uma célula unitária cúbica com átomos em todos os cantos e um átomo no centro. Isto é chamado um sólido cúbico de corpo centrado (BCC). Os átomos nos cantos de uma célula unitária BCC não entram em contacto uns com os outros, mas entram em contacto com o átomo no centro. Uma célula unitária BCC contém dois átomos: um oitavo de um átomo em cada um dos oito cantos (8 × 1/8= 1 átomo dos cantos) mais um átomo do centro. Qualquer átomo nessa estrutura toca em quatro átomos na camada acima dela e quatro átomos na camada abaixo dela. Assim, um átomo em uma estrutura BCC tem um número de coordenação de oito. Os átomos nos arranjos BCC estão compactados muito mais eficazmente do que em uma estrutura cúbica simples, ocupando aproximadamente 68% do volume total.
Muitos outros metais cristalizam em um arranjo que tem uma célula unitária cúbica com átomos em todos os cantos e nos centros de cada face. Este arranjo é chamado de sólido cúbico centrado na face (FCC). Uma célula unitária FCC contém quatro átomos: um oitavo de um átomo em cada um dos oito cantos (8 × 1/8= 1 átomo dos cantos) e uma metade de um átomo em cada uma das seis faces (6 × 1/2= 3 átomos das faces). Os átomos nos cantos tocam nos átomos nos centros das faces adjacentes ao longo das diagonais da face do cubo. Como os átomos estão em pontos reticulares idênticos, eles têm ambientes idênticos. Os átomos em um arranjo FCC estão compactados o mais próximo possível, com átomos a ocupar 74% do volume. Cada átomo entra em contacto com seis átomos na sua própria camada, três na camada acima, e três na camada abaixo. Neste arranjo, cada átomo toca em 12 vizinhos próximos e, portanto, tem um número de coordenação de 12.
Este texto foi adaptado de Openstax, Chemistry 2e, Sections 10.5 The Solid State of Matter, e 10.6 Lattice Structures in Crystalline Solids.


