16.6: Кривые кислотно-основного титрования
Кривая титрования представляет собой график некоторого свойства раствор в сравнении с количеством добавленного титранта. Для титрования кислотно-основная pH раствор является полезным свойством для мониторинга, поскольку он предсказуемо меняется в зависимости от состава раствор и, следовательно, может использоваться для мониторинга прогресса титрования и определения его конечной точки. Титрование кислотно-основная можно выполнять с сильной кислотой и сильным основание, сильной кислотой и слабым основание, или сильным основание и слабой кислотой.
При титровании, выполненном для 25.00 мл 0.100 M HCl (сильная кислота) с 0.100 M сильного основание NaOH, его кривая титрования показана красным цветом на рисунке 1a. При титровании, выполненном для 25.00 мл 0.100 M CH3COOH (слабая кислота) с 0.100 M NaOH, кривая титрования показана желтым цветом на рис. 1b.
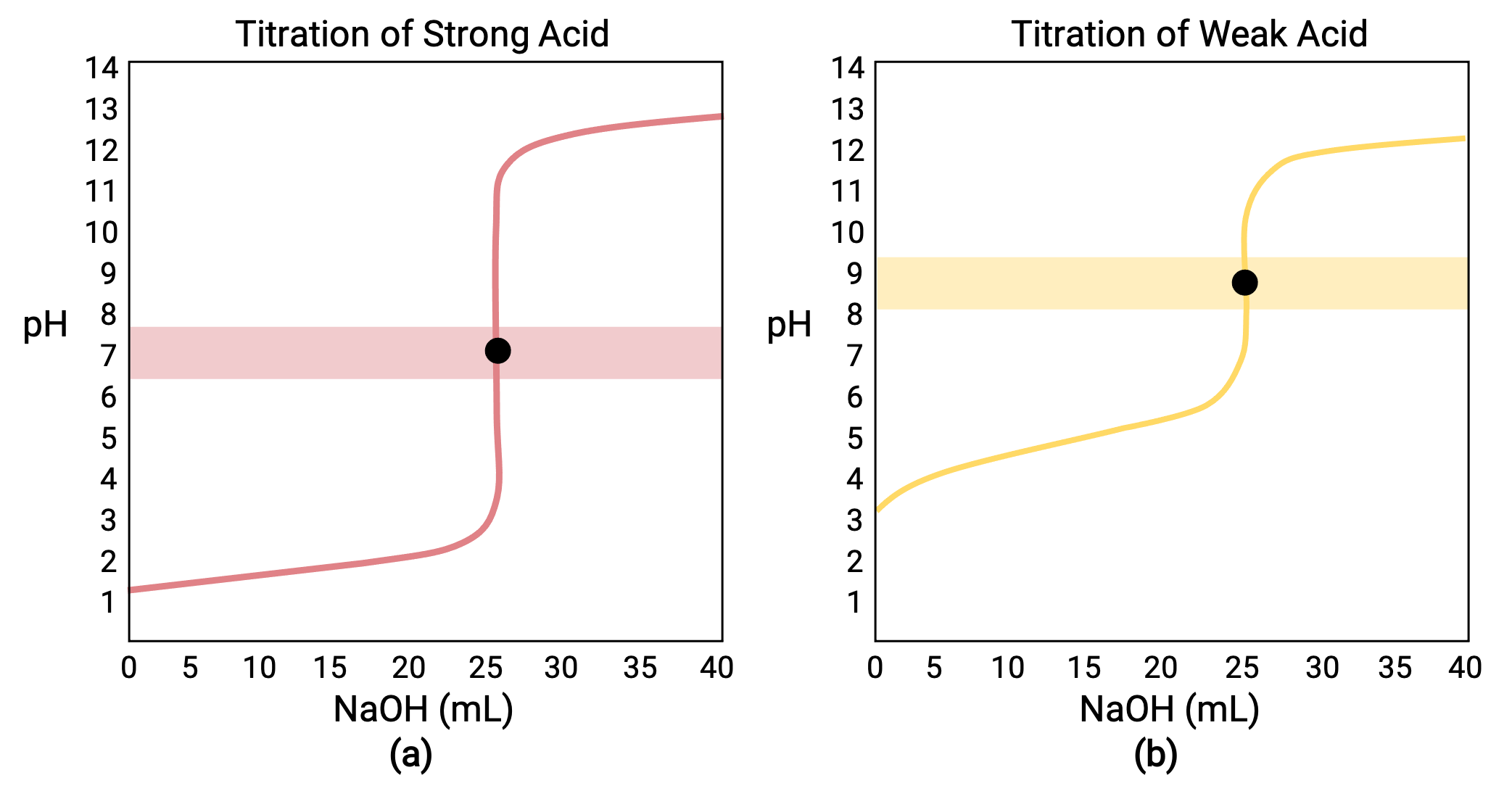
Рисунок 1 (A) Титровальная кривая титрования 25.00 мл 0.100 M HCl (сильная кислота) с 0.100 M NaOH (strong основание) имеет эквивалентную точку 7.00 pH. (b) кривая титрования для титрования 25.00 мл уксусной кислоты 0.100 м (слабая кислота) с 0.100 M NaOH (strong основание) имеет эквивалентную точку 8.72 pH.
Титрование сильного или слабого основание с сильной кислотой имеет аналогичную S-образную кривую, однако кривая инвертируется, так как pH начнет в основной области и уменьшится с добавлением сильной кислоты. Титрование слабой кислоты или основание также можно использовать для определения Ка или Кбайт соответственно.
Четыре этапа титрования:
- Начальное состояние (добавленный объем титранта = 0 мл): PH определяется титрированной кислотой; поскольку два образца кислоты равномерно сконцентрированы, слабая кислота будет демонстрировать больший начальный pH
- Точка предварительной эквивалентности (0 мл < V < 25 мл): PH раствор постепенно увеличивается, и кислота потребляется реакцией с добавлением титранта; состав включает в себя непрореагированные кислоты и реакционный продукт, его конъюгатный основание
- Точка эквивалентности (V = 25 мл): Резкое повышение pH наблюдается по мере перехода состава раствор от кислого к нейтральному (для образца с сильной кислотой) или основному (для образца с слабой кислотой), при котором pH определяется ионизацией конъюгатного основание кислоты
- Точка пост-эквивалентности (V > 25 мл): PH определяется количеством сверхсильного титранта основание; так как оба образца титруются одним титрантом, на этом этапе обе кривые титрования выглядят одинаково.
Этот текст адаптирован из Openstax, Химия 2е изд., раздел 14.7: Кислотно-основное титрование.


