20.1: Geçiş Metallerinin Özellikleri
Geçiş metalleri, d orbitallerini kısmen dolduran elementler olarak tanımlanır. Şekil 1'de gösterildiği gibi, grup 3–12'deki d-blok elemanları geçiş elemanlarıdır. İç geçiş metalleri (lantanitler ve aktinitler) olarak da adlandırılan f-blok elemanları da bu kriteri karşılar, çünkü d orbital kısmen f orbitallerinden önce işgal edilir.
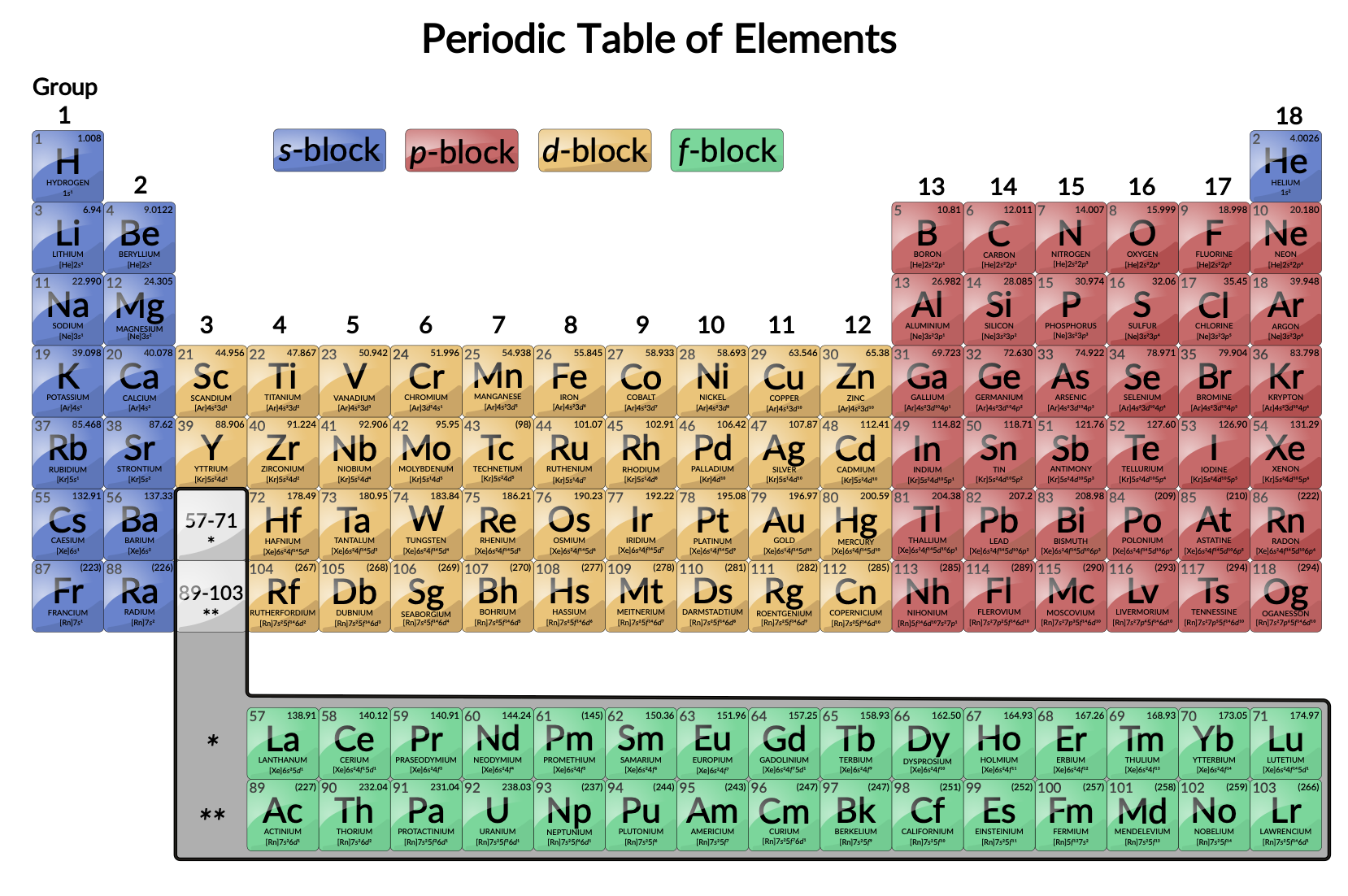
Şekil 1: Periyodik Tablo. Geçiş metalleri periyodik tablonun 3–11 numaralı gruplarında bulunur. İç geçiş metalleri tablonun gövdesinin altındaki iki satırdadır.
d-blok elemanları ilk geçiş serisine (Sc'den Cu'ya kadar olan elemanlar), ikinci geçiş serisine (Y'den Ag'ye kadar olan elemanlar) ve üçüncü geçiş serisine (la elemanı ve Hf'den Au'ya kadar olan elemanlar) ayrılır. Aktinyum, Ac, Rg ile Rf'yi de içeren dördüncü geçiş serisinin ilk üyesidir.
f-blok elemanları, lantanit serisini (veya lantanoid serisini) oluşturan Lu'dan Ce elementleri ve aktinit serisini (veya aktinoid serisini) oluşturan Lr'den Th’ye kadar olan elementlerdir. Lantan, lantanit elementlerine çok benzediğinden, elektron konfigürasyonu onu üçüncü geçiş serisinin ilk üyesi haline getirse de bir lantanit elementi olarak kabul edilir. Benzer şekilde, aktiniyumun davranışı, elektron konfigürasyonu onu dördüncü geçiş serisinin ilk üyesi yapmasına rağmen, aktinit serisinin bir parçası olduğu anlamına gelir.
Geçiş elemanları diğer metallerle ortak birçok özelliğe sahiptir. Bunlar, ısı ve elektriği iyi ileten hemen hemen tümü sert, yüksek erime noktalı katılardır. Kolayca alaşımlar oluştururlar ve kararlı katyonlar oluşturmak için elektronları kaybederler. Ek olarak, geçiş metalleri, merkezi metal atomunun veya iyonunun bir Lewis asidi olarak hareket ettiği ve bir veya daha fazla elektron çiftini kabul ettiği çok çeşitli kararlı koordinasyon bileşikleri oluşturur. Birçok farklı molekül ve iyon, Lewis bazları olarak hizmet eden metal merkeze yalın çiftler bağışlayabilir.
Geçiş Elementlerinin Özellikleri
Geçiş metalleri çok çeşitli kimyasal davranışlar gösterir. Bazı geçiş metalleri güçlü indirgeyici ajanlardır, diğerleri ise çok düşük reaktiviteye sahiptir. Örneğin, tüm lantanitler kararlı +3 sulu katyonlar oluşturur. Bu tür oksidasyonların itici gücü, Be+2 ve Mg+2 oluşturan Be veya Mg gibi alkali toprak metallerininkine benzerdir. Öte yandan, platin ve altın gibi malzemeler çok daha yüksek indirgeme potansiyellerine sahiptir. Oksidasyona direnme yetenekleri, onları devreler ve mücevherler oluşturabilecek yararlı malzemeler haline getirir.
Cr+3, Fe+3 ve Co+2 gibi daha hafif d-blok elementlerinin iyonları, suda stabil olan renkli hidratlanmış iyonlar oluşturur. Bununla birlikte, bunların hemen altındaki iyonlar (Mo+3, Ru+3 ve Ir+2) dengesizdir ve havadan oksijen ile kolayca reaksiyona girer. Daha ağır d-blok elementleri tarafından oluşturulan basit, suya dayanıklı iyonların çoğu, MoO42− ve ReO4− gibi oksianyonlardır.
Rutenyum, osmiyum, rodyum, iridyum, paladyum ve platin, platin-grubu metalleridir. Zorlukla, suda stabil olan basit katyonlar oluştururlar ve ikinci ve üçüncü geçiş serilerindeki önceki elementlerin aksine, kararlı oksianyonlar oluşturmazlar.
Hem d-hem de f-blok elemanları, ikili bileşikler oluşturmak için ametallerle reaksiyona girer; genellikle ısıya ihtiyaç duyulur. Bu elementler, oksidasyon durumunda +1 ila +6 arasında değişen çeşitli halojenler oluşturmak için halojenlerle reaksiyona girer. Isıtıldığında, oksijen paladyum, platin, gümüş ve altın dışındaki tüm geçiş elemanları ile reaksiyona girer. Bu son metallerin oksitleri diğer reaktanlarla oluşturulabilir, ancak ısıtıldığında ayrışırlar. f-blok elemanları, grup 3'ün elemanları ve bakır dışındaki ilk geçiş serisinin elemanları, sulu asit çözeltileri ile reaksiyona girerek hidrojen gazı ve ilgili tuzların çözeltilerini oluşturur.
Geçiş metalleri çok çeşitli oksidasyon durumlarına sahip bileşikler oluşturabilir. İlk geçiş serisinin elementlerinin gözlenen oksidasyon durumlarından bazıları Tablo 1'de gösterilmiştir. İlk geçiş serisinde soldan sağa doğru hareket ederek, ortak oksidasyon durumlarının sayısı ilk önce tablonun ortasına doğru maksimuma çıkar, sonra azalır. Tablodaki değerler tipik değerlerdir; bilinen başka değerler de vardır ve yeni eklemeleri sentezlemek mümkündür. Örneğin, 2014 yılında araştırmacılar yeni bir iridyum oksidasyon durumunu (+9) sentezlemede başarılı olmuşlardır.
| 21 Sc | 22 Ti | 23 V | 24 Cr | 25 Mn | 26 Fe | 27 Co | 28 Ni | 29 Cu | 30 Zn |
| +1 | |||||||||
| +2 | +2 | +2 | +2 | +2 | +2 | +2 | +2 | ||
| +3 | +3 | +3 | +3 | +3 | +3 | +3 | +3 | +3 | |
| +4 | +4 | +4 | +4 | ||||||
| +5 | |||||||||
| +6 | +6 | +6 | |||||||
| +7 |
Tablo 1. İlk geçiş serisinin geçiş metalleri, farklı oksidasyon durumlarına sahip bileşikler oluşturabilir.
Skandiyumdan Manganeze kadar olan elementler için (ilk geçiş serisinin ilk yarısı), en yüksek oksidasyon durumu, değerlik kabuklarının hem s hem de d orbitallerindeki tüm elektronların kaybına karşılık gelir. Örneğin, titanyum (IV) iyonu, titanyum atomu iki 3d ve iki 4s elektronunu kaybettiğinde oluşur. Bu en yüksek oksidasyon durumları, skandiyum, titanyum ve vanadyumun en kararlı formlarıdır. Bununla birlikte, seri boyunca devam ettikçe tüm değerlik elektronlarını metallerden çıkarmaya devam etmek mümkün değildir. Demirin +2'den +6'ya kadar oksidasyon durumları oluşturduğu bilinmektedir, demir(II) ve demir(III) en yaygın olanıdır. İlk geçiş serisinin elemanlarının çoğu, suda stabil olan +2 veya +3'lük bir yüke sahip iyonlar oluşturur, ancak serinin erken üyelerininki hava ile kolayca oksitlenebilir.
İkinci ve üçüncü geçiş serilerinin elemanları genellikle birinci serinin elementlerinden daha yüksek oksidasyon durumlarında daha kararlıdır. Genel olarak, atom yarıçapı bir gruptan aşağı doğru artar, bu da ikinci ve üçüncü serilerin iyonlarının ilk serilerdekilerden daha büyük olmasına neden olur. Elektronları çekirdekten daha uzakta bulunan orbitallerden çıkarmak, çekirdeğe yakın elektronları çıkarmaktan daha kolaydır. Örneğin, grup 6'nın üyeleri olan molibden ve tungsten, çoğunlukla sulu çözeltide +6 oksidasyon durumuyla sınırlıdır. Grubun en hafif üyesi olan krom, suda kararlı Cr+3 iyonları ve hava yokluğunda daha az kararlı Cr+2 iyonları oluşturur. Krom için en yüksek oksidasyon durumuna sahip sülfit, Cr+3 iyonunu içeren Cr2S3'tür. Molibden ve tungsten, metallerin +4 ve +6 oksidasyon durumları sergilediği sülfitler oluşturur.
Geçiş metalleri tarafından sergilenen özelliklerin çeşitliliği, karmaşık değerlik kabuklarından kaynaklanmaktadır. Bir oksidasyon durumunun normal olarak gözlemlendiği çoğu ana grup metalden farklı olarak, geçiş metallerinin değerlik kabuğu yapısı, genellikle birkaç farklı kararlı oksidasyon durumunda meydana geldikleri anlamına gelir. Ek olarak, bu elementlerdeki elektron geçişleri, görünür elektromanyetik spektrumdaki fotonların emilimine karşılık gelebilir ve bu da renkli bileşiklere yol açabilir. Bu davranışlardan dolayı, geçiş metalleri zengin ve büyüleyici bir kimya sergilerler.
Bu metin bu kaynaktan uyarlanmıştır: Openstax, Chemistry 2e, Chapter 19.1 Occurrence, Preparation, and Properties of Transition Metals and Their Compounds.


