20.8: Théorie du champ cristallin - complexes octaédriques
Théorie du champ cristallin
Pour expliquer le comportement observé des complexes de métaux de transition (tels que les couleurs), un modèle a été conçu, impliquant des interactions électrostatiques entre les électrons des ligands et les électrons sur les orbitales d non hybridées de l'atome métallique central. Ce modèle électrostatique est la théorie du champ cristallin (TCC). Il permet de comprendre, d'interpréter et de prévoir les couleurs, le comportement magnétique et certaines structures des composés de coordination des métaux de transition.
La TCC se concentre sur les électrons non-liants de l'ion métallique central dans les complexes de coordination, et non sur les liaisons métal-ligand. Comme la théorie de la liaison de valence, la TCC ne raconte qu'une partie de l'histoire du comportement des complexes. Dans sa forme pure, la TCC ignore tout lien covalent entre les ligands et les ions métalliques. Le ligand et le métal sont tous deux traités comme des charges ponctuelles infiniment petites.
Tous les électrons sont négatifs, de sorte que les électrons donnés par les ligands repoussent les électrons du métal central. Considérons le comportement des électrons dans les orbitales d non hybridées d'un complexe octaédrique. Les cinq orbitales d sont constituées de régions en forme de lobe et sont disposées dans l'espace, comme illustré dans la figure 1. Dans un complexe octaédrique, les six ligands sont coordonnés le long des axes.
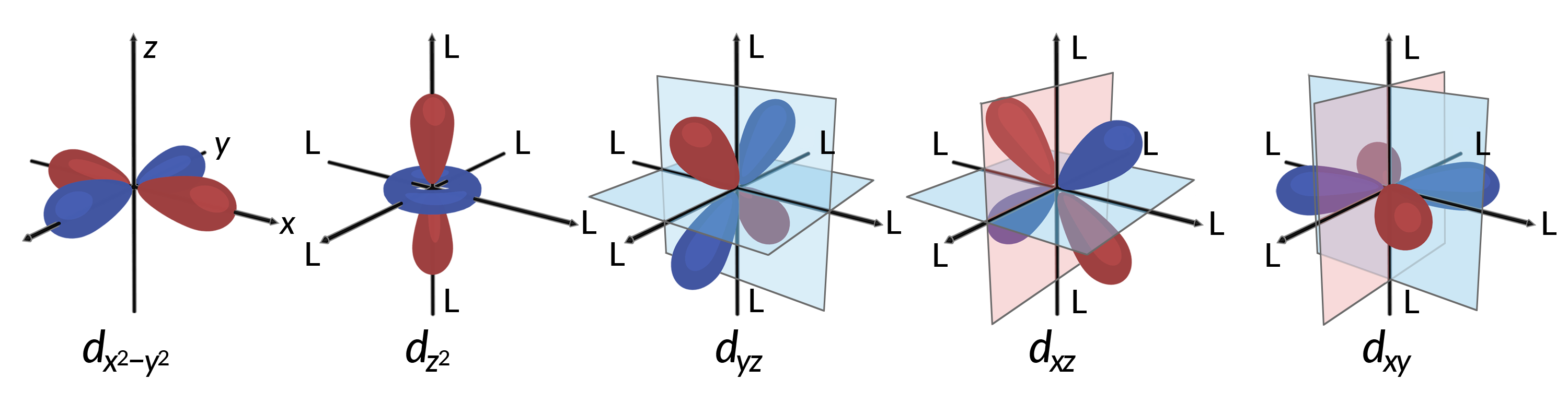
Figure 1. Les caractéristiques directionnelles des cinq orbitales d sont indiquées ici. Les parties ombrées indiquent la phase des orbitales. Les ligands (L) se coordonnent le long des axes dans les complexes octaédriques. Pour plus de clarté, les ligands ont été omis de l'orbitale dx2−y2 de sorte que les libellés des axes puissent être affichés.
Dans un ion métallique non complexé en phase gazeuse, les électrons sont répartis entre les cinq orbitales d en accord avec la règle de Hund car les orbitales ont toutes la même énergie. Dans les complexes de métaux de transition, les énergies des orbitales d des atomes de métaux de transition sont influencées par le type de ligands et la géométrie moléculaire. Si les molécules de ligand sont disposées uniformément autour de l'ion métallique, un champ cristallin sphérique est créé. Ce champ cristallin sphérique élève les énergies des orbitales d de l'ion métallique d'une quantité égale (figure 2). Lorsque les ligands sont coordonnés par rapport à un ion métallique dans une géométrie octaédrique, les énergies des orbitales d ne sont plus les mêmes.
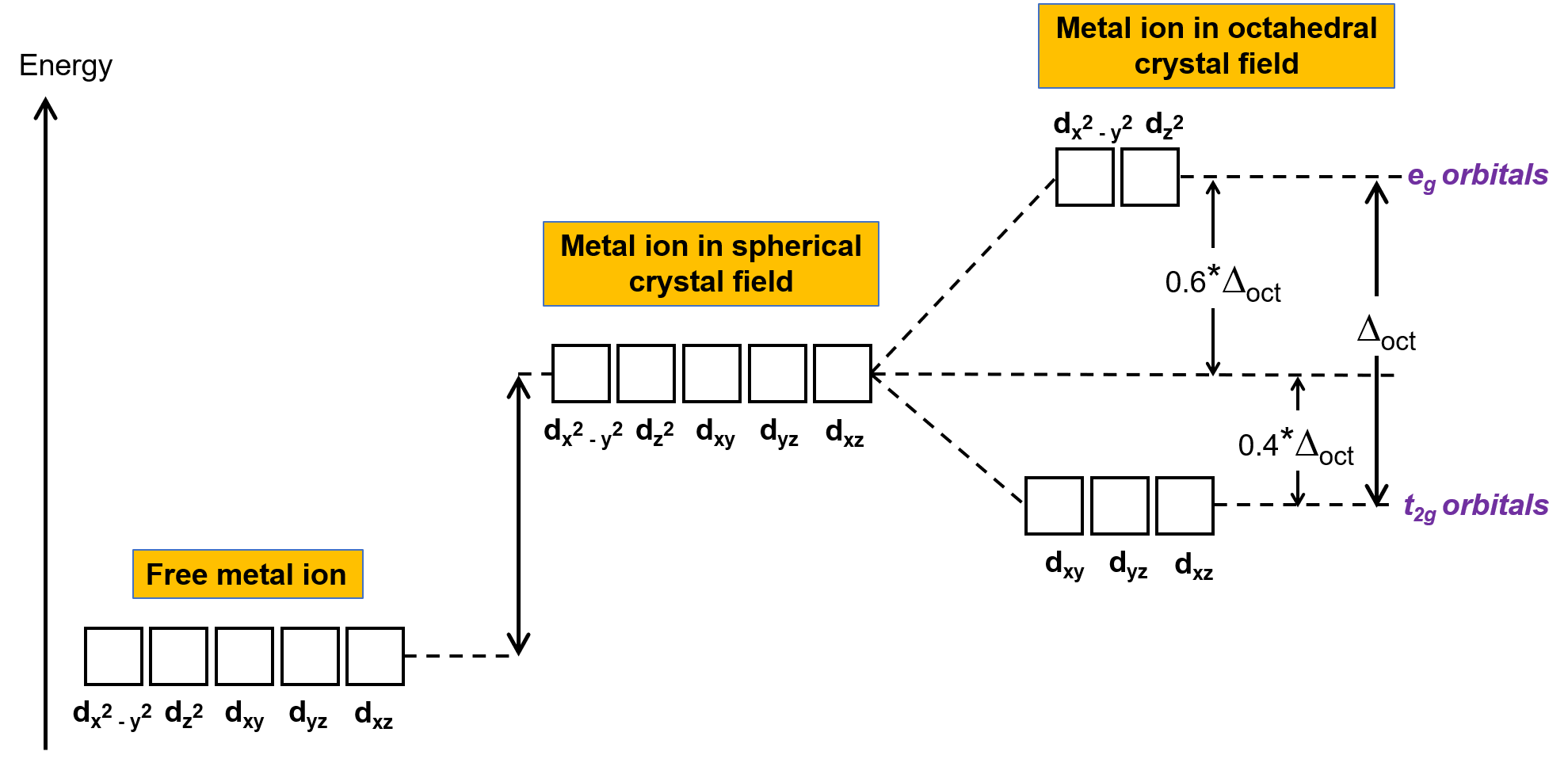
Figure 2. Les orbitales d de l'ion métallique dans un champ cristallin sphérique sont déstabilisées (plus haute en énergie) par rapport aux orbitales d de l'ion métallique libre non complexé. Dans les complexes octaédriques, les orbitales eg sont plus déstabilisées (plus haute en énergie) que les orbitales t2g parce que les ligands interagissent plus fortement avec les orbitales d vers lesquelles ils sont directement dirigés.
Dans les complexes octaédriques, les lobes de deux des cinq orbitales d, les orbitales dx2−y2 et dz2, pointent vers les ligands (figure 1). Ces deux orbitales sont appelées les orbitales eg (le symbole fait référence à la symétrie des orbitales). Les trois autres orbitales, les orbitales dxy, dxz et dyz, ont des lobes qui pointent entre les ligands et sont appelés des orbitales t2g (là encore, le symbole fait référence à la symétrie des orbitales). Lorsque six ligands s'approchent de l'ion métallique le long des axes de l'octaèdre, leurs charges ponctuelles repoussent les électrons dans les orbitales d de l'ion métallique. Cependant, les répulsions entre les électrons dans les orbitales eg (orbitales dx2-y2) et les ligands sont supérieures aux répulsions entre les électrons dans les orbitales t2g (orbitales dxy, dxz et dyz) et les ligands. C'est parce que les lobes des orbitales eg pointent directement vers les ligands, alors que les lobes des orbitales t2g pointent entre eux. Ainsi, les électrons dans les orbitales eg de l'ion métallique dans un complexe octaédrique ont des énergies potentielles plus élevées que celles des électrons dans les orbitales t2g. La différence d'énergie peut être représentée comme le montre la figure 2.
La différence d'énergie entre les orbitales eg et t2g est appelée dédoublement du champ cristallin et elle est symbolisée par Δoct, où oct signifie octaédrique. L'intensité de Δoct dépend de nombreux facteurs, y compris la nature des six ligands situés autour de l'ion métallique central, la charge sur le métal, et si le métal utilise des orbitales 3d, 4d ou 5d. Différents ligands produisent des dédoublements du champ cristallin différents. Le dédoublement croissant du champ cristallin produit par les ligands est exprimé dans la série spectrochimique, dont une version courte est donnée ici :
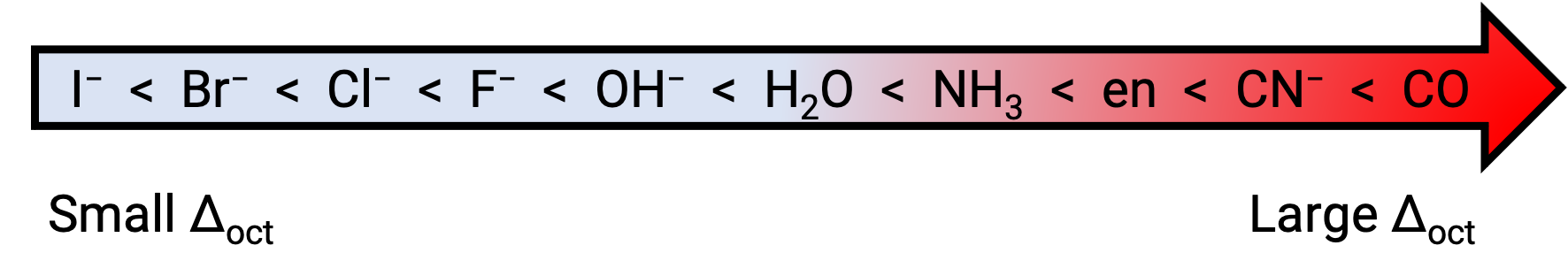
Ce texte est adapté de Openstax, Chimie 2e, Section:19.3 : Propriétés spectroscopiques et magnétiques des composés de coordination.


