20.9: Théorie du champ cristallin - complexes tétraédriques et complexes plans carrés
Complexes tétraédriques
La théorie du champ cristallin (TCC) s'applique aux molécules dans des géométries autres que la géométrie octaédrique. Dans les complexes octaédriques, les lobes des orbitales dx2−y2 et dz2 pointent directement vers les ligands. Pour les complexes tétraédriques, les orbitales d restent en place, mais avec seulement quatre ligands situés entre les axes. Aucune des orbitales ne pointe directement vers les ligands tétraédriques. Cependant, les orbitales dx2−y2 et dz2 (le long des axes cartésiens) se recouvrent moins avec les ligands que les orbitales dxy, dxz et dyz. Par analogie avec le cas octaédrique, on peut prévoir le diagramme énergétique pour les orbitales d dans un champ cristallin tétraédrique comme le montre la figure 1. Pour éviter toute confusion, l'ensemble octaédrique eg devient un ensemble tétraédrique e, et l'ensemble octaédrique t2g devient un ensemble t2.
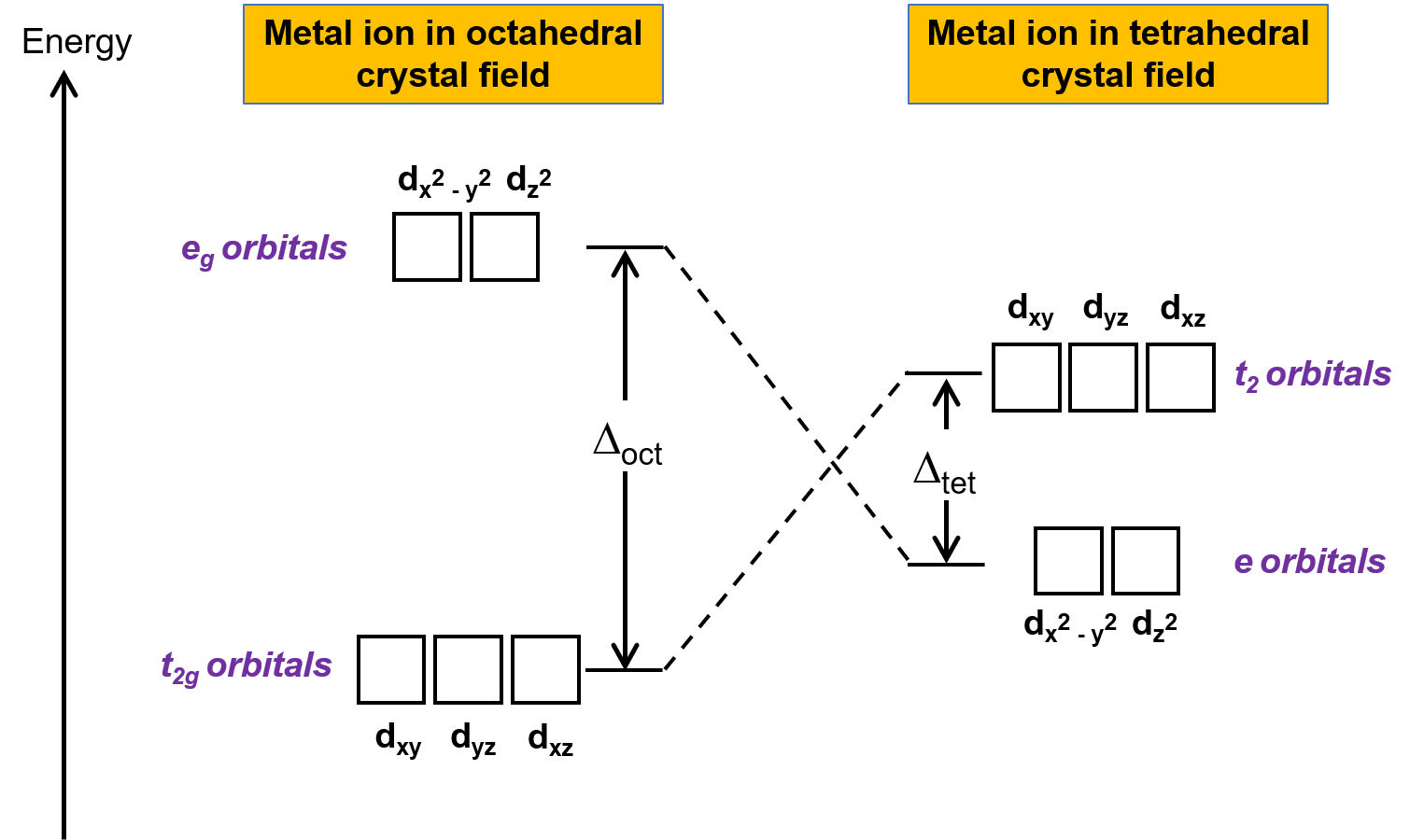
Figure 1. Dédoublement des orbitales d de l'ion métallique dans les cas de champs cristallins octaédrique et tétraédrique. Par rapport au champ cristallin octaédrique, le mode de dédoublement du champ cristallin tétraédrique est inversé. L'énergie de dédoublement du champ cristallin du complexe octaédrique, ou Δoct, est plus grande que l'énergie de dédoublement du champ cristallin du complexe tétraédrique, Δtét .
Puisque la TCC est basée sur la répulsion électrostatique, les orbitales qui se trouvent plus prés des ligands seront déstabilisées et élevées en énergie par rapport à l'autre ensemble d'orbitales. Le dédoublement est inférieur à celui des complexes octaédriques car le recouvrement est inférieur, et donc l'énergie de dédoublement du champ cristallin, ou Δtét, est généralement petite.
Complexes plans carrés
L'autre géométrie courante est plane carrée. Il est possible de considérer une géométrie plane carrée comme une structure octaédrique de laquelle une paire de ligands trans a été enlevée. Les ligands retirés sont supposés être sur l'axe des z. Cela modifie la distribution des orbitales d, car les orbitales sur ou près de l'axe z deviennent plus stables, et celles sur ou près des axes x ou y deviennent moins stables. Cela entraîne le dédoublement des ensembles t2g et eg octaédriques et donne un schéma de dédoublement plus compliqué (figure 2).
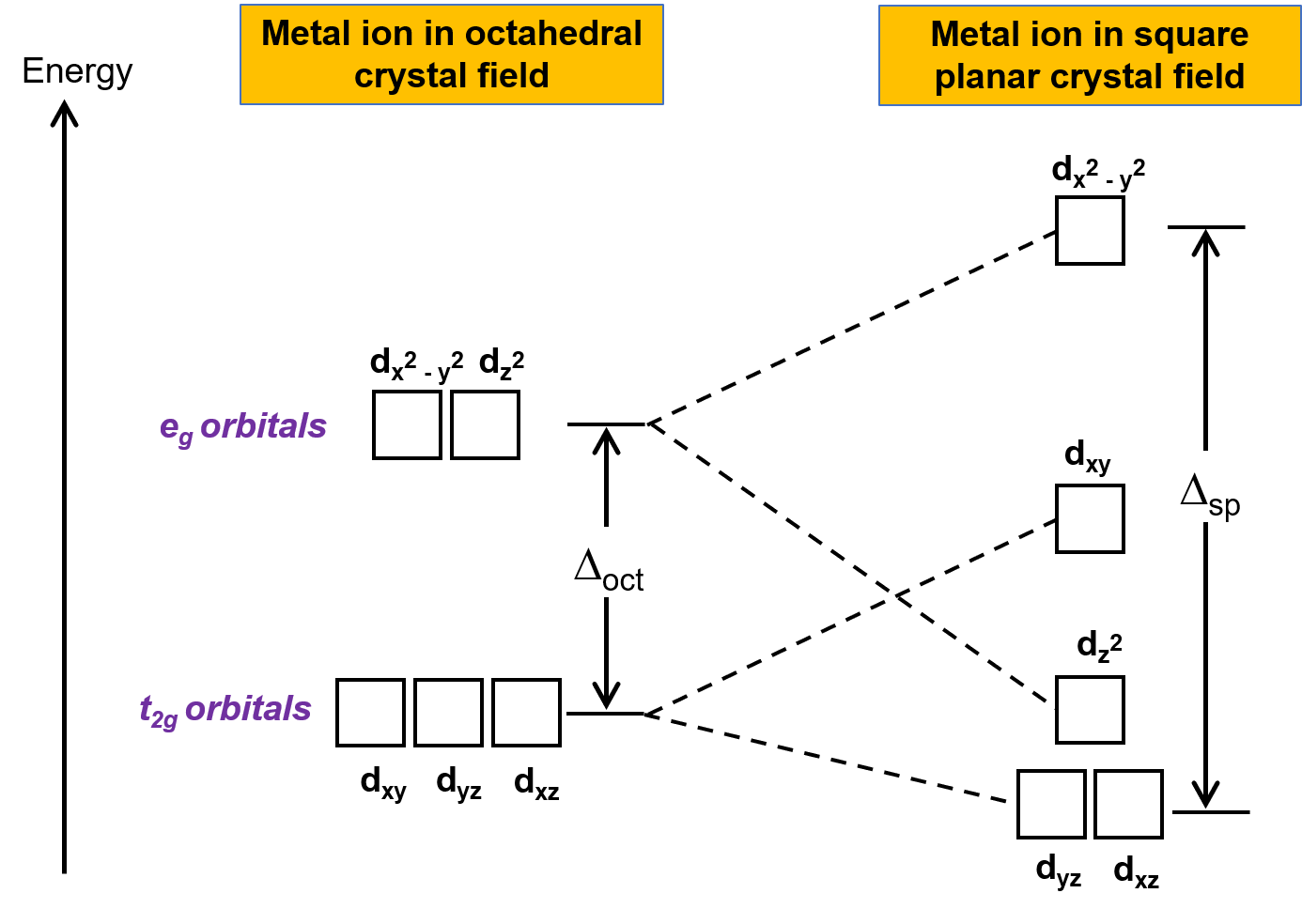
Figure 2. Dédoublement de l'ensemble t2g et de l'ensemble eg d'orbitales dans un champ cristallin plan carré. L'énergie de dédoublement du champ cristallin des complexes plans carrés Δpc est plus grande que Δoct.
Ce texte est adapté de Openstax, Chimie 2e, Section 19.3 : Propriétés spectroscopiqueset magnétiques des composés de coordination.


