20.9: Teoría del Campo Cristalino - Complejos Tetraédricos y Cuadrados Planos
Complejos tetraédricos
La teoría del campo de cristal (TCC) es aplicable a moléculas de geometrías distintas de la octaédrica. En los complejos octaédricos, los lóbulos de los orbitales dx2−y2 and dz2 apuntan directamente a los ligandos. Para los complejos tetraédricos, los orbitales d permanecen en su lugar, pero con sólo cuatro ligandos ubicados entre los ejes. Ninguno de los orbitales apunta directamente a los ligandos tetraédricos. Sin embargo, los orbitales dx2−y2 (a lo largo de los ejes cartesianos) se superponen con los ligandos menos que los orbitales dxy, dxz, y dyz Por analogía con el caso octaédrico, el diagrama de energía para los orbitales d en un campo cristalino tetraédrico puede predecirse como se muestra en la Figura 1. Para evitar confusiones, el conjunto octaédrico eg se convierte en un conjunto tetraédrico e, y el conjunto octaédrico t2g se convierte en un conjunto t2.
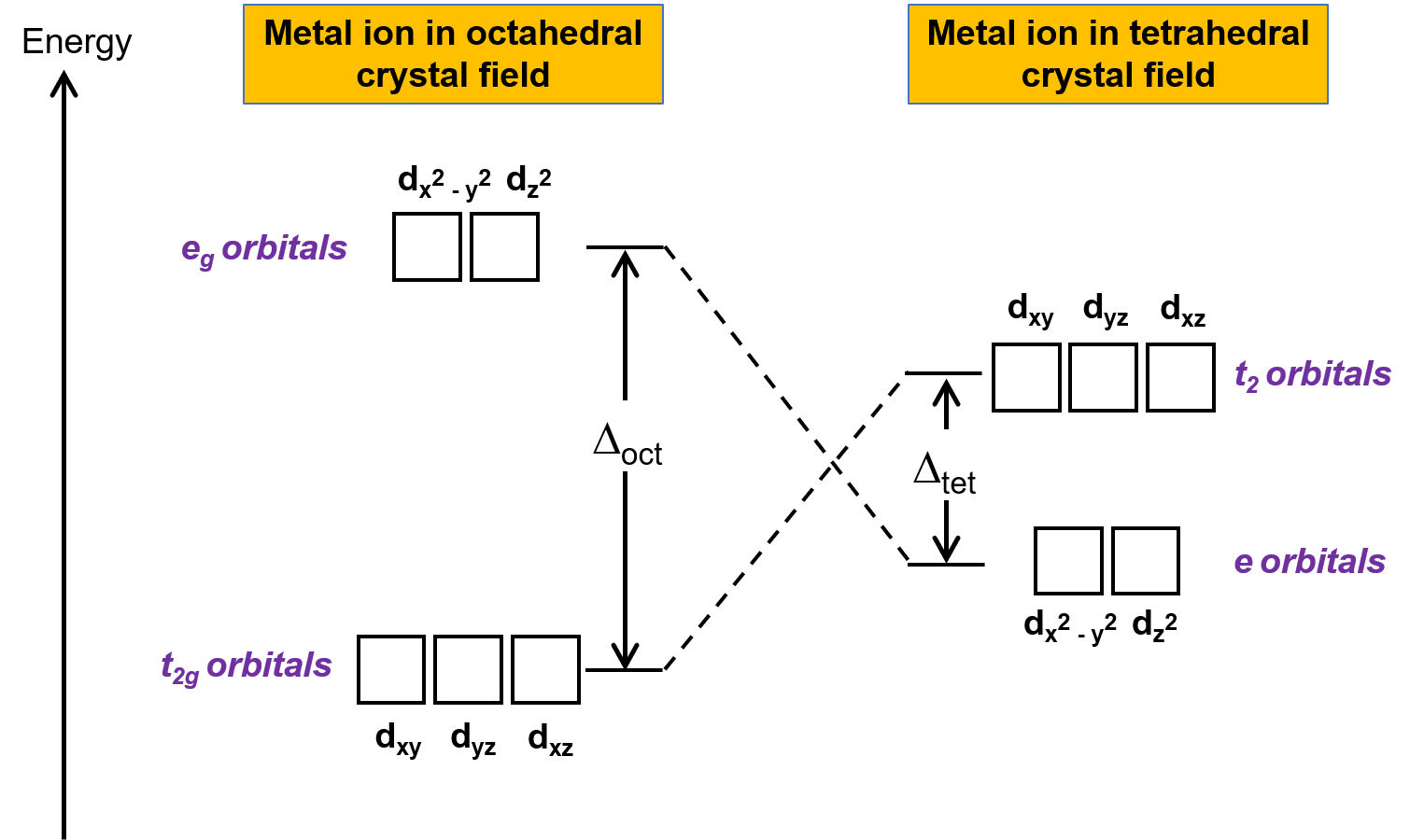
Figura 1.División de los orbitales d del ion metal bajo campos cristalinos octaédricos y tetraédricos. En comparación con el campo cristalino octaédrico, en el campo cristalino tetraédrico se invierte el patrón de división. El campo cristalino que divide la energía del complejo octaédrico, o Δoct, es más grande que el campo cristalino que divide la energía del complejo tetraédrico, Δtet.
Puesto que la TCC se basa en la repulsión electrostática, los orbitales más cercanos a los ligandos serán desestabilizados y aumentados en energía en relación con el otro conjunto de orbitales. La división es menor que para los complejos octaédricos porque el solapamiento es menor, por lo que el campo cristalino que divide la energía, o Δtet es generalmente pequeño.
Complejos cuadrados planos
La otra geometría común es cuadrada plana. Es posible considerar una geometría cuadrada plana como una estructura octaédrica con un par de ligandos trans eliminado. Se supone que los ligandos eliminados están en el eje z. Esto cambia la distribución de los orbitales d, a medida que los orbitales en o cerca del eje z se vuelven más estables, y aquellos en o cerca de los ejes x o y se vuelven menos estables. Esto resulta en el octaedro t2g y el eg establece la división y genera un patrón de división más complicado (Figura 2).
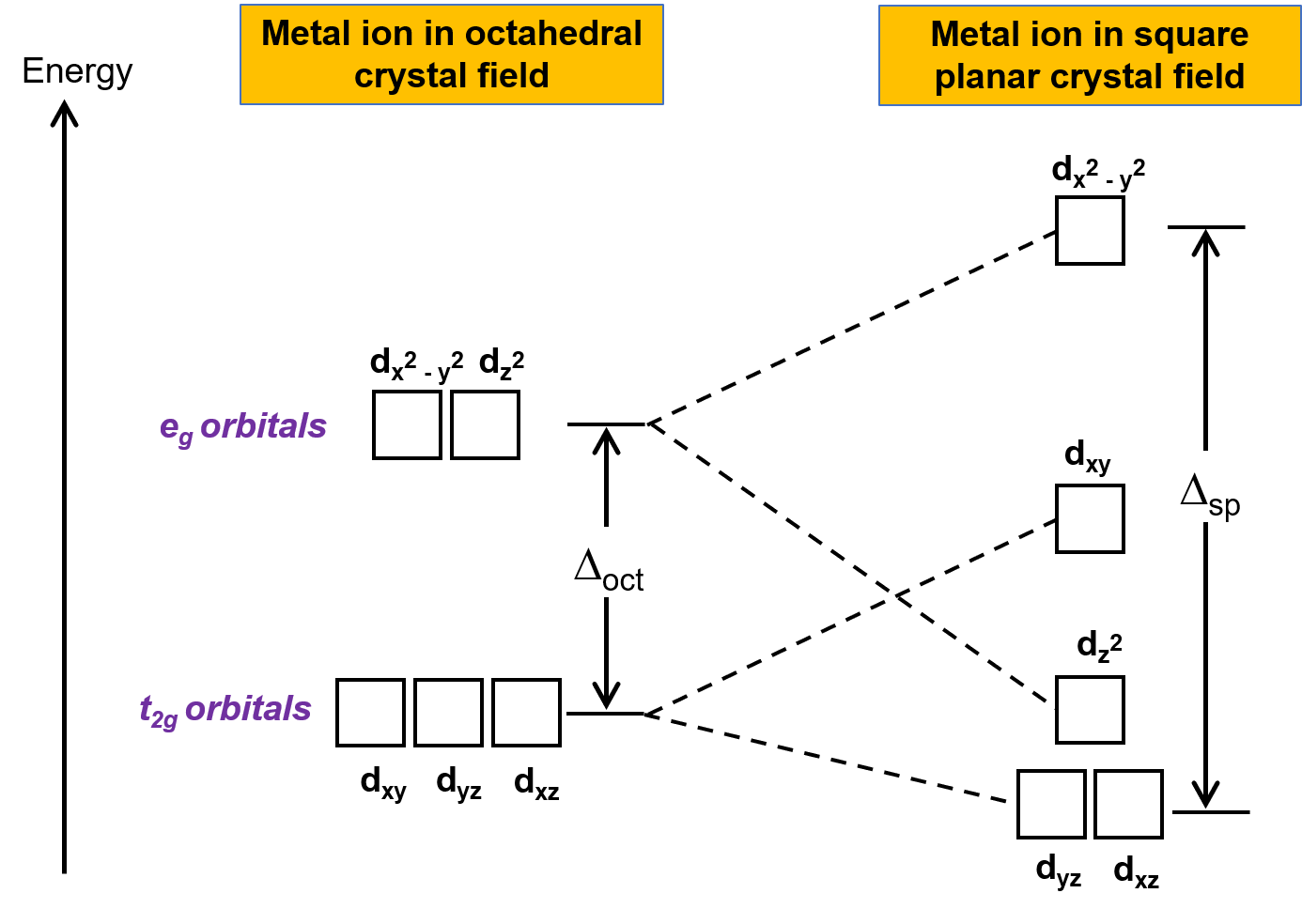
Figura 2.División del conjunto t2g y del conjunto de orbitales eg en un campo cristalino cuadrado plano. La energía de división del campo cristalino de los complejos planares cuadrados, o Δsp, es mayor que Δoct.
Este texto es adaptado de Openstax, Química 2e, Sección 19.3: Propiedades Espectroscópicas y Magnéticas de los Compuestos de Coordinación.


