14.7: Négliger le changement de concentration initiale
Si une réaction a une petite constante d'équilibre, la position d'équilibre favorise les réactifs. Dans de telles réactions, un changement négligeable de la concentration peut se produire si les concentrations initiales des réactifs sont élevées et que la valeur de Kc est faible. Dans de telles circonstances, la concentration à l'équilibre est approximativement égale à sa concentration initiale. Cette estimation peut être utilisée pour simplifier les calculs d'équilibre en supposant que certaines concentrations à l'équilibre sont égales aux concentrations initiales. Toutefois, pour faire cette supposition, le changement dans la concentration d'un acide ou d'une base faible, c'est-à-dire x, doit être inférieur à 5 % de sa concentration initiale. Si x est supérieur à 5 %, la formule quadratique doit être utilisée pour résoudre l'équation d'équilibre.
Calcul des concentrations à l'équilibre à l'aide d'une supposition de simplification algébrique
Quelles sont les concentrations à l'équilibre d'une solution de 0,15 M de HCN ?
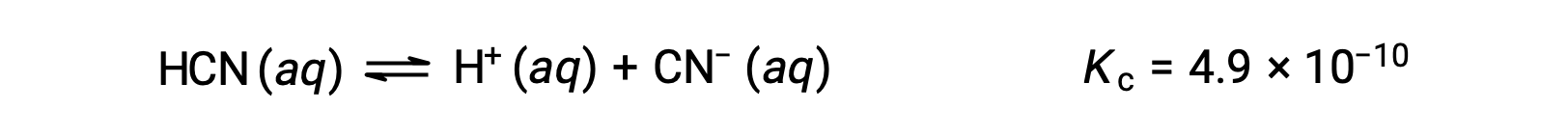
L'utilisation de x pour représenter la concentration de chaque produit à l'équilibre donne ce tableau ICE.
| HCN (aq) | H+ (aq) | CN− (aq) | |
| Concentration initiale (M) | 0,15 | 0 | 0 |
| Changement (M) | &8722;x | +x | +x |
| Concentration à l'équilibre (M) | 0,15 − x | x | x |
Remplacez les termes des concentrations à l'équilibre dans l'expression de Kc
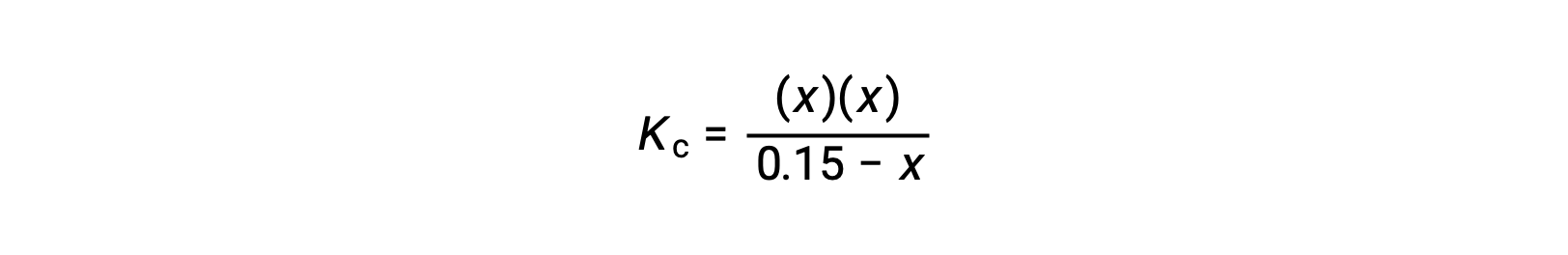
réorganisez la forme quadratique et résolvez pour trouver x
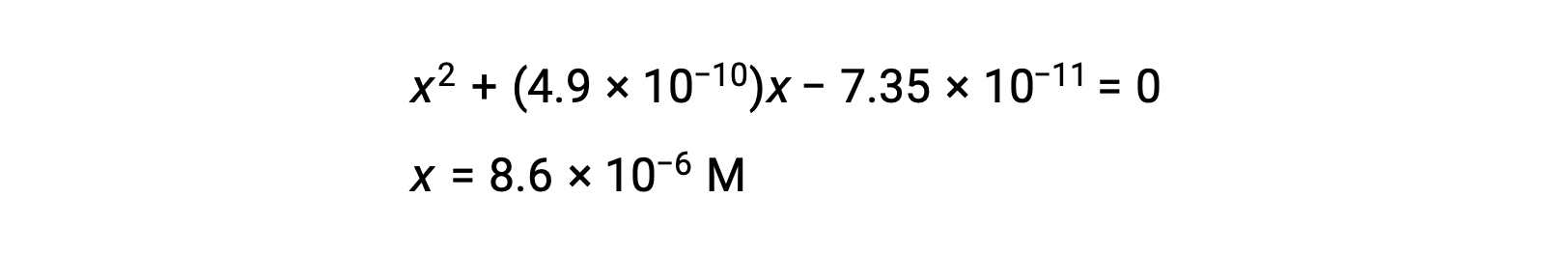
Ainsi, [H+] = [CN–] = x = 8,6 × 10–6 M et [HCN] = 0,15 – x = 0,15 M.
Notez dans ce cas que le changement de concentration est significativement inférieur à la concentration initiale (conséquence du petit K), et que la concentration initiale présente donc un changement négligeable :

Cette approximation permet une approche mathématique plus rapide du calcul qui évite la nécessité de résoudre les racines d'une équation quadratique :
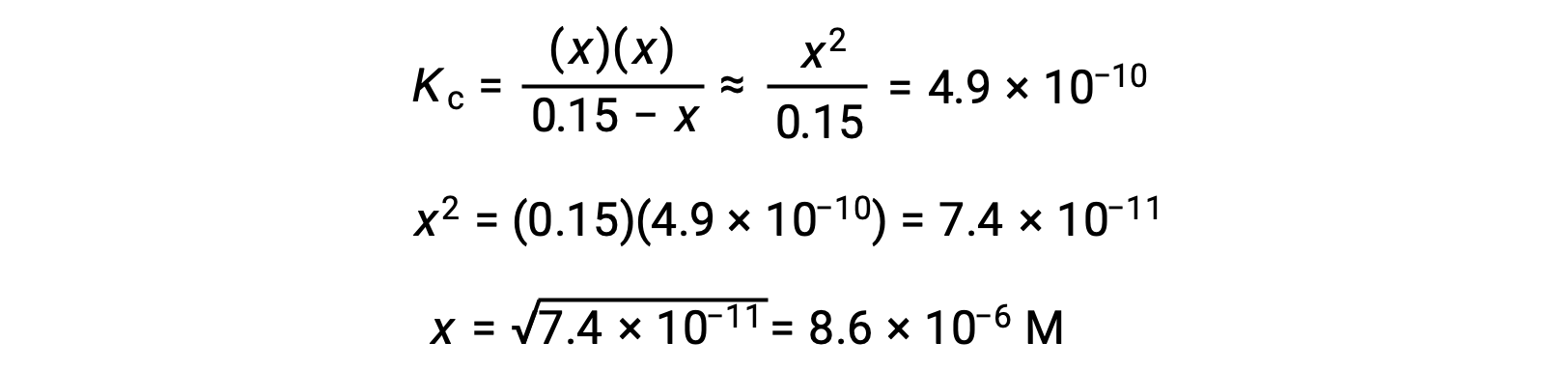
La valeur de x calculée est en effet beaucoup moins élevée que la concentration initiale
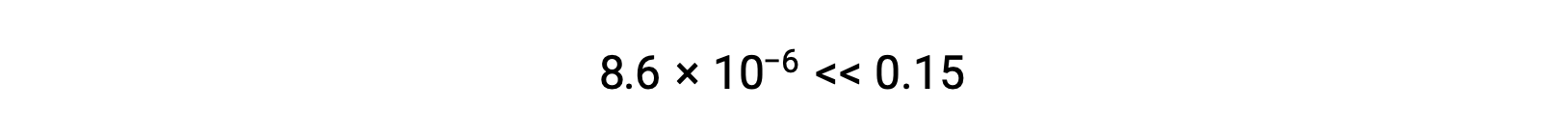
c'est pourquoi l'approximation était justifiée. Si cette approche simplifiée devait donner une valeur pour x ne justifiant pas l'approximation, le calcul devrait être répété sans procéder à l'approximation.
Ce texte a été adapté d'Openstax, Chimie 2e, Section 13.4 Calculs d'équilibre Lecture suggérée


