Overview
Source : Laboratoire de Dr. Henrik Sundén-Chalmers University of Technology
Spectroscopie de résonance magnétique nucléaire (RMN) est une technique d’analyse essentiel pour les chimistes organiques. Avec l’aide de la RMN, le travail dans le laboratoire biologique a été facilité énormément. Non seulement peut il fournir des informations sur la structure d’une molécule mais également de déterminer la teneur et la pureté d’un échantillon. Par rapport aux autres techniques usuelles pour les chimistes organiques — comme l’analyse thermique et de spectrométrie de masse (MS) — RMN est une méthode non destructive qui est utile lorsque la récupération de l’échantillon est importante.
Une des techniques plus fréquemment utilisées de NMR pour un chimiste organicien est NMR protonique (1H). Les protons présents dans une molécule seront comporte différemment selon son environnement chimique, ce qui permet d’élucider sa structure. En outre, il est possible de surveiller l’achèvement d’une réaction en comparant les spectres de RMN des matières premières à celle du produit final.
Cette vidéo illustre bien comment la spectroscopie RMN peut être utilisée dans le travail quotidien d’un chimiste organicien. S’affichera alors ce qui suit : J’ai) préparation d’un échantillon de NMR. II) à l’aide d' 1H RMN pour surveiller une réaction. III) identifiant le produit obtenu par une réaction avec 1H RMN. La réaction qui sera montrée est la synthèse d’un E- chalcone (3) d’un (1) d’aldéhyde et une cétone (2) (schéma 1). 1
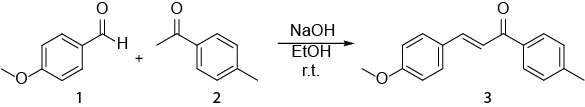
Schéma 1. Synthèse des (2E)-3-(4-methoxyphenyl)-1-(4-methylphenyl)-2-propen-1-one.
Principles
Noyaux avec une masse impair ou numéro atomique aura une propriété appelée spin, ce qui permet d’utiliser NMR pour détecter des éléments tels que l’hydrogène (1H), carbone (13C) et phosphore (31P). Les spins sont aléatoires et tourne dans des directions aléatoires ; Toutefois, en appliquant un champ magnétique externe ces noyaux va se rallient avec ou contre le champ magnétique appliqué. Ces deux États ont des niveaux d’énergie différents : un état de faible consommation d’énergie et un état de haute énergie. Irradiation par rayonnement électromagnétique provoque l’état de faible consommation d’énergie à retourner à l’état de haute énergie. Lorsque le rayonnement est cessé, les noyaux subira relaxation et decay induction libre (FID) est obtenue. Le DIF est transformée de Fourier pour donner les pics du spectre RMN du. Différents éléments auront des fréquences différentes, conduisant à des déplacements chimiques différents (tableau 1). Les spectres RMN peuvent fournir différents types d’informations sur un composé ; l’intégrale d’un pic fournit le nombre de protons représenté par elle, le couplage constant (couplage J) donne la corrélation entre les protons et le schéma de fractionnement d’un pic raconte combien d’autres noyaux de NMR-actifs se trouvent à proximité (souvent dénommé « neighbors »).
Depuis des noyaux 1H RMN mesures 1H, il est important d’utiliser des solvants deutérés ; dans le cas contraire le signal d’intérêt sera perdu dans le bruit du signal solvant.
| Type de proton | Maj (δ, ppm) | Type de carbone | Maj (δ, ppm) |
| 1° alkyle, RCH3 | 0,8 à 1,2 | 1° alkyle, RCH3 | 0 – 40 |
| 2° alkyle, R2CH2R | 1,2 à 1,5 | 2° alkyle, R2CH2R | 10 – 50 |
| 3° alkyle, RCHR2 | 1,4 à 1,8 | 3° alkyle, RCh2 | 15 – 50 |
| Allylique, R2C = CRCH3 | 1,6 à 1,9 | Alcène, C=C | 100-170 |
| Cétone, RC(=O) CH3 | 2.1 à 2.6 | Aryl, C dans l’anneau aromatique | 100-170 |
| Éther, ROCH2R | 3.3 – 3,9 | Alcool ou éther, R3COR | 50 à 90 |
| Alcool, HOCH2R | 3.3 – 4.0 | Acide carboxylique ou ester, RC(= O) ou |
160-185 |
| Vinyliques, R2C = CH2 | 4.6 – 5,0 | Aldéhyde ou cétone, RC(= O) R |
182 – 215 |
| Vinyliques, R2C = CRH | 5.2 – 5,7 | ||
| Aromatique, ArH | 6.0 – 8.5 | ||
| Aldéhyde dithiostersH | 9,5 à 10,5 | ||
| Hydroxyle de l’alcool, ROH | 0,5 à 6,0 | ||
| Carboxylique, RC(=O) OH | 10-13 |
Tableau 1. Commune proton et du carbone déplacements chimiques en RMN. 2
Subscription Required. Please recommend JoVE to your librarian.
Procedure
1. préparation de la RMN, matière première
- Ajouter environ 10 mg à partir de matériel dans un tube propre de NMR.
- Dissoudre le produit de départ dans un solvant deutéré de mL ~0.7 (exemple donné CDCl3). Une hauteur adéquate du solvant pour un bon spectre est de 4,5 à 5 cm.
- Boucher le tube NMR soigneusement et écrire le nom de l’échantillon sur la PAC.
- Agiter l’échantillon doucement pour s’assurer que tout le matériel avait dissous. Prendre soin d’éviter tout contact entre le solvant et la PAC, qui pourrait conduire à une contamination possible de l’échantillon.
- Insérez le tube de NMR soigneusement dans un cône d’hélice. Le cône d’hélice tournera une fois inséré dans l’aimant pour s’assurer que l’ensemble de l’échantillon subit un champ magnétique homogène. Nettoyez l’extérieur du tube de NMR et spinner avec 2-propanol et laboratoire des tissus afin d’éliminer les traces de doigts et de la saleté.
- Place la casserole dans une profondeur d’échantillonnage de calibre pour s’assurer que le fond du tube NMR n’est pas inséré trop profondément dans la sonde NMR comme qui peut éventuellement endommager le spectromètre. Différentes sondes ont des profondeurs différentes échantillon et l’utilisateur doit être conscient de la jauge de profondeur spécifique.
- Placer l’échantillon dans le spectromètre RMN. Ici un spectromètre Varian 400 MHz, équipé d’un échantillonneur automatique, a été utilisé.
- A l’issue de la mesure de NMR, traiter le spectre et assigner les pics dans le spectre.
2. préparation du NaOH 3M et Chalcone synthèse
- Ajouter 60 mg NaOH dans une fiole jaugée de 50 mL.
- Dissoudre le NaOH en ajoutant de l’eau déminéralisée à la moitié de la fiole. Diluer la solution plus loin en ajoutant plus d’eau jusqu'à ce que la marque est atteinte.
- Ajouter 10 mL d’éthanol à un ballon à fond rond 50 mL équipé d’une barre d’agitation magnétique.
- Par la suite, ajouter 680,5 mg 4-méthoxybenzaldéhyde et 5 mL de solution de NaOH préparée à l’étape 2.1 dans le même ballon.
- Ajouter mg 671 4-méthylacétophénone ultérieurement à la solution brassée et boucher la fiole et remuer à la température ambiante.
- Surveiller l’avancement de la réaction par 1H RMN à intervalles de 30 min (voir étape 3) jusqu'à consommation complète des matières premières.
- Ajouter 5 mL d’eau alors que la réaction a atteint fin (environ 3 h). Filtre le précipité qui en résulte et lavez-le avec 20 mL d’éthanol/eau de 1:2. Sécher à l’air précipitée.
- Calculer le rendement du produit obtenu. Préparer un échantillon de NMR selon étape 1.2.2.7. Vérifier la pureté avec 1H RMN. Si pas pur, purifier le produit par l’intermédiaire de recristallisation à l’éthanol.
- Ajouter environ 3 gouttes du mélange réactionnel dans un tube de NMR à l’aide d’une pipette Pasteur et rincer la pipette avec solvant deutéré.
- Répétez les étapes 1,2 – 1,8.
3. brève interprétation d’un spectre RMN
- Processus le spectre avec un logiciel adapté (exemple MestReNova).
- Corrélation entre les différents sommets pour les déplacements de la RMN dans le tableau 1. Les déplacements chimiques donne un soupçon de quel type d’environnement, les protons existe dans.
- Intégrer les sommets pour obtenir le nombre d’hydrogènes correspondant à chaque pic. L’intégration de tous les pics donne un nombre relatif de protons totales.
- Évaluer la séparation des pics-proton, qui indiquent le nombre de voisins.
- Mesurer le raccord en J pour voir comment les protons sont reliés les uns aux autres.
La spectroscopie RMN, ou résonance magnétique nucléaire est une importante méthode de détermination de la structure moléculaire et la pureté des échantillons en chimie organique.
De RMN des échantillons de spectroscopie sont exposés à un champ magnétique puissant. Lors de l’exposition certains noyaux de transition, ou résonne, entre les niveaux d’énergie discrets. L’écart d’énergie entre ces niveaux peut être mesuré et visualisée comme les spectres. Ces données peuvent être utilisées pour élucider la structure chimique de l’échantillon.
Pas tous les noyaux ont les propriétés requises pour être NMR-active. Les isotopes communes étudiées sont 1H, 2H, 13C, 19septies et 31P.
Cette vidéo va introduire les principes qui sous-tendent la RMN, étape aux préparations des échantillons de NMR exemple de différents stades d’une réaction chimique et discuter de plusieurs applications.
Dans l’acte de NMR, hélium et azote liquide sont utilisés pour refroidir un aimant Super conductrice. L’aimant s’applique un champ magnétique constant à un échantillon. Au sein de l’échantillon, les noyaux atomiques avec un nombre impair de protons et de neutrons seront aligneront avec le terrain, en adoptant un état de faible consommation d’énergie, ou contre elle, adoptant un état de haute énergie.
La différence d’énergie entre les deux niveaux est la fréquence de résonance, qui dépend de la puissance du champ appliqué et le type de noyau. Pour les aimants utilisés dans RMN, la valeur est dans la radiofréquence, ou RF, gamme.
Une bobine RF excite l’échantillon avec une impulsion de radiofréquence, passer les noyaux de faible consommation d’énergie à l’état plus élevé, avant de revenir en arrière. La bobine détecte ces changements de magnétisation, qui apparaissent comme des pics.
La force de la RMN réside dans sa capacité à distinguer des noyaux, dans cet affaire hydrogène, par leur environnement chimique. Électrons sur les atomes seront bloquer, ou « bouclier », les noyaux de certains du champ magnétique. Cet intensité du champ modifie la fréquence de résonance pour les noyaux particuliers, appelé un déplacement chimique. Dans l’éthanol, les protons du méthylène, hydroxyle et méthyle tous ont des fréquences de résonance unique. Déterminer les superficies de chaque pic élucide le nombre de chaque type de proton.
Étant donné que les instruments avec différentes forces magnétiques seront déplacera les fréquences de résonance, ils sont référencés à une molécule standard ajoutée à l’échantillon, souvent tétraméthylsilane ou TMS. Le déplacement chimique des fréquences est très faible, souvent signalés en parties par million ou ppm.
Lorsque vous utilisez un aimant puissant avec une haute résolution, pics fractionne parfois sous-pics. Ceci est causé par les noyaux voisins, dont certains sont alignés avec le champ magnétique, certaines contre ; encore changer le champ efficace appliqué aux noyaux. Dans l’éthanol, les 2 protons méthyléniques divisé le pic de méthyle deux fois en un triplet et les protons méthyliques 3 diviser le pic de méthylène trois fois en un quatuor. La distance du fractionnement ou couplage J, est liée à la distance entre les noyaux, aidant à découverte qualitative.
Maintenant que vous comprenez les principes fondamentaux derrière NMR, examinons un exemple de procédure qui utilise des spectres RMN du proton pour surveiller la synthèse de la chalcone d’un aldéhyde et cétone.
Commencez en utilisant une pipette Pasteur pour ajouter une petite quantité de la matière première dans un bécher. Se déplacer dans la hotte et diluer le produit de départ avec 0,7 mL de solvant deutéré. Solvants deutérés sont utilisés, comme la fréquence de résonance du deutérium est en dehors de la plage des protons.
Utiliser une pipette Pasteur pour ajouter 0,7 mL de produit dilué de départ dans un tube propre 5 mm NMR, remplissage du tube fond 4,5 à 5 cm. Cap la RMN et l’étiquette. Agiter doucement le tube, en veillant à éviter tout contact entre l’échantillon et la PAC. Ensuite, insérez le tube dans le cône d’hélice.
Nettoyez l’extérieur du tube et le cône à l’aide de tissus 2-propanol et de laboratoire. Ensuite, placez l’ensemble de l’échantillon dans la jauge de profondeur et calibrer la profondeur d’insertion.
Après calibration, charger l’assembly de l’échantillon dans le spectromètre RMN soit manuellement ou à l’aide d’un échantillonneur automatique. Enfin, utilisez un poste informatique pour acquérir le spectre RMN.
Générer des spectres de RMN à l’aide de cette procédure pour chacun des produits de la réaction départ. Pour la synthèse de chalcone, spectres doivent être générés pour méthoxybenzaldéhyde tant méthylacétophénone.
Ensuite, effectuer la synthèse de l’échantillon en combinant les matières premières et les réactifs dans un flacon pour commencer la réaction.
À des intervalles de 30 min, enlever une petite portion du mélange réactionnel à l’aide d’une pipette Pasteur et ajouter 3 gouttes dans un tube propre de NMR.
Diluer ce produit brut de réaction avec le solvant deutéré et préparent pour NMR en utilisant la procédure décrite précédemment.
Comme la réaction progresse, se forme un précipité jaune. Lorsque la réaction est terminée, laver et filtre le précipité et générer des spectres de RMN du produit de réaction purifiée.
Maintenant que nous avons généré des spectres RMN à chaque étape de la réaction chimique, nous allons les analyser.
Les pics des spectres RMN pour chacun des produits de départ sont attribués à des groupes de différents protons de la molécule selon leurs déplacements chimiques et le nombre de protons qui contribuent à chaque pic. Ici, nous attribuons les 4 groupes principaux proton pour méthylacétophénone et méthoxybenzaldéhyde, notant le pic de l’aldéhyde entre 9,5 et 10,5 ppm. En comparant les spectres de RMN des produits bruts réactionnels à des moments différents, l’évolution de la réaction chimique qui synthétise la chalcone est élucidée. Par exemple, le pic de l’aldéhyde de la méthoxybenzaldéhyde matériel départ est encore présent après 30 min de réaction, mais il est complètement disparu après 3 h, signifiant la fin de la réaction.
En examinant le spectre du produit purifié nous pouvons assigner chaque pic à un groupe de proton dans la structure de la chalcone. Par exemple, examen pics 3 et 4, nous voyons que leurs intégrales sont à la fois un autre, correspondant aux groupes contenant un seul proton.
Pics 3 et 4 sont soi-disant les doublets indiquant un proton voisin. Les deux ont des constantes de couplage J de 16 Hz, ce qui suggère que les protons sont situés à travers un E-double liaison. En attribuant tous les pics de NMR du produit purifié de réaction, nous confirmons la synthèse d’une pure chalcone.
Spectroscopie RMN a une large gamme d’applications et est utilisée dans de nombreux domaines scientifiques et médicaux.
Dans cette application, proton RMN est utilisés pour vérifier la synthèse et la structure de diamidocarbene et mononoamidocarbine, dont les spectres RMN ont des profils différents de fractionnement du pic. Ces produits de réaction apparemment différents de carbènes également généré lorsqu’il est combiné avec du phosphore blanc ; DAC1 a généré un produit de la réaction de rouge vif, tandis que MAAC2 produit un orange vif. Ces différences dans les produits de réaction ont été confirmés à l’aide d’une deuxième application de la RMN, 31P RMN, qui génère des spectres basés sur des différences dans la fréquence de résonance des noyaux de phosphore.
Ici, l’imagerie par résonance magnétique nucléaire, ou IRM, a été utilisé pour générer une carte anatomique du cerveau et de sélectionner les régions cérébrales d’intérêt. Puis spectroscopie RMN a été utilisée pour générer des spectres des métabolites principaux. Enfin, à l’aide de MRI changements dans le métabolisme de cerveau dans des conditions expérimentales différentes ont été évalués.
Dans cette application, la RMN a été utilisés pour analyser les propriétés de liaison et de proposer une structure 3D d’un peptide de cuivre liant. Tout d’abord, spectres de RMN ont été comparés pour du peptide délié et cuivre lié aux États. Ensuite, différentes conformations possibles de la structure du peptide en utilisant des techniques de RMN 2D plus avancés, ont été évaluées. Enfin, ces contraintes structurelles dérivées de NMR ont servi à élaborer une structure 3-Dimensional proposée pour le peptide non lié.
Vous avez juste regardé introduction de JoVE d’analyse RMN. Vous devez maintenant comprendre les principes fondamentaux derrière génération spectres NMR et analyse, ainsi qu’une procédure de préparation d’échantillons de NMR.
Merci de regarder !
Subscription Required. Please recommend JoVE to your librarian.
Results
En comparant les spectres des produits de départ (Figures 1 et 2) à celle du produit final (Figure 5), une nette différence entre les spectres peut être observée, indiquant la formation de la chalcone. Le point de terminaison de la réaction peut être détermine en prélevant des échantillons de NMR à différents intervalles de temps ; par exemple, le pic de proton aldéhyde (C(=O)H) (1) peut être vu à la Figure 3 , mais pas dans la Figure 4, signifiant la fin de la réaction après 3 h. En regardant les intégrales, fendage schémas et J-accouplements des sommets, il est possible de valider la structure de la chalcone. Les intégrales des pics (numéros sous le pic, Figure 5) montrent la quantité relative d’hydrogènes présents qui devraient correspondre à la quantité d’atomes d’hydrogène contenus dans le produit. En outre, le modèle de fendage donne une indication sur le nombre de voisins ; par exemple, le pic (5) et (1) — les deux maillots — n’indiquer aucun voisin à proximité avec intégrales de 3 est en corrélation avec le MeO - et le groupe Me respectivement. En comparant le produit chimique se déplace dans les spectres avec tableau 1 , il est possible d’expliquer que le MeO-groupe correspond à l’état singulet 3,80 ppm et le Me-groupe à 2,45 ppm. En outre, la formation de la double liaison peut être considérée comme deux doublets (Figure 5), 7,80 et 7,44 ppm. En regardant le couplage J de 16 Hz indique la formation d’un E-alcène ; le Z-alcène a généralement une plus petite valeur de 10 à 12 Hz.3 assignant les pics aromatiques vérifie la structure (Figure 5). 4

Figure 1. Assignés 1H RMN de 4-méthylacétophénone s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 2. Assignés 1H RMN de 4-méthoxybenzaldéhyde. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 3. Brut 1H RMN après 30 min, montrant la crête résiduelle aldéhyde. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 4. Brut 1H RMN après 3 h ne montrant aucun Pic résiduel de l’aldéhyde. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 5. 1 H RMN spectres du produit obtenu après la marche à suivre. Le montre l’image insérée la J -couplages de l’alcène. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
NMR, par exemple, permet de détecter des intermédiaires réactionnels, facilitant le travail dans l’élucidation d’un mécanisme de réaction. Avec l’aide de la RMN, il est également possible d’observer les interactions et les mouvements moléculaires importantes pour le développement de médicaments. En outre, NMR peut donner des informations structurelles sur les matériaux solides ; par exemple pour fournir une justification pour les propriétés matérielles observées. Autres applications de la RMN peuvent être trouvées dans le domaine de la médecine, où l’imagerie par résonance magnétique (IRM) est souvent utilisé pour le diagnostic médical. NMR a également servi en métabolomique pour détecter différents métabolites excrétés par l’organisme, permettant ainsi une empreinte métabolique. Les utilisations de la RMN sont larges ; de la détermination de la structure d’une molécule unique d’imagerie du cerveau humain.
Subscription Required. Please recommend JoVE to your librarian.
References
- Ta, L., Axelsson, A., Bijl, J., Haukka, M., Sundén, H., Ionic Liquids as Precatalysts in the Highly Stereoselective Conjugate Addition of α,β-Unsaturated Aldehydes to Chalcones. Chem. Eur. J. 20 (43), 13889-13893 (2014).
- Table adapted from Graham Solomons, T. W. Fryhle, C. B., Organic Chemistry, 10th edition, Wiley, p. 387, 418 (2011).
- Clayden, J., Greeves, N., Warren, S., Wothers, P. Proton nuclear magnetic resonance. Organic Chemistry, Chapter 11, Oxford University Press, 269 (2001).
- Wu, X.-F., Neumann, H., Spannenberg, A., Schulz, T., Jiao, H., Beller, M.,Development of a General Palladium-Catalyzed Carbonylative Heck Reaction of Aryl Halides. J. Am. Chem. Soc. 132 (41), 14596-14602 (2010).




