Overview
Source : Laboratoire de Jeff Sanoussi - University of Massachusetts Amherst
Le produit d’une extraction par solvant organique, un extrait de lipides totaux (TLE), est souvent un mélange complexe de centaines, voire des milliers de différents composés. Le chercheur est souvent seulement intéressé par une poignée de composés ou, si vous êtes intéressé dans un grand nombre, peut avoir besoin éliminer les constituants indésirables « in the way » ou conjointement à élution. Par exemple, les concentrations de composés dans un échantillon sont souvent déterminées sur un chromatographe en phase gazeuse couplée à un détecteur à ionisation de flamme (GC-FID), parce que la relation entre la réponse de la FID (en pA) et la quantité de composé présent dans un échantillon (par exemple, ng/µL) est linéaire et sensible. La portion de GC de l’instrument sépare les différents composés dans un échantillon basé sur leur point d’ébullition, la structure chimique et l’affinité avec une phase solide qui peut changer selon la demande. Il en résulte un chromatogramme (Figure 1), montrant la séparation des constituants chimiques différents dans le temps, ainsi que leur concentration relative (calculée comme l’aire sous la courbe). Cependant, parfois plus d’un composé élué au large de la GC à la fois (Figure 1). Dans ce cas, purification de l’échantillon est nécessaire avant les composés peuvent être quantifiées en toute confiance.
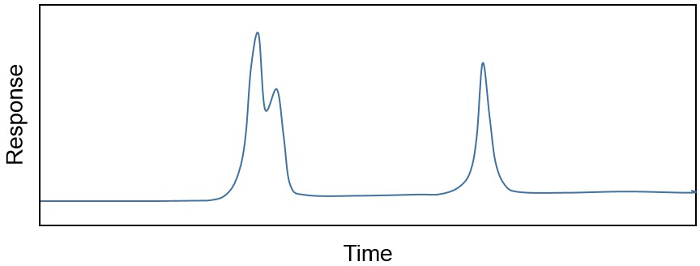
Figure 1. Un chromatogramme montrant la séparation des constituants chimiques différents dans le temps et de leur concentration relative (aire sous la courbe). Pics de co élution et séparés sont indiqués.
Principles
FAMEs (esters méthyliques d’acides gras) sont des constituants importants des microbes terrestres et marins et sont souvent utilisés, conjointement avec des techniques génétiques, pour décrire la diversité des écosystèmes microbiens dans les systèmes modernes et anciens. Toutefois, la présence de FAMEs dans un échantillon n’est pas toujours utile. En raison de leur taille et leur chimie semblable, FAMEs appelés alkenonatescommonly éluer conjointement avec longue chaîne alkyl cétones, appelés alkénones (Figure 2). La distribution des alcénones dans un échantillon rapporte des informations sur la température de surface de mer à l’époque ou le lieu de l’échantillon a été prélevé, et leur caractérisation exacte et précise est donc importante.
La saponification est une technique courante de purification utilisée pour convertir les FAMEs en acides gras, ce qui modifie leurs caractéristiques chimiques assez pour enlever du co élution avec alkénones (Figure 3). Saponificationis une forme d’hydrolyse. Dans l’hydrolyse, l’eau est utilisé pour fractionner les molécules. La saponification est une hydrolyse qui est accélérée en présence d’une base, tels que l’hydroxyde de potassium (KOH). KOH se dissout dans K+ et OH– dans l’eau. L’anion hydroxyde (OH-, ions de charge négative) ajoute à l’atome de carbone tertiaire légèrement, positivement chargées au cœur de la renommée (Figure 3, haut). Cependant, cette configuration chimique est instable, (carbone a lié au trop grand nombre d’autres atomes) et l’alcoolate (ROH–) est expulsé. Tourne le H de la base conjuguée cette forme d’expulsion rapidement vers l’alcoolate former le méthanol de l’alcool et le sel de potassium d’acides gras (Figure 3, milieu). À ce stade, le fautif de la renommée (alkenoate) a été convertie en un composé chimique qui n’est plus Co élué avec elle. Toutefois, si l'on veut analyser aussi chimie renommée, ils peuvent être récupérées par l’addition d’acide (HCl) à la solution, jusqu'à ce que le pH atteigne environ 2. À ce pH, le sel de potassium de l’acide gras est divisé pour former un acide carboxylique et un sel ionique (KCl ; Figure 3, bas).

Figure 2 . La structure chimique d’un alcénone avec des atomes de carbone 37 et 2 doubles liaisons (en haut) et son associé alkenoate FAME (en bas).

Figure 3 . Une représentation schématique de la saponification de l’acide palmitique à l’aide d’hydroxyde de potassium (KOH) pour augmenter la vitesse d’hydrolyse (http://www.mpbio.com/).
La saponification est une technique couramment utilisée pour supprimer des esters méthyliques d’acides gras d’un mélange organique complexe.
Échantillons organiques complexes sont souvent analysés par chromatographie en phase gazeuse, qui est utilisé pour déterminer les concentrations relatives des différents composants.
Cependant, les composés qui sont semblables dans la taille et la structure ne peuvent être distinguées par l’instrument, les résultats de l’inclinaison. Par conséquent, des composés indésirables qui produisent des signaux qui se chevauchent doivent être enlevés afin d’obtenir des résultats précis.
Cette vidéo couvre l’utilisation de saponification pour purifier les alkénones pour la paléoclimatologie. Il est le premier d’une série décrivant la purification des échantillons complexes biomarqueur. Il couvrira la procédure, ainsi que quelques autres utilisations de la technique.
Polyinsaturés à longue chaîne alkyl cétones, appelés alkénones, ont été démontrés pour fournir des informations utiles sur la température de surface de mer passés.
Toutefois, les organismes qui produisent des alcénones souvent créent acides gras esters méthyliques qui sont similaires en taille et en structure chimique, appelé alkénoates. En raison de ces similitudes, Oates doivent être enlevés avant qu’une analyse exacte peut être obtenue.
La saponification est une technique courante utilisée pour prévenir l’élution Co de ces molécules. Saponification utilise l’eau pour fractionner la liaison moléculaire d’un ester. Une base se fixe sur le carbone au cœur de l’alkenoate. Cette réaction d’addition crée un intermédiaire instable et l’alcoolate est expulsé.
L’hydrogène provenant du nouvellement formé pénètre acid de l’alcoolate expulsé et l’anion carboxylate qui en résulte constitue une liaison ionique avec le cation de la base. Le résultat est un alcool et un sel d’acide gras. Ajout d’un acide fort sera re-générer de l’acide carboxylique. À ce stade, l’alkenoate incriminé a été convertie en une forme qui n’est plus Co élué avec l’alcénone d’intérêt.
Maintenant que vous comprenez comment saponification peut servir à purifier un mélange organique, vous êtes prêt à commencer la procédure.
Tout d’abord, acquérir un extrait lipidique total séchés - ou TLE - qui a été obtenu à l’aide d’une méthode d’extraction par solvant. Ensuite, préparer les solutions de saponification tel qu’indiqué dans le protocole du texte. S’assurer que tous les composants sont pure et libre d’hydrocarbures. Une fois que les solutions sont prêtes, ajouter la TLE séché dans un flacon de 60 mL en verre borosilicaté. Ajouter 2 mL d’hydroxyde de potassium normal 2 et sceller le flacon. Ensuite, faire chauffer le flacon à 60 ° C pendant 2,5 heures Cliver la liaison ester. Lorsque c’est terminé, laissez l’échantillon refroidir à température ambiante. Une fois l’échantillon refroidi, ajouter 2 mL de solution de chlorure de sodium à 5 % dans le flacon. Boucher le flacon et agiter brièvement. Ajouter quelques gouttes d’acide chlorhydrique 6 N jusqu'à un pH de 2 - à l’aide de papier pH pour tester. L’addition de cet acide se protoner l’anion carboxylate pour former le produit final - stable de l’acide carboxylique.
Maintenant que la solution acidifiée est exempt d’ester, ajouter 5 mL d’hexane. Boucher et agiter vigoureusement pendant 5 secondes pour extraire les composés organiques de l’eau. Laisser la solution se reposer jusqu'à ce que la phase organique et aqueuse séparer complètement. Sels, d’ions et l’acide chlorhydrique n’ayant pas réagi restera dans la phase aqueuse, tandis que les composés organiques seront sépareront dans l’hexane. Une fois que les phases sont complètement séparés, retirer environ 75 % de l’hexane à l’aide d’une pipette et verser dans un autre flacon de 40 mL. Répétez ce procédé d’extraction supplémentaires deux fois, ajouter 5 mL d’hexane chaque fois. Une fois cette opération terminée, jeter la solution aqueuse reste dans une poubelle appropriée. Étiqueter le flacon contenant la phase organique fraîchement saponifiée. Les acides carboxyliques produites ne peut pas être injectés dans les instruments couramment utilisés pour l’analyse d’alcénone sans davantage de purification. Acides carboxyliques injectés dans un chromatographe en phase gazeuse rapidement s’accumuler et ruiner les criques, les revêtements d’entrée et l’extrémité avant des colonnes. Pour retirer ces acides, l’échantillon doit d’abord subir une autre technique de purification : séparation par chromatographie sur colonne.
Saponification a plusieurs applications dans l’extraction et la purification de molécules organiques.
Saponification peut être utilisée non seulement pour séparer les biomarqueurs, mais aussi d’extraire les composants individuels pour une utilisation dans les produits commerciaux. Dans cet exemple, les composés de l’arbre de tabac - Nicotiana glauca - ont été isolés et analysés afin d’examiner leur potentiel comme matière première pour une grande variété de produits bio, comme combustible, la chaleur et un tableau de composés chimiques.
Les feuilles étaient d’abord homogénéisés, puis centrifugés, afin de concentrer les molécules d’intérêt. Le matériel végétal concentré a été ensuite saponifié. Le matériaux extraits a été analysée par spectrométrie de masse à chromatographie en phase liquide, afin de déterminer la concentration de tocophérol - une famille de composés de la vitamine E se trouve généralement dans les plantes.
Le matériel extrait peut également être reconstitués in vitro à sa composition originale. Dans cet exemple, la saponification a été utilisée pour extraire les caroténoïdes des plants d’épinards, d’être par la suite reconstitués in vitro. L’épinard a d’abord homogénéisé, puis centrifugé, pour récolter les molécules de pigment. Ces molécules ont été ensuite suspendus dans une solution d’hydroxyde de potassium dans une ampoule à décanter, initiant la saponification. Les caroténoïdes saponifiées séparé en une couche d’éther, qui a été recueillie et séchée. À l’aide d’une série de solution tampons, les caroténoïdes - et d’autres molécules de pigmentation - ont ensuite été reconstitués in vitro. Cette purification a permis pour l’analyse de ces pigments sans l’interférence de même structuré composés organiques.
En raison de sa capacité à hydrolyser des esters, saponification peut être utilisée pour « libérer » composés qui sont par ailleurs liés aux macromolécules. Dans cet exemple, une étape de saponification anhydre est utilisée pour convertir le sel d’acide carboxylique de potassium4-fluorobenzoate éthyl-4-fluorobenzoate. Cette déprotection par saponification permet la production de brut SFB - une réaction qui ne serait pas possible si la molécule était resté « coincé ».
Vous avez regardé juste introduction de Jupiter à la purification de Uk'37 échantillons par saponification. Vous devez maintenant comprendre comment fonctionne la saponification et comment l’utiliser pour purifier les alkénones dans un extrait lipidique total. Autres procédés de purification se traduira dans les vidéos suivantes.
Merci de regarder !
Subscription Required. Please recommend JoVE to your librarian.
Procedure
1. le programme d’installation et préparation du matériel
- Obtenir un lipide total extrait (TLE) en utilisant une méthode d’extraction par solvant (Sonication, Soxhlet ou Accelerated Solvent Extraction (ASE)).
- Préparer une solution de 2 N KOH à 5 % H2O dans le méthanol.
- KOH et le méthanol peuvent être achetés auprès de détaillants de produits chimiques. Ces produits chimiques doivent être pure et libre d’hydrocarbures.
- La masse molaire du KOH est Amou ~ 56, ce qui donne 1 mol de OH– pour chaque mole de KOH. Ainsi, pour atteindre une concentration de N 2, dissoudre 112 g de KOH à 0,95 L d’eau pure et 0,05 L de méthanol.
- Notez que la dissolution de KOH dans l’eau est exothermique et crée une grande quantité de chaleur. Prendre soin d’ajouter les boulettes KOH à l’eau lentement pour éviter une réaction violente.
- Dissoudre le 112 g de pastilles de KOH dans 0,95 L d’eau pure sur une plaque de remuer automatique.
- Ajouter 0,05 L de méthanol, une fois tous le KOH se dissout pour faciliter la dissolution des biomarqueurs organiques en solution aqueuse.
- KOH et le méthanol peuvent être achetés auprès de détaillants de produits chimiques. Ces produits chimiques doivent être pure et libre d’hydrocarbures.
- Préparer une solution d’acide chlorhydrique N (HCl) 6 H2O.
- HCl peut être acheté auprès de revendeurs de produits chimiques. Ce produit chimique doit être pure et libre d’hydrocarbures.
- HCl est généralement concentré que 13 N. Ainsi, un mélange de 1:1 de HCl et de l’eau pure produit un mélange de 6,5 N de HCl, qui est assez proche de 6 N aux fins de cette expérience.
- N’oubliez pas d’ajouter le HCl à l’eau et non l’inverse, que l’ajout d’eau à HCl concentré est exothermique et génère de la chaleur. Cela peut provoquer des HCl éclabousse.
- Doucement et lentement verser 100 mL de HCl dans un bécher de 100 mL, eau pure, en agitant le mélange entre les ajouts de HCl.
- Préparer une solution de 5 % NaCl (sel de table) en H2O.
- NaCl peut être acheté auprès de revendeurs de produits chimiques. Ce produit chimique doit être pure et libre d’hydrocarbures.
- Calculer et pèsent la masse de sel nécessaire pour rendre ~ 1 L de solution à 5 % (p/p). 1 L d’eau pèse environ 1 kg ou 1 000 g. Ainsi, 50 g de NaCl dissous dans 950 mL donne une solution à 5 % (50 g + 950 g = 1 000 g ; 50 g / 1 000 g = 0.05 ou 5 %).
- Doucement, ajouter 50 g de NaCl à l’eau pure sur une plaque automatique remuer et attendre qu’il se dissoudre.
- Obtenir les matériaux suivants : 2 propre et brûlé (550 ° c pendant 6 h) flacons en verre de borosilicate 40 mL avec capuchon doublé PTFE ; un réchaud ou blocs de chauffage ; pipettes de verre borosilicaté tible (550 ° c pendant 6 h) et d’ampoules ; bande de pH (acide gamme) ; Hexane (hexane peut être acheté auprès de revendeurs de produits chimiques. Ce produit chimique devrait être Optima Grade ou équivalent).
2. méthodes
- Commencez avec la TLE séchée (contenant des esters) dans l’un des flacons verre borosilicaté 40 mL.
- Ajouter environ 10 mL de 2 N KOH à la TLE et le cap.
- Faire chauffer dans le four ou sur un bloc de chauffage à 60 ° c pendant 2,5 heures Cliver la liaison ester (Figure 3).
- Retirer l’échantillon du feu et laisser refroidir à température ambiante.
- Ajouter environ 10 mL de la solution de NaCl 5 % à la TLE (Figure 3). Cela permet de garder l’interface entre la phase aqueuse et organique (à ajouter) de moussage. Boucher et agiter brièvement.
- Ajoutez 6 N HCl à la TLE salée goutte à goutte jusqu'à pH 2 de protoner la O– et former le produit final, un acide carboxylique stable (Figure 3, utilisez du papier pH pour tester). Si l’ELT a été coloré, il peut y avoir un changement de couleur coïncidant avec pH 2.
- Ajouter environ 20 mL d’hexane dans la solution acidifiée, qui est maintenant exempt d’ester. Boucher et agiter vigoureusement pendant 5 s pour extraire les composés organiques de l’eau.
- Laisser pour reposer jusqu'à ce que les phases aqueuses et organiques complètement séparés. Sels, d’ions, l’eau et n’ayant pas réagi HCl restent dans la phase aqueuse. Composés organiques sont maintenant dans l’hexane.
- Enlever environ 75 % de l’hexane de surnageant à l’aide d’une pipette et verser dans le flacon de verre de borosilicate autres 40 mL.
- Répétez de 2,7 à 2,9 deux fois, ajouter environ 10 mL d’hexane chaque fois.
- Jeter les reste mélange aqueux dans un conteneur à déchets approprié.
- Étiqueter le flacon contenant l’hexane et exempt d’ester organics « TLE - saponifiée. »
Subscription Required. Please recommend JoVE to your librarian.
Results
Cette purification produit une TLE garantis sans pouvant être conjointement élution avec l’alkénones. Toutefois, la purification produit des acides carboxyliques, qui ne peut être injectés dans les instruments couramment utilisés pour analyser des échantillons pour des concentrations d’alcénone en raison de leur faible volatilité. Par exemple, le point d’ébullition de l’hexane, un hydrocarbure à 6 carbones, est de 68 ° c, mais le point d’ébullition de l’acide (l’acide hexanoïque) est de 205 ° c. La plupart biomarqueurs prêtent GC ont de 20 à 35 atomes de carbone (point d’ébullition augmente en général avec un nombre croissant d’atomes), et la plupart des programmes température GC arrêter environ 300 ° c. Acides carboxyliques injectés dans un GC rapidement s’accumuler et la ruine de bras de mer, doublures d’entrée et l’extrémité avant des colonnes. Pour supprimer ces acides, l’échantillon doit tout d’abord subir une autre séparation de technique de purification par chromatographie sur colonne.
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
Tel que mentionné précédemment, la saponification est couramment utilisée dans les laboratoires de la géochimie organique pour enlever des esters méthyliques d’acides gras (FAMEs) d’alkénones, appelé alkénoates, qui co éluer avec alkénones sur chromatographes en phase gazeuse (Figure 1). La saponification est également utilisé pour « libres » acides gras « liés » à sédiments ou des macromolécules. La dégradation et la préservation de la matière organique et de biomarqueurs dans les sédiments implique la suppression des groupes fonctionnels (N, O et S) et la polymérisation éventuelle de différents biomarqueurs dans les macromolécules ou l’adsorption de biomarqueurs et de macromolécules sur surfaces minérales. Pas tous les biomarqueurs dans une limite de mise en devenir et le ratio de biomarqueurs liés-à-libre peuvent changer de réglage et l’âge des sédiments pour des raisons pas encore complètement expliqué. Saponification, parfois à des températures plus élevées que celles discutées ici (> 200 ˚C), est utilisé pour libérer ces biomarqueurs liés à l’effort pour décrire leur, leurs sources et les mécanismes responsables de leur nature lié.
Subscription Required. Please recommend JoVE to your librarian.




