Overview
Source : Laboratoire de Jeff Sanoussi - University of Massachusetts Amherst
Le produit d’une extraction par solvant organique, un extrait de lipides totaux (TLE), est souvent un mélange complexe de centaines, voire des milliers de différents composés. Le chercheur est souvent seulement intéressé par une poignée de composés. Les composés d’intérêt peuvent appartenir à l’un de plusieurs classes de composés, tels que les alcanes, cétones, alcools ou acides (Figure 1), et il peut être utile supprimer les classes de composés auquel il n’appartient-elle pas afin d’obtenir une vision plus claire des composés que vous intéresse. Par exemple, un TLE peut contenir 1 000 composés, mais l’Uk'37 proxy de mer la température de surface est basé sur seulement deux composés (alkénones) et le proxy de température de surface de mer de86 TEX repose sur quatre seulement (glycérol dialkyl glycérol tetraethers). Il incombe au chercheur de retirer autant de composés qu’ils ne sont pas intéressés. Cela rend l’analyse instrumentale des composés d’intérêt (alkénones ou GDGTs), moins susceptible d’être compliquée par d’autres composés superflues.
Dans d’autres cas, une technique de purification en amont peut avoir produit des composés que vous souhaitez maintenant supprimer de l’échantillon, comme la production d’acides carboxyliques pendant la saponification dans notre précédente vidéo. Dans les deux cas ci-dessus, la technique de purification par chromatographie sur colonne est très utile.
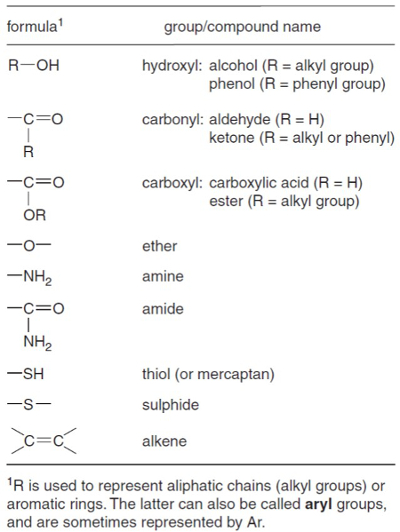
La figure 1. La géochimie importants groupes fonctionnels. De Killops et Killops1.
Principles
Chromatographie sur colonne de gel de silice est une technique de purification qui utilise les différentes associations de classes de composés discrets pour une phase solide de silice, une poudre fine, appelée un gel. Une petite pipette est chargée environ moitié plein avec le gel (Figure 2). Cette colonne est alors saturée avec un solvant apolaire, souvent l’hexane. Un échantillon est ensuite chargé sur le dessus du gel dans la colonne, et une série de solvants de polarité de plus en plus est passée successivement à travers l’échantillon afin du pour dissocier dans les classes de composés distincts. La séparation est basée sur l’affinité des différentes classes de composés pour la phase solide ou la phase solvant. Les composés polaires se lier plus fortement à la silice et tient donc plus de solvants polaires pour être lavé de la colonne. Ainsi, à l’aide d’une colonne et un seul échantillon, cet échantillon peut être séparé en plusieurs fractions ; par exemple, apolars (hydrocarbures), mi-polaires (cétones et alcools) et polaires (acides et autres composés fonctionnalisés).

La figure 2. Image d’un support sur mesure qui permet la purification des échantillons jusqu'à 12 à la fois.
Chromatographie sur colonne est une technique souple pour purifier le mélange complexe de composés présents dans les sédiments. Séparent les mélanges car ils se déplacent à travers la colonne et sont collectées dans les fractions, chacun contenant une classe de composés chimique différentes. Par conséquent, chromatographie sur colonne est souvent utilisé comme une étape de purification supplémentaire après l’isolement initial du composé désiré. Organique des extraits tels qu’extraits de lipides totaux peuvent être des mélanges complexes de nombreux composés. Quelques techniques de purification, comme la saponification, introduisent des composés qui peuvent endommager les instruments analytiques et donc doivent être enlevés avant l’analyse. Cette vidéo fait partie d’une série sur les lipides extraction, purification et analyse des sédiments. Une fois un extrait lipidique total prélevé un échantillon sédimentaire, chromatographie sur colonne est utilisé pour purifier les alkénones et GDGTs, selon l’analyse désirée.
En chromatographie sur colonne, un mélange de composés chimiques est chargé sur une phase stationnaire solide comme le gel de silice. Une phase mobile comme un solvant organique est ensuite utilisée pour éluer ou supprimer, les composés de la colonne. L’ordre dans lequel les composés sont élués dépend de la puissance des interactions des composés avec le gel de silice et avec l’éluant.
L’éluat est recueillie dans les fractions, chacun contenant différents composés du mélange. En fonction des propriétés des composés, un solvant seul peut assurer l’espacement suffisant et éluer tous les composés d’intérêt. Dans le cas contraire, plusieurs solvants sont utilisés pour éluer chacun des composés d’intérêt à son tour.
Les composés polaires, qui ont une répartition inégale de la charge, adsorbent fortement sur le gel de silice polaire, tandis que les composés apolaires adsorbent faiblement. Solvants polaires ont une plus grande affinité pour le gel de silice et sont donc des éluants plus puissants que les solvants apolaires. Ainsi, les solvants apolaires éluer les composés apolaires seul, tandis que les solvants polaires éluer fois composés polaires et apolaires.
Lorsque les composés désirés sont modérément polaires, apolaire composés doivent être lavés au large de la colonne avec un solvant apolaire avant d’utilise un solvant polaire. Pour éviter l’élution des composés très polaires indésirables tels que les acides, un éluant polaire ne devrait pas avoir plus de puissance à élution que nécessaire pour le composé désiré plus polaire.
Maintenant que vous comprenez les principes de la chromatographie sur colonne, Let ' s go grâce à une procédure de purification des biomarqueurs lipidiques d’un extrait lipidique total par chromatographie sur colonne de gel de silice.
Pour éliminer les contaminants organiques, pipettes de verre de borosilicate de la combustion, flacons en verre borosilicate et laine de verre pendant 6 h à 550 ° C. Une fois que la verrerie est prête à l’emploi, mis en place une grille de tenir les pipettes et flacons. Obtenir des bulbes de pipette, nettoyer la pince à épiler, une spatule de laboratoire, gel de silice, hexane, dichlorométhane et du méthanol. Avec la pince à épiler propre, placez une petite touffe de laine de verre dans la bouche d’une pipette. Poussez doucement la laine de verre pour le fond de la pipette avec la tige d’une autre pipette pour former un bouchon desserré. Soigneusement charger le gel de silice dans la pipette jusqu'à moitié plein. Fixez le poteau de la pipette dans le panier. Fixez un flacon de verre de borosilicate 4 mL sous la pointe de la pipette pour la collecte des déchets. Dans un autre flacon en verre de borosilicate, suspendre jusqu'à 10 mg d’échantillon sec depuis le procédé de saponification dans l’hexane. Si l’échantillon adhère aux parois de la cuvette, laisser agir le flacon pendant 5 min. La chromatographie en phase inverse peut maintenant commencer.
Pour commencer la chromatographie, laver la colonne de gel de silice et 3 volumes d’hexane pour enlever les bulles d’air et les impuretés. Ensuite, remplacez le flacon de déchets avec un flacon vide pour la fraction apolaire. Avec une pipette en verre, charger l’échantillon sur la colonne et permettre la suspension d’imbiber dans le gel de silice. Travailler rapidement afin que la colonne se dessécher pendant la procédure. Rincer le flacon d’échantillon deux fois avec petites portions d’hexane et transférer chaque rinçage à la colonne. Continuez à ajouter hexane à la colonne jusqu'à ce que le flacon est presque plein. Permettre à tous de l’hexane pour terminer la saisie du gel de silice. Puis, échanger le flacon rempli avec un flacon vide pour la fraction en milieu polaire. Ensuite, rincer le flacon d’échantillon avec du DCM et l’ajouter à la colonne 3 fois. Continuer à ajouter du DCM pour la colonne jusqu'à ce que le flacon est presque plein. Permettre le DCM finir le trempage dans le gel de silice et ensuite échanger le flacon rempli avec un flacon vide pour la fraction polaire. Répétez cette procédure avec du méthanol.
Une fois que le flacon est presque plein, laisser le méthanol finir les gouttes dans le flacon et puis cap tous les flacons. La fraction milieu polaire contient l’alkénones désiré, tandis que les GDGTs sont dans la fraction polaire. Pour les échantillons d’alcénone particulièrement sale ou complexe, la fraction milieu polaire doit être davantage purifiée avec adduction d’urée, avant l’analyse.
Chromatographie sur colonne est largement utilisé en chimie comme technique d’analyse et de purification.
Nanotubes de carbone, ou CNTs, sont de plus en plus utilisés dans de nombreuses industries, mais il y a une préoccupation grandissante de leurs effets sur la santé humaine. Variant les propriétés des changements CNTs, comment ils se comportent dans l’eau et le sol. Afin d’étudier comment bien poreux comme le sable et la saleté conserve CNTs, une colonne a été préparée avec sol poreux comme la phase stationnaire. Tout d’abord, les fractions ont été recueillies pendant le chargement de la solution de la CNT sur la colonne pour analyser le transport de la CNTs dans le sol. Ensuite, les CNTs encore adsorbés au sol sont éluées et les fractions analysées pour la quantité de CNTs qui étaient restées dans le sol. Les résultats tendent à mieux comprendre la relation entre la fonctionnalisation de surface CNT et leurs mécanismes de transport dans l’environnement.
Chromatographie sur colonne peut être utilisée sur les petites et grandes échelles, et est donc utilisé lors de la conception des synthèses pour les applications industrielles. Soie d’araignée ont l’excellente résistance à la traction et la ductilité, mais ne peut être récoltés à l’échelle industrielle. Suite à la synthèse des protéines de soie, les protéines recombinantes en soie sont purifiés par chromatographie d’affinité, dont la phase stationnaire est conçue pour retenir seulement la molécule désirée. Élution et lavage complet accorde les fractions de protéine pure nécessaires pour faire tourner la soie d’araignée à grandes échelles.
Il existe beaucoup de phases stationnaires pour chromatographie sur colonne. Une phase stationnaire peut ne pas convenir à tous les produits potentiels d’une synthèse avec un vaste champ de substituants, tels que la synthèse de cette iodoaziridine. Produit brut est mélangé à diverses phases stationnaires et décomposition évalués par RMN du proton. RMN du proton étant très sensible, beaucoup de phases stationnaires peut subir pour la décomposition du produit à l’aide d’une petite quantité de produit brut. Chromatographie sur colonne est ensuite exécutée avec la phase stationnaire optimale, permettant la purification de composés très réactifs et de roman.
Vous avez juste regardé introduction de Jupiter à la chromatographie sur colonne pour la purification d’un extrait lipidique total. La vidéo suivante vous montrera comment purifier davantage des mélanges complexes contenant des alcénones.
Merci de regarder !
Subscription Required. Please recommend JoVE to your librarian.
Procedure
1. le programme d’installation et préparation du matériel
- Obtenir un lipide total extrait (TLE) en utilisant une méthode d’extraction par solvant (Sonication, Soxhlet ou Accelerated Solvent Extraction (ASE)).
- Rassembler ce qui suit : en verre borosilicaté tible pipettes et ampoules, gel de silice, hexane, le dichlorométhane (DCM) et du méthanol.
- Ces matériaux peut être achetés à partir de n’importe quel détaillant de produits chimique. Les réactifs doivent être pure et libre à partir d’hydrocarbures.
- Également obtenir la laine de verre de consommé et flacons en verre de borosilicate de 4 mL.
- Assurez vous d’avoir un moyen de soutenir la colonne et les flacons de collection au cours de la procédure. Par exemple, un stand avec pinces et un rack de vil. Plusieurs laboratoires ont conçu des grilles sur mesure qui contiennent plusieurs colonnes et des flacons de collection (Figure 2). Cela permet à nombre de colonnes à être exécuté en même temps.
2. méthodes
- Commencez par l’échantillon sec dans un flacon de 4 mL. Si l’échantillon pèse plus de ~ 10 mg une fois sec, il peut avoir besoin de se diviser avant d’effectuer les étapes suivantes, comme le gel de silice peut seulement réagir avec une masse finie de la matière organique.
- Suspendre l’échantillon dans une petite quantité d’hexane. Il s’agit de la première et la moins polaire des trois solvants utilisés dans cette expérience.
- S’il y a échantillon collé à l’intérieur de la cuvette, laisser agir les échantillons pendant 5 min.
- Charger une petite quantité de laine de verre dans la partie supérieure de la pipette à l’aide d’un ensemble de pince à épiler propre. Poussez doucement la laine de verre vers le bas de la pipette, l’aide d’une autre pipette, pour former un bouchon.
- Transvaser avec soin le gel de silice dans la pipette jusqu'à ce qu’il est environ à moitié pleine.
- Placez un flacon de 4 mL de collecte des déchets dans la colonne.
- Faire tremper le gel de silice dans la pipette et 3 volumes d’hexane. Cela la colonne des conditions, supprime les bulles d’air et rince les éventuelles impuretés hors du gel de silice.
- Une fois le lavage final est terminé, retirer la cuvette de la collecte des déchets et le remplacer par un flacon pour recueillir la fraction apolaire.
- Transvaser avec soin l’ensemble de l’échantillon dans l’hexane dans la colonne à l’aide d’une pipette. Rincer le flacon d’échantillon deux fois plus petits volumes d’hexane et transvaser dans la colonne. Permettre à l’hexane, que l’échantillon a été transféré à se pour imbiber complètement le gel de silice. À aucun moment au cours de la procédure devrait le silicagel dessécher.
- Continuez à ajouter hexane à la partie supérieure de l’échantillon jusqu'à ce que le flacon de collection sous la colonne est presque plein (~ 4 mL).
- Permettre à tous de l’hexane pour entrer dans le gel de silice avant de commencer avec le solvant prochain.
- Placer le flacon de collection de polarité moyenne sous la colonne.
- Ajouter DCM vers le haut de la colonne jusqu'à ce que le flacon est presque plein. Encore une fois, permettre à tous de la DCM pour entrer dans le flacon de collection avant de commencer le prochain solvant.
- Placer le flacon de collection polar au titre de la colonne.
- Ajouter méthanol vers le haut de la colonne jusqu'à ce que la collection vile est presque pleine.
Subscription Required. Please recommend JoVE to your librarian.
Results
Cette technique de purification produit trois flacons différents, chacun contenant une classe de composés différent ou un groupe de classes de composés. La complexité d’un échantillon à analyser sur un instrument a été considérablement réduite. Ce procédé élimine également les composés, tels que les acides produites au cours de la saponification, qui peut réellement s’en tenir aux parties des instruments, en raison de leur faible volatilité, ce qui diminuerait leur exactitude, précision et durée de vie.
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
Alkénones et isoprenoidal GDGTs sont les deux constituants très courants de sédiments marins et peuvent être trouvés à travers les océans du monde. Alkénones sont plus détectés dans les sédiments lacustres, bien que les organismes responsables de leur production sont différents dans l’océan et donc la relation entre l’Uk'37 ratio et l’eau de la température (étalonnage) est différente de l’océan et même entre les lacs séparés. Isoprenoidal GDGTs se trouvent dans certains grands lacs et à l’instar d’alkénones, souvent besoin d’un étalonnage locaux.
Les alcénones et GDGTs, nous nous intéressons à sortent dans la cétone et fractions polaires, respectivement. Dans les sédiments marins, nous analysons souvent les deux procurations de température de surface (SST) de mer dans un échantillon. Cela permet la construction de deux indépendants SST records, qui montrent l’évolution de la température de l’eau sur le site de la base à travers le temps. Cette comparaison, appelée une approche multi-proxy, souvent met en évidence des fois quand les deux procurations d’accord et moments où ils ne font pas. Cet accord ou divergence lui-même contient des informations. Si les deux procurations d’accord, peut-être les organismes produisant la même profondeur habitat occupent, ou peut-être ils vivaient à des profondeurs distinctes, mais une colonne d’eau bien mélangé a conduit à l’homogénéisation verticale de la température (l’eau se refroidit généralement avec la profondeur). Si les deux procurations sont en désaccord, il pourrait être que les deux populations vivent à des profondeurs distinctes ; vivant dans des eaux chaudes et peu profondes et dans l’eau plus fraîche, plus profond. Ou il pourrait être que les composés ont été produites au cours de différentes périodes de l’année et reflètent donc les températures des différentes saisons. Ces questions sont créées par l’analyse de deux procurations de SST différentes sur le même site et elles mettent en évidence les géochimistes bio soins et paléoclimatologues ont besoin à prendre lors de l’interprétation de leurs données.
En raison de la relative stabilité élevée d’hydrocarbures apolaires, la fraction apolaire contient de nombreux composés organiques intéressants. Les alcanes sont des constituants importants de la couche cireuse externe de la feuille, et ils sont utilisés dans les documents de sédiments pour de nombreuses raisons. La longueur de leur chaîne moyenne (nombre d’atomes de carbone) contient des informations sur la dominance d’aquatiques contre les plantes terrestres, la température et des précipitations. Le rapport isotopique du carbone dans les alcanes est lié au type plante de C3 et C4 de la plante qui l’a produite, et le rapport isotopique de l’hydrogène est lié au niveau local à des précipitations et la température globale. Stéranes et hopanes se trouvent aussi dans la fraction apolaire. Ces biomarqueurs sont les versions geostable des composés bioactifs tels que hopanoids et stéroïdes, qui servent un rôle biochimique important dans les procaryotes et les eucaryotes, respectivement.
La fraction de polarité moyenne contient notre alkénones. Alkénones sont des cétones, qui sont des enregistreurs importants antiques des températures de surface par l’intermédiaire de la Uk'37 proxy de mer la température de surface. Quelques cétones proviennent également les cires de feuille même que les alcanes font, bien qu’il n’y a généralement beaucoup moins.
La fraction polaire contient des acides carboxyliques, un autre facteur constitutif dans la cire des feuilles, c’est un peu moins précis et plus difficile à travailler que les alcanes (faible volatilité) mais peut néanmoins concerner certaines des mêmes informations. Tetraethers de glycérol glycérol dialkyl (GDGTs) sont dans la fraction polaire et un autre enregistreur important des températures de l’eau et l’air anciens.
Subscription Required. Please recommend JoVE to your librarian.
References
Killops, S. and Killops, V. Introduction to Organic Geochemistry. Blackwell Publishing, Malden, MA (2005).




