Overview
Quelle: Tamara M. Powers, Department of Chemistry, Texas A & M Universität
Metal Carbonyl-komplexe werden als Metall Vorläufer für die Synthese von metallorganischen komplexe sowie Katalysatoren verwendet. Infrarotspektroskopie (IR) ist einer der eingesetzten und informative Charakterisierungsmethoden Co, Verbindungen enthalten. Gruppentheorie oder die Verwendung von Mathematik, die Symmetrie eines Moleküls zu beschreiben bietet eine Methode, um die Anzahl der IR aktiven C-O-Schwingungs-Modi innerhalb eines Moleküls Vorhersagen. Experimentell beobachtet, dass die Anzahl der C-O in der IR erstreckt, ist eine direkte Methode, die Geometrie und Struktur der Metal Carbonyl Komplex zu etablieren.
In diesem Video werden wir die Molybdän Carbonyl Komplex Mo(CO)4[P(OPh)3]2, synthetisieren, das in den Cis- und Trans -Formen (Abbildung 1) vorhanden sein können. Wir werden Gruppentheorie und IR-Spektroskopie verwenden, um festzustellen, welche Isomer isoliert ist.
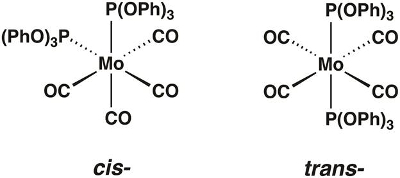
Abbildung 1. Der Cis- und Trans-Isomere von Mo(CO)4[P(OPh)3]2.
Principles
Auswahlregeln:
Auswahlregeln bestimmen die Anzahl der elektronischen Übergänge von einem Quantum Zustand zu einem anderen, für ein gegebenes Molekül möglich sind. IR-Spektroskopie-Sonden Schwingungs Übergänge vom Grundzustand des Moleküls, V = 0, um den ersten angeregten Zustand, V = 1. Die Anzahl der Freiheitsgrade Schwingungs (Normalschwingungen Vibration) für lineare und nicht lineare Moleküle kann mit Gleichung 1 und Gleichung 2, bzw. berechnet werden.
3N - 5 (1)
3N - 6 (2)
wo N = Anzahl der Atome im Molekül
Normalen Modus der Schwingung IR aktiv zu sein muss das Molekül Dipol ändern. Daher sind Normalschwingungen Vibration, wo eine Änderung der Dipol tritt nicht auf, IR inaktiv. Die Anzahl der aktiven IR-Modi kann durch Gruppentheorie bestimmt werden.
Gruppentheorie:
Chemiker benutzen Gruppe Theorie um zu verstehen, die Beziehung zwischen die Symmetrie und die physikalischen Eigenschaften eines Moleküls. Während der Bereich der Gruppentheorie zu breit um rigoros in diesem Video zu decken ist, stellen wir die notwendigen Werkzeuge benötigt, um einfache Koordination komplexe Gruppentheorie zuweisen und zeigen, wie es verwendet werden, um die Anzahl der aktiven Schwingungs Modi IR Vorhersagen. Um zu demonstrieren, werden wir durch die Anwendung der Gruppentheorie, das Molekül Cis -Mo(CO)4[P(OPh)3]2laufen.
Zuerst müssen wir die Punktgruppe des Moleküls zu ermitteln. Punktgruppen werden verwendet, um die Symmetrie-Elemente, die in einem bestimmten Molekül zu beschreiben. Um die Punktgruppe des Cis -Mo(CO)4[P(OPh)3]2zu ermitteln, nutzen wir ein Flussdiagramm genannt einen Symmetrie-Baum, der eine Reihe von Fragen über die Symmetrie Elemente im Molekül (Abbildung 2) fragt. Tabelle 1 enthält eine Zusammenfassung aller Symmetrie Elemente in der Symmetrie-Baum enthalten. Mit der Symmetrie-Baum, und vorausgesetzt, dass die Liganden P(OPh)3 Punkt Liganden (unter Missachtung der Symmetrie dieser Liganden), finden wir, dass GUS -Mo(CO)4[P(OPh)3]2 in die Punktgruppe C ist 2v.

Abbildung 2. Symmetrie-Baum für Punkt Gruppenentscheidung verwendet.
Tabelle 1. Symmetrie-Elemente verwendet in Punkt Gruppenentscheidung.
| Symmetrie-element | Symbol verwendet | Beispiel * |
| Identität | E |  |
| Drehachse (Drehung von 360 ° / n) |
C n |  |
| Horizontale Spiegelebene (Reflexion über die Xy-Ebene) |
Σ h |  |
| Vertikale Spiegelebene (Reflexion über Xz oder Yz-Ebene) |
Σ v |  |
| Diagonale Spiegelebene (Reflexion zwischen Xz und Yz-Ebenen) |
Σ d |  |
| Inversion Center | Ich |  |
| Unsachgemäße Drehachse (Drehung von 360 ° / n gefolgt von Reflexion senkrecht zur Drehachse) |
S n |  |
| * Beispiele sind für einem oktaedrischen Komplex, wo Liganden 1–6 gleichwertig sind. Auf die Operation, sollte das resultierende Molekül von seiner ursprünglichen Konfiguration zu unterscheiden. | ||
Wir müssen für den nächsten Schritt Zeichentabellen, einzuführen, die alle die Symmetrie vorhanden innerhalb einer bestimmten Gruppe zu beschreiben. Die Zeichentabelle für die Punkt-Gruppe- C-2v ist unten dargestellt.
| C 2v | E | C 2 | Σ v (Xz) | Σ v ' (Yz) | ||
| A 1 | 1 | 1 | 1 | 1 | z | x2, y2, Z2 |
| A 2 | 1 | 1 | −1 | −1 | R-z | XY |
| B 1 | 1 | −1 | 1 | −1 | X, Ry | XZ |
| B 2 | 1 | −1 | −1 | 1 | y, Rx | YZ |
Die Punktgruppe wird in der oberen linken Ecke der Zeichentabelle angezeigt. Auf der rechten Seite der Punktgruppe sind alle Symmetrie Vorgänge in dieser Punktgruppe aufgeführt.Die nachfolgenden Zeilen auflisten aller Symmetrie Darstellungen (irreduziblen Darstellungen, vertreten durch Mulliken-Symbole, i.e.,A1) in dieser Punktgruppe, zusammen mit der Symmetrie von Funktionen, die erzählen von der Symmetrie der enthaltenen atomaren orbitale sowie lineare Bewegung entlang der x-, y- und z-Achse.
Mit der Zeichentabelle für die Punkt-Gruppe- C-2v, erzeugen wir eine reduzierbar (Γrot) Darstellung der C-O stretching Modi in das Molekül Cis -Mo(CO)4[P(OPh)3]2 (Abbildung 3 ). Die reduzierbar Darstellung oder die Linearkombination der irreduziblen Darstellungen können durch Anwendung jeder der Symmetrie Vorgänge innerhalb der Zeichentabelle auf die Schwingungen im Molekül und aufzeichnen, die Anzahl der C-O-Schwingungen erzeugt werden, die bleiben Sie unverändert (in der gleichen Position im Raum). Z. B. auf die C-O-Schwingungen in Cis -Mo(CO)4[P(OPh)3]2das Identity-Symmetrie-Element zuweisen, bleiben alle vier der Schwingungs Pfeile in der gleichen Position. Daher ist der erste Wert in unserer reduzierbar Darstellung 4. Wenn wir diese Übung weiter, generieren wir die reduzierbar Darstellung unten gezeigt.
| C 2v | E | C 2 | Σ v (Xz) | Σ v ' (Yz) |
| Γ rot | 4 | 0 | 2 | 2 |
Als Nächstes verwenden wir die C-2v -Zeichentabelle Linearkombination der irreduziblen Darstellungen zu finden, die Γrot für die C-O-Schwingungen im Cis -Mo(CO)-4[P(OPh)3]2erzeugt. Reduktion der reduzierbaren Darstellung kann mit der Reduzierung der Formel in Gleichung 3erreicht werden.
 (3)
(3)
Wo:
nich mehrmals die irreduzible Darstellung ich in der reduzierbaren Darstellung tritt =
h = Ordnung der Gruppe (Gesamtzahl der Symmetrie Operationen)
c = die Klasse der Betrieb
gc = Anzahl der Vorgänge in der Klasse
Χ Ich = Zeichen der irreduziblen Darstellung für den Betrieb der Klasse
Χ R = Zeichen der reduzierbaren Darstellung für den Betrieb der Klasse
Mit Gleichung 3 für jede der irreduziblen Darstellungen in der Zeichentabelle C2v, finden wir, dass Γrot = 2A1 + B1 + B2. Alle drei beteiligten irreduziblen Darstellungen, A1, B1und B2, sind IR aktiv, weil sie zu, wie die x-, y- oder z-Achse verwandeln (siehe die Symmetrie von Funktionen in der Zeichentabelle). Daher erwarten wir, dass GUS -Mo(CO)4[P(OPh)3]2 4 C-O stretching Modi in seinem IR-Spektrum aufweisen wird.
Zusammenfassend lässt sich sagen, sind folgende Schritte notwendig, um die Anzahl der IR aktiven Schwingungs-Modi in einem Molekül zu ermitteln:
1. bestimmen der Punktgruppe des Moleküls.
(2) erzeugen Sie eine reduzierbar Darstellung der C-O stretching Vibrationen innerhalb des Moleküls.
3. reduzieren Sie die reduzierbar Darstellung mit Gleichung 3.
4. ermitteln Sie die Anzahl der translationalen irreduziblen Darstellungen in die verkleinerte Darstellung von Schritt 3 vorhanden.
Wenn wir diese 4 mit Trans -Mo(CO)4[P(OPh)3]2 Schritte, finden wir, dass das Molekül nur 1 aktive C-O-Schwingungen-Modus besitzt.

Abbildung 3. CO Schwingungs erstreckt sich in GUS-Mo(CO)4[P(OPh)3]2.
Subscription Required. Please recommend JoVE to your librarian.
Procedure
1. Setup der Schlenk-Linie (für eine genauere Verfahren, lesen Sie bitte die "Schlenk Linien übertragen von Lösungsmittel" Video der Serie Essentials of Organic Chemistry ). Schlenk Linie Sicherheit sollte überprüft werden, vor der Durchführung dieses Experiments. Gläser sollten für Sterne Risse vor Gebrauch überprüft werden. Darauf sollte geachtet werden, um sicherzustellen, dass O2 ist nicht in der Schlenk Linie Falle kondensiert, wenn Flüssigkeit N2verwenden. Bei N2 Flüssigkeitstemperatur O2 kondensiert und explosiv in Anwesenheit von organischen Lösungsmitteln. Wenn der Verdacht besteht, dass O2 verdichtet worden oder eine blaue Flüssigkeit in die Kühlfalle eingehalten wird, lassen Sie die Falle unter dynamischen Vakuum kalt. Entfernen Sie die Flüssigkeit N2 Falle nicht oder schalten Sie die Vakuumpumpe. Im Laufe der Zeit wird die Flüssigkeit O2 in die Pumpe erhaben; Es ist nur sicher, die flüssige N2 Falle zu entfernen, sobald alle O2 hat sublimiert.
- Schließen Sie das Überdruckventil.
- Aktivieren Sie das N2 Gas und die Vakuumpumpe.
- Als die Schlenk Linie Vakuum erreicht seine Mindestdruck, bereiten die Kühlfalle mit Flüssigkeit N2 oder Trockeneis/Aceton.
- Montieren Sie die Kühlfalle.
(2) Synthese von Mo(CO)4[P(OPh)3]2 (Abbildung 4)1
Hinweis: Verwenden Sie standard Schlenk-Linie-Techniken für die Synthese von Mo(CO)4[P(OPh)3]2 (siehe Video "Synthese einer Ti(III) Metallocen-Katalysatoren mit Schlenk Linie Technik"). Metal Carbonyl-komplexe sind eine Quelle für kostenlose CO, das ist hochgiftig. Kohlenmonoxid-Vergiftung tritt auf, wenn CO an Hämoglobin bindet, wodurch deutliche Reduzierung der Sauerstoffversorgung des Körpers. Daher ist es äußerst wichtig, entsprechende Schutzmaßnahmen beim Umgang mit und arbeiten mit Metall Carbonyl-komplexe. Reaktionen, die kostenlose CO generieren müssen in einem gut gelüfteten Abzug zur Vermeidung der Exposition mit dem giftigen Gas durchgeführt werden.
- Fügen Sie 1,6 g (4,92 Mmol) Mo(CO)4(Nbd) (Nbd = 2,5-Norbornadiene) und 1,6 mL (9.84 Mmol) Triphenyl gefährdeten (P(OPh)3) in einem 100 mL-Schlenk-Kolben und die Kanüle Übertragung des Lösungsmittels Schlenk-Kolben vorbereiten.
Hinweis: Mo(CO)4(Nbd) ((Bicyclo[2.2.1]hepta-2,5-diene)tetracarbonylmolybdenum(0)) von Sigma-Aldrich erworben werden können oder mit Literatur Methoden synthetisiert. 2 - Schlenk-Kolben per Kanüle 20 mL entgast Dichlormethan hinzufügen.
- Rühren Sie das Reaktionsgemisch für 4 h bei Raumtemperatur unter N2.
- Entfernen Sie die flüchtigen Bestandteile unter Vakuum und die daraus resultierenden waschen mit kaltem Hexanes Niederschlag (zwei wäscht jede mit 10 mL, −78 ° C).
- Trocknen Sie das feste Produkt unter Vakuum für 15 min.
- IR-Spektrum des Produkts in einer Lösung von Hexanes zu messen.

Abbildung 4. Synthese von Mo(CO)4[P(OPh)3]2.
Gruppen-Theorie ist ein mathematisches Modell verbinden molekulare Symmetrie mit Eigenschaften wie IR-aktiv-Schwingungs-Modi.
Jedes Molekül kann mit einer Punktgruppe, die jedes Element der Symmetrie vorhanden in einem Molekül in Bezug auf einen festen Punkt beschreibt eingestuft werden.
Gruppentheorie bietet spezielle Tabellen, so genannte Zeichentabellen, um vorherzusagen, die Wirkung von einem Molekül Symmetrie auf seine Schwingungs-Modi und andere wichtigen Eigenschaften.
Dieses Video diskutieren die zugrunde liegenden Prinzipien der Gruppentheorie, illustrieren das Verfahren für die Synthese und Charakterisierung von ein Isomer des Mo(CO)4[P(OPh)3]2, und stellen einige Anwendungen der Gruppentheorie in Chemie.
Molekulare Symmetrie beschreibt die nisht zu unterscheidend Konfigurationen eines Moleküls. Die Transformationen zwischen ihnen heißen Symmetrie Operationen, die auftreten in Bezug auf ein oder mehrere Elemente der Symmetrie.
Die fünf Elemente der Symmetrie sind richtige und falsche Rotationsachsen Spiegel Flugzeuge, Zentren der Inversion und Identität. Jedes Molekül hat das Identität Element oder E, in denen keine Änderung Eintritt.
Eine Spiegelebene, σ, beschriftet ist eine Reflexion Flugzeug mit identischen beginnend und endend Konfigurationen. Moleküle können mehr als eine Spiegelebene haben. Ein Zentrum der Inversion, beschriftet ich, ist ein Punkt durch die jedes Atom reflektiert wird.
Eine ordnungsgemäße Drehachse ist eine Achse, um die sich ein Molekül zu einer identischen Konfiguration dreht. Es ist beschriftet, Cn, wobei n 360 geteilt durch den Drehwinkel ist.
Eine unsachgemäße Rotationsachse, mit der Bezeichnung Sn, ist die Achse, um die ein Molekül gedreht wird und dann durch eine senkrecht Spiegelebene reflektiert . Moleküle können mehr als eine Rotationsachse haben. Die Achse mit der höchsten n ist die Hauptmittellinie.
Punktgruppen mit einem Symmetrie-Baum, der die Symmetrie-Operationen notwendig, um das Molekül zu klassifizieren identifiziert werden Moleküle zugewiesen.
Z. B. BF3 ist eine nichtlineare. Es tut nicht haben mindestens zwei Achsen mit n größer als 2. Es hat mindestens eine Drehachse; Die Hauptmittellinie ist C3. Es hat drei C2 Achsen senkrecht zu seiner Hauptachse und eine Spiegelebene senkrecht zu seiner Hauptachse. Boron Trifluoride gehört zu der Punktgruppe D3 h .
Jeder Punktgruppe hat eine Zeichentabelle mit seinen wesentlichen Symmetrie-Operationen. Jede Zeile enthält eine irreduzible Darstellung der Vorgänge, zusammen mit den entsprechenden atomaren orbitale und Linearbewegungen.
Reduzierbar Darstellungen entstehen durch die Auswertung, wie diese Symmetrie Operationen molekularen Eigenschaften auswirken. Reducing diese Darstellung gibt die Beitragenden irreduziblen Darstellungen.
Nun, Sie die Prinzipien der Gruppentheorie verstehen, gehen wir durch ein Verfahren zur Synthese ein Isomer des Mo(CO)4[P(OPh)3]2 und Vergleich ihrer IR-Spektrum, die Anzahl der IR-aktiven Modi für jedes Isomer von vorhergesagt Gruppentheorie.
Um den Vorgang zu starten, schließen Sie die Schlenk Linie Vent, und starten Sie den Gasstrom N2 .
In einer Dampfhaube 0,5 g Mo(CO)4(Nbd) messen Sie ab und Molybdän-Vorläufer in einen 200-mL-Schlenk-Kolben. Statten Sie der Reaktionskolben mit Stir Bar und Verschluss der Flasche mit einem Glasstopfen. Verbinden Sie den Kolben mit der Schlenk-Linie über den Seitenarm, und Vorbereitung des Kolbens für die Kanüle Übertragung durch Evakuierung des Schiffes für 5 Minuten, gefolgt von Nachfüllen der Küvette mit N2. Wiederholen Sie diese Evakuierung und Nachfüllen Sie Prozess insgesamt 3 Mal.
Als nächstes bereiten Sie ein weiteres Schlenk-Kolben ausgestattet mit einer Gummiseptum mit 20 mL CH2Cl2. Schließen Sie die Flasche an die Schlenk an und sichern Sie die Flasche in der Haube. Mit einer Spritze, 0,87 mL Triphenyl gefährdeten auszuarbeiten und in den Schlenk-Kolben zu verzichten. Sicherstellen Sie, dass die Schlenk Linie Absperrhahn N2offensteht. Entgasen Sie die CH2Cl2/triphenyl gefährdeten Mischung von sprudelnden N2 durch das Lösungsmittel für 10 Minuten. Dann verwenden Sie Kanüle Übertragung der Küvette mit festen der Projektmappe hinzu. Öffnen Sie den Reaktionskolben N2 Gas und rühren Sie die Mischung für 4 Stunden bei Raumtemperatur.
Wenn die Reaktion beendet ist, ersetzen Sie die Gummiseptum mit einem Glasstopfen, und entfernen Sie flüchtige Lösungsmittel im Vakuum.
Hinzufügen, Hexanes um die resultierende Produkt und kühlen in einem Trockeneis/Aceton Bad kurz, bis ein Niederschlag Formen. Filtern Sie den Niederschlag zu und waschen Sie das Präzipitat zweimal mit 10 mL kalte Hexanes und sammeln Sie die Solid durch Filtration. Trocknen Sie das feste Produkt unter Vakuum 15 Minuten.
Zu guter Letzt lösen Sie einen Teil des Produkts in Hexanes auf und laden Sie die Lösung in einer IR-Zelle. Erwerben Sie eine IR-Spektrum des Komplexes.
Nun, lassen Sie uns feststellen, ob das Produkt Cis oder Trans -Isomer durch Zuweisen von Punktgruppen zu beiden Isomere und Vergleich der prognostizierten IR-aktiv-Modi, um IR-Spektrum.
GUS-Staaten weder die Trans -Isomer ist linear, und hat weder mehr als zwei Rotationsachsen mit Bestellungen höher als 2. Beide haben mindestens eine Drehachse. Die Hauptachsen für Cis und Trans -Isomere sind C2 und C4, beziehungsweise.
Das Cis -Isomer keinen zwei C2 Achsen senkrecht zur Erdachse C2 hat, noch es eine senkrechte Spiegelebene. Es hat zwei Spiegelflächen mit der C-2 -Achse, also die Punktgruppe C2v. Das Trans -Isomer hat vier C2 Achsen und einer Spiegelebene senkrecht zur Erdachse C4 so die Punktgruppe D4 h.
Nächste, reduzierbar Darstellungen von den CO-Strecken entstehen durch das Molekül jede Symmetrie Betrieb zuweisen und zählen die C-O-Strecken, die Standorte im Raum unverändert bleiben.
Der C-2v -Tisch hat vier Operationen: Identität, C-2 -Rotation und Reflexionen durch zwei Spiegelflächen mit der C-2 -Achs. An der Operation Identität bleiben alle vier Dipolmomente. Alle vier Dipolmomente nehmen verschiedene Positionen nach einer C-2 -Rotation. Zwei Dipolmomente bleiben in der gleichen Position für jede Reflektion.
Die Verringerung der Formel berechnet den Koeffizienten der jede irreduzible Darstellung in der reduzierbaren Darstellung. Die Frage Gruppe Auftrag ist die Anzahl der Symmetrie Operationen. Klassen sind Typen von Symmetrie Operationen. Hier ist die Anzahl der Vorgänge in jeder Klasse 1, die traditionell eine Zeichentabelle ausgelassen wird.
Der Charakter ist der Wert entsprechend zu einer Vertretung einer bestimmten Klasse. Wenn die Verringerung der Formel angewendet wird, drei irreduzible Darstellungen zu finden sind, mit einem doppelt auftreten. Diese Darstellungen transformieren als die x-, y-oder Z -Achse, die mit vier C-O IR-aktive Strecken übereinstimmt.
Mit der gleichen Technik, das Trans -Isomer gefunden wird, einer IR-aktive C-O-Ausdehnung haben. IR-Spektrum des Messguts Molybdän hat Gipfel bei 2046, 1958 und 1942 cm-1. Mit höherer Auflösung Daten kann eine vierte C-O-Stretch beobachtet werden. Basierend auf den erhaltenen IR, kann man feststellen, dass die isolierte Mo(CO)4[P(OPh)3]2 komplex das Cis -Isomer.
Gruppentheorie ist weit verbreitet in der organischen und anorganischen Chemie. Schauen wir uns ein paar Beispiele.
Raman-Spektroskopie erkennt molekulare Schwingungen, bei denen Änderungen im Polarisierbarkeit in der Elektronenhülle. Eine symmetrische Dehnung in CO2 ändert nicht das Dipolmoment und ist daher nicht IR-aktiv. Jedoch ändern Elektronen Abkehr von Kernen die Polarisierbarkeit, so dass die Strecke Raman-aktiv. Raman-aktiv-Schwingungs-Modi erkennen Gruppentheorie nach der gleichen allgemeinen Methode zur Identifizierung von IR-aktiven Modi.
Molekularer orbital Theorie oder MO-Theorie, ist ein Modell verwendet, um die Bindung in Molekülen zu beschreiben. Addieren und Subtrahieren der atomaren orbitale von zwei Atomen führt zur Bildung von molekularen orbital Diagramme von einfachen Diatomics.
Um MO-Diagramme der Übergang Metall komplexe zu generieren, verwenden Wissenschaftler Gruppentheorie Symmetrie angepasste lineare Kombinationen von atomaren orbitale zur Darstellung der äußeren Atome oder Liganden erzeugen. Dies wird erreicht, indem reduzierbar Darstellungen der Liganden atomaren orbitale generieren, und dies dann auf eine irreduzible Darstellung zu reduzieren.
Die Symmetrie Darstellungen der das Metallzentrum und Symmetrie angepasste lineare Kombinationen werden im Diagramm verglichen. In diesem Modell überlappen orbitale mit dem gleichen Symmetrie zu bilden zwei Molekülorbitale.
Sie habe nur Jupiters Einführung in die Gruppentheorie beobachtet. Sie sollten jetzt vertraut sein mit den zugrunde liegenden Prinzipien der molekulare Symmetrie zu finden die Punktgruppe eines Moleküls und einige Beispiele wie Gruppentheorie in organischer und anorganischer Chemie verwendet wird. Danke fürs Zuschauen!
Subscription Required. Please recommend JoVE to your librarian.
Results

Abbildung 5. IR Mo(CO)4[P(OPh)3]2.
Lösung IR in gesättigten Kohlenwasserstoff (cm-1): 2046 (s), 1958 (s), 1942 (Vs).
Die vierte Resonanz kann nur hoch auflösende Bedingungen gesehen werden. Daher ist es möglich, da in diesem Fall, dass nur 3 der 4 Resonanzen eingehalten werden.
Basierend auf den erhaltenen IR, können wir daraus schließen, dass Cis-Isomer des Mo(CO)4[P(OPh)3]2 wurde isoliert.
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
In diesem Video haben wir gelernt, wie Gruppentheorie verwenden, um die Anzahl der IR aktiven Schwingungs-Modi in einem Molekül Vorhersagen. Wir das Molekül Mo(CO)4[P(OPh)3]2 synthetisiert und IR verwendet, um festzustellen, welche Isomer isoliert wurde. Wir beobachteten, dass das Produkt hatte drei C-O-Schwingungen in ihrer IR-Spektrum, die im Einklang mit dem Cis-Isomer.
Gruppentheorie ist ein leistungsfähiges Werkzeug, das von Chemikern nicht nur IR aktiv Schwingungs-Modi, Vorhersagen verwendet aber auch Schwingungs, Rotations- und anderen Niederfrequenz-Modi in der Raman-Spektroskopie zu beobachten. Darüber hinaus ist Gruppentheorie theoretisch molekularen orbital (MO) implementiert, das am weitesten verbreitete Modell Verklebung in Übergang Metall komplexe zu beschreiben ist. MO-Diagramme von organischen und anorganischen Chemie, verwendet können Vorhersagen und beobachteten Reaktivität eines Moleküls zu erklären.
1St, 2Ndund 3rd Reihe Metal Carbonyl-komplexe sind in anorganische Synthese als Metall Vorläufer für komplexere metallorganischen Verbindungen verbreitet. Die häufigsten Arten von Reaktionen mit Metal Carbonyl-komplexe Beispiele für CO Liganden Substitution, Redox an das Metallzentrum und nukleophilen Angriff an der CO-Einheit. Metal Carbonyl-komplexe selbst sind weit verbreitet in der Katalyse. Zum Beispiel ist Hydroformylierung, die industrielle Herstellung von Aldehyden aus Alkenen, durch das Metall Carbonyl Komplex HCo(CO)3 (Abbildung 6) katalysiert.

Abbildung 6. Hydroformylierung von Metal Carbonyl Komplex HCo(CO)3.
Subscription Required. Please recommend JoVE to your librarian.
References
- Fukumoto, K., Nakazawa, H. Geometrical isomerization of fac/mer-Mo(CO)3(phosphite)3 and cis/trans-Mo(CO)4(phosphite)2 catalyzed by Me3SiOSO2CF3. J Organomet Chem. 693(11), 1968-1974 (2008).
- Darensbourg, M. Y., Magdalena, P., Houliston, S. A., Kidwell, K. P., Spencer, D., Chojnacki, S. S., Reibenspies, J. H. Stereochemical nonrigidity in heterobimetallic complexes containing the bent metallocene-thiolate fragment. Inorg Chem. 31(8), 1487-1493 (1992).
- Darensbourg, M. Y., Darensbourg, D. J. Infrared Determination of Stereochemistry in Metal Complexes. J Chem Ed. 47(1), 33-35 (1970).




