Overview
Quelle: Perchet Thibaut1,2,3, Meunier Sylvain1,2,3, Sophie Novault4, Rachel Golub1,2,3
1 Einheit für Lymphopoiese, Institut für Immunologie, Pasteur Institute, Paris, Frankreich
2 INSERM U1223, Paris, Frankreich
3 Université Paris Diderot, Sorbonne Paris Cité, Cellule Pasteur, Paris, Frankreich
4 Flow Cytometry Platfrom, Cytometry and Biomarkers UtechS, Center for Translational Science, Pasteur Institute, Paris, Frankreich
Die allgemeine Funktion des Immunsystems besteht darin, den Körper gegen infektiöse Organismen und andere Eindringlinge zu verteidigen. Weiße Blutkörperchen, oder Leukozyten, sind die Wichtigsten Akteure des Immunsystems. Bei einer Infektion werden sie aktiviert und initiieren eine Immunantwort. Leukozyten können in verschiedene Subpopulationen (z. B. myeloische Zellen, Lymphozyten, dendritische Zellen) unterteilt werden, basierend auf verschiedenen Parametern, die biologisch, physisch und/oder funktionell sein können (z. B. Größe, Granularität und Sekretion). Eine Möglichkeit, Leukozyten zu charakterisieren, ist durch ihre Oberflächenproteine, die hauptsächlich Rezeptoren sind. Jede Leukozytenpopulation drückt eine spezifische Kombination von Rezeptoren (z. B. zytotoxische, aktivierende, Migrationsrezeptoren) aus, die Teilmengen unter den Populationen definieren können. Da das Immunsystem eine breite Palette von Zellpopulationen umfasst, ist es wichtig, sie zu charakterisieren, um ihre Teilnahme an der Immunantwort zu entschlüsseln.
Die Durchflusszytometrie (FC oder FCM) ist eine weit verbreitete Methode zur Analyse der Expression von Zelloberflächen und intrazellulären Molekülen, die verschiedene Zelltypen in einer heterogenen Zellmischung charakterisiert und definiert. Durchflusszytometer bestehen aus drei Hauptsubsystemen: Fluidik, Optik und Elektronik. Das Fluidiksystem transportiert die Zellen in einem Strom so, dass sie nacheinander vor einem Laser passieren. Das Optiksystem besteht aus Lichtquellen (Lasern) zur Beleuchtung der Partikel, optischen Filtern zur Steuerung des resultierenden Lichts und Fluoreszenzsignalen an geeignete Detektoren. Schließlich wandelt das Elektroniksystem die erfassten Lichtsignale in elektronische Signale um, die vom Computer verarbeitet werden können. Wenn eine einzelne Zelle vor dem Laserstrahl verläuft, streut sie Licht. Ein Detektor vor dem Strahl misst die Vorwärtsstreuung (FS) und mehrere Detektoren zur Seitenstreuung (SC). Der FS korreliert mit der Zellgröße und SC ist proportional zur Granularität der Zellen. Auf diese Weise können Zellpopulationen oft allein aufgrund von Unterschieden in ihrer Größe und Granularität unterschieden werden.
Neben der Analyse der Größe, Form und Komplexität einer Zelle wird die Durchflusszytometrie häufig zur Erkennung der Expression von Zelloberflächenrezeptoren verwendet (1). Dies wird durch die Verwendung von fluorchrom-markierten monoklonalen Antikörpern erreicht, die an bekannte zellspezifische Rezeptoren binden. Bei Anregung emittieren diese gebundenen Fluorchrome ein Licht von spezifischer Wellenlänge, genannt Emissionswellenlänge, das erkannt und bewertet werden kann. Fluoreszenzmessungen liefern quantitative und qualitative Daten über fluorchromemarkierte Zelloberflächenrezeptoren. Hämatologen nutzten FC als erste für die therapeutische Nachbeobachtung von Immunzellpopulationen (2). Jetzt wird es für eine Vielzahl von Anwendungen wie Immunophenotypisierung, Zelllebensfähigkeit, Genexpression, Zellzählung und GFP-Analyse verwendet.
FACS (Fluorescent Activated Cell Sorter) ist eine spezialisierte Art der Durchflusszytometrie, die eine Population von Zellen mithilfe der fluoreszierenden Kennzeichnung in Subpopulation sortiert. Genau wie bei der konventionellen Durchflusszytometrie werden erste FS-, SC- und Fluoreszenzdaten gesammelt. Dann wendet die Maschine eine Ladung (negativ oder positiv) an und ein elektrostatisches Ablenksystem (Elektromagnete) erleichtert die Entnahme geladener Tröpfchen, die Zellen in geeigneten Röhren enthalten.
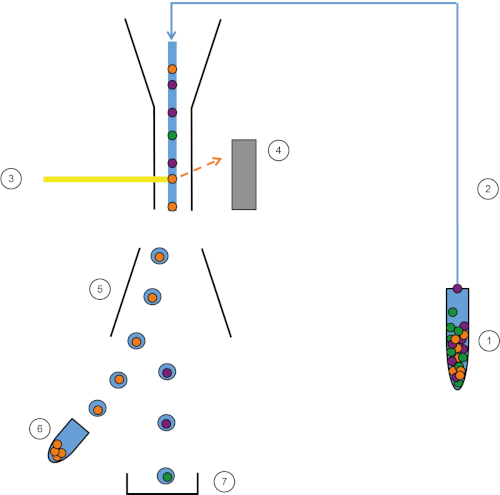
Abbildung 1: Schematische Darstellung von FACS. Probe (1) wird im FACS (2) angesaugt und vor dem Laser (3) übergeben. Die Zellfluoreszenz wird von Fluoreszenzdetektoren wahrgenommen (4). Schließlich werden die Zellen in Tröpfchen eingearbeitet und die von Interesse sindden Zellen durch Umlenkplatten (5) abgelenkt und in einem Sammelrohr (6) gesammelt. Die restlichen Zellen gehen in den Papierkorb (7). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Der Sortieraspekt des FACS bietet viele Vorteile. Viele Tests können helfen, die Rolle bestimmter Zellen im Immunsystem zu verstehen, wie z. B. Analysen der Genexpression wie RT-qPCR, Zellzyklus oder Zytokinsekretion. Allerdings sollten Zellen vorgelagert gereinigt werden, um klare und spezifische Ergebnisse zu erhalten. Hier kommt FACS nützlich und die gewünschten Zellen können mit großer Reinheit sortiert werden, was sehr zuverlässige und reproduzierbare Ergebnisse liefert. FACS kann auch verwendet werden, um Zellen basierend auf nuklearen oder anderen intrazellulären Färbung und entsprechend der Anwesenheit, Abwesenheit, und Dichte der Oberflächenrezeptoren zu sortieren. FACS ist jetzt eine Standardtechnik für die Reinigung von Subpopulationen von Zellen und hat die Fähigkeit, bis zu vier Populationen gleichzeitig zu sortieren.
Diese Übungseinheit im Labor zeigt, wie man milden Leukozyten isoliert und dann mit FACS gezielt B-Lymphzellen aus der Milz-Leukozyten-Zellmischung sortiert.
Procedure
1. Vorbereitung
- Vor Beginn Laborhandschuhe und die entsprechende Schutzkleidung anziehen.
- Sterilisieren Sie alle Sezierwerkzeuge, zuerst mit einem Waschmittel und dann mit 70% Ethanol und dann gründlich trocknen.
- Bereiten Sie 50 ml von Hanks ausgewogener Salzlösung (HBSS) vor, die 2% fetales Kalbsserum (FCS) enthält.
2. Dissektion
- Mit einem Kohlendioxid-Zufuhrsystem, euthanisieren Sie die Maus durch Hypoxie. Sichern Sie die eingeschläferte Maus auf einer Sezierplatte in der Supine-Position und führen Sie eine Längs-Laparotomie mit Schere und Zange durch.
- Mit Zange, bewegen Sie den Darm und Magen auf der rechten Seite des Bauches, um den Magen und Milz auszusetzen. Die Milz ist am Magen befestigt.
- Mit Zangen, lösen Sie die Milz vorsichtig aus dem Magen und legen Sie sie in die Petrischale mit 5ml HBSS 2% FCS.
3. Immunzellisolierung
- Legen Sie die Milz in ein 40-m-Zellsieb über die gleiche Petrischale. Crush die Milz mit einem Kolben, um es in der gleichen Schale zu dissoziieren.
- Übertragen Sie die dissoziierte Milz und die Flüssigkeit in ein 15mL Zentrifugenrohr.
- Zentrifugieren Sie das Rohr bei 370 x g für 7 min bei 10°C und entsorgen Sie den Überstand, um das Pellet zu vermeiden.
- Das Pellet in 2 ml Kaliumacetat wieder aufsetzen, um die Erythrozyten zu lysieren. Warten Sie 2 min und machen Sie dann das Volumen bis zu 15 ml mit HBSS 2% FCS.
- Zentrifugieren Sie das Rohr wieder bei 370 x g für 7 min bei 10°C. Entsorgen Sie den Überstand und setzen Sie das Pellet in 5ml von HBSS 2% FCS wieder aus.
- Zählen Sie die Zellen mit einem Trypan-Blau-Färbe-Assay und passen Sie die endgültige Zellkonzentration auf 107 Zellen/ml mit einem entsprechenden Volumen von HBSS 2% FCS an.
4. Zellfärbung
- Übertragen Sie 200 l der Zellsuspension in sechs FACS-Röhren, die mit 1 bis 6 gekennzeichnet sind.
- Zentrifugieren Sie die Rohre bei 370 x g für 7 min bei 10°C und entsorgen Sie den Überstand, um das Pellet zu vermeiden.
- Als nächstes bereiten Sie sechs neuartige Antikörpermischungen vor, indem Sie gemäß Tabelle 1 eine angemessene Menge an Antikörpern zu 200 l HBSS 2% FCS hinzufügen.
- Übertragen Sie diese Antikörpermischungen dann in die entsprechenden nummerierten FACS-Rohre.
- Inkubieren Sie die Zellsuspensionen mit den Antikörpern für 20 Minuten auf Eis im Dunkeln gemischt.
- Fügen Sie 1 ml HBSS 2% FCS zu jedem Rohr hinzu und zentrieren Sie dann wieder bei 370 x g für 3 min bei 10°C.
- Entsorgen Sie den Überstand und setzen Sie das Pellet in 200 l HBSS 2% FCS wieder aus.
- Übertragen Sie die resuspendierten Pellets in neue FACS-Rohre.

Tabelle 1: Antikörper mischen Zusammensetzung. Für das Experiment wurden sechs Mischungen von 200 l HBSS + Antikörper n. Chr. vorbereitet. Mix 1 ist für PMT-Einstellung, Mischungen 2 bis 5 sind für Kompensationseinstellungen und Mix 6 für die Zellensortierung.
5. FACS Kalibrierung
- Schalten Sie zunächst den Sortierer ein und führen Sie"Fluidics Startup"durch.
- Schalten Sie den Stream ein und warten Sie dann 15 min, bis sich der Stream stabilisiert.
- Passen Sie die Amplitude des Stroms an, um eine abgetrennte Tropfenbildung zu erhalten. Klicken Sie dann auf den "Sweet Spot", um die Amplitudenanpassung abzuschließen.
- Setzen Sie den Neutraldichtefilter (N.D.) Filter - 1.0 ein und öffnen Sie die "CST" Schnittstelle, die für Zytometer-Setup und -Tracking steht.
- Um die tägliche Qualitätskontrolle durchzuführen, verdünnen Sie zuerst die CST-Perlen mit FACS-Medium nach den Anweisungen des Herstellers und führen Sie dann die CST-Kontrolle durch.
- Sobald die CST-Steuerung abgeschlossen ist, ersetzen Sie den N.D. 1.0-Filter durch den N.D. 2.0-Filter am Zytometer.
- Anschließend werden Tropfenverzögerungsperlen in FACS-Medium nach den Anweisungen des Herstellers verdünnt und dann in das FACS geladen.
- Um sicherzustellen, dass eine ordnungsgemäße Sortierung Drop Delay-
- Klicken Sie zuerst auf "Spannung" und dann auf "Optischer Filter". Der rechte Quadrant sollte 100 % betragen. Stellen Sie bei Bedarf die rote Laserschraube am Zytometer links oder rechts ein, um 100% im rechten Quadranten zu erhalten.
- Führen Sie als Nächstes eine Testsortierung durch, um sicherzustellen, dass der Stream in das Auflistungsrohr fällt. Klicken Sie dazu auf "Waste Drawer" und starten Sie "TestSort". Überprüfen Sie, ob Seitenströme in Sammelrohre fallen. Wenn dies nicht der Fall ist, stellen Sie die Spannung ein, bis sie dies tun.
- Navigieren Sie zur experimentellen Vorlage. Öffnen Sie dann das "Accudrop Drop Delay" Experiment und klicken Sie auf das "Sortierlayout".
- Ändern Sie den Durchfluss, um 1000 bis 3000 Ereignisse pro Sekunde zu erhalten.
- Klicken Sie auf "Spannung" und dann auf "Optischer Filter". Der linke Quadrant sollte gleich 0 und der rechte Quadrant 100 sein.
- Klicken Sie im Fenster "Layoutsortieren " auf "Sortieren" und dann auf "Abbrechen". Der linke Quadrant sollte gleich 100 und der rechte Quadrant 0 sein. Wenn der linke Quadrant kleiner als 95 ist, klicken Sie auf"Auto Delay", um ihn automatisch anzupassen.
6. Durchflusszytometrie und Reinheitskontrolle
- Beginnen Sie die Durchflusszytometrie, indem Sie mit der Röhre 1 (ungefärbte Zellen) beginnen, um die Zellmorphologie und die negativen Spitzen der Fluorchrome zu definieren. Richten Sie die Vorwärts- und Seitenstreuung ein und definieren Sie die Spannungen der einzelnen Fluoreszenzparameter. Platzieren Sie die negative Population in den ersten zehn Jahren, indem Sie die Raster auf jedem Punktdiagramm verwenden.
- Als nächstes lasten Sie Rohr 2 (einfarbige Farbregelung) im Zytometer. Passen Sie die Spektralüberlappung an, bis die negativen und positiven Mediane der Grundgesamtheit ausgerichtet sind, oder verwenden Sie die automatische Berechnungssoftware. Es ist wichtig, das Signal auf der Skala zu halten. Kompensationskontrollen müssen den Einstellungen für experimentelle Fluorchrome und Detektoren entsprechen. Rekord 10.000 Events.
- Wiederholen Sie diese Schritte mit Tube 3, 4 und 5 (andere Einzelfarbensteuerungen).
- Als Nächstes laden Sie Tube 6 (mehrbefleckte Zellen) und definieren Sie Zellpopulationen von Interesse, indem Sie eine spezifische Gating-Strategie verwenden.
- Wählen Sie im Fenster Layout sortieren die von Interesse bestochene Zellenpopulation aus. Wählen Sie den Zellenschwellenwert in den "Zielereignissen" und die Genauigkeitsstufe in der "Genauigkeit" aus. Hier wird nur eine Population sortiert, aber vier verschiedene Populationen können gleichzeitig sortiert werden.
- Sobald Sie bereit sind, klicken Sie auf "Sortieren" und "OK", dann warten Sie auf die Zellensortierung.
- Sobald die Zellsortierung abgeschlossen ist, führen Sie eine Reinheitskontrolle durch, indem Sie zuerst 10 l sortierte Zellen in ein neues FACS-Rohr mit 90 MikroliterHBSS 2% FCS pipetieren.
- Dann laden Sie das Rohr das Zytometer. Zeichnen und analysieren Sie die Phänotypen der Zellen, um zu überprüfen, ob die Gating-Strategie wie beabsichtigt funktioniert hat.
7. Datenanalyse
- Öffnen Sie die 'FlowJo' Software und ziehen Sie die Dateien für jede Röhre im Fenster"Alle Beispiele".
- Doppelklicken Sie auf eine Datei, um sie in einem neuen Fenster zu öffnen.
- Klicken Sie auf das "Polygon" und erstellen Sie die zuvor verwendete Gating-Strategie neu.
- Wiederholen Sie die Schritte mit allen anderen Dateien.
- Um die Punktdiagramme zu visualisieren, klicken Sie auf "Layout-Editor" und ziehen Sie die Vonstächen-Populationen aus Tube 6 und reinheitskontrolle in der Layout-Editor-Registerkarte. Zellen sollten nur in der Bevölkerung von Interesse an Reinheitskontrolle erscheinen (siehe Abbildung 2).
- Um die Reinheit der B-Lymphozyten in den sortierten Zellen zu überprüfen, klicken Sie auf "Tabelleneditor". Ziehen Sie B-Lymphozytenpopulation aus Tube 6 und Reinheitskontrolle in der Tabelle.
- Wählen Sie im Menü "Statistik" die Frequenz von CD45+ Zellen aus, um die Reinheit dieser Zellpopulation zu testen, und klicken Sie dann auf "Tabelle erstellen".
- Parameterwerte werden in einer neuen Tabelle angezeigt. Überprüfen Sie im Reinheitskontrollfenster die Häufigkeit von B-Lymphozyten innerhalb der CD45+ Zellen, die höher als 98 % sein sollten (siehe Abbildung 2, untere Platte).
Das Immunsystem schützt den Körper vor eindringenden Krankheitserregern durch die Erzeugung von Leukozyten, auch weiße Blutkörperchen genannt. Wenn ein Erreger einen Organismus erfolgreich infiziert, wird eine Vielzahl von Leukozyten aktiviert und diese koordinierte Reaktion wird als Immunantwort bezeichnet.
Häufig ist es für Forscher nützlich, den spezifischen Typ und die Anzahl der Immunzellen zu identifizieren, die als Reaktion auf einen Erreger aktiviert wurden. Durchflusszytometrie ist eine Technik, die es Forschern ermöglicht, Zellen auf der Grundlage spezifischer Epitope, die auf ihren Oberflächen exprimiert werden, zu trennen. Dies wird mit fluorchromen gekennzeichneten monoklonalen Antikörpern erreicht, die an bekannte immunzellspezifische Epitope binden, und bei Anregung emittieren diese gebundenen Fluorchrome eine Wellenlänge des Lichts, die durch ein Durchflusszytometer erkannt und bewertet werden kann.
Durchflusszytometer bestehen aus drei Systemen. Das Fluidsystem transportiert Zellen in einem Strom so, dass sie nacheinander vor einem Laser passieren. Das optische System besteht aus Lasern und Detektoren, die das Vorhandensein oder Fehlen der Fluorophore erkennen. Schließlich wandelt das elektronische System die gesammelten optischen Daten zur Analyse in elektronische Dateien um.
Eine Erweiterung der Durchflusszytometrie ist der Fluoreszenz-aktivierte Zellsortierer (FACS), der die Anreicherung bestimmter Zellpopulationen ermöglicht, so dass sie unabhängig untersucht werden können. Die Zellsortierung erfolgt mit einer vibrierenden Düse innerhalb des Fluidics-Stroms, die Mikrotröpfchen bildet, die jeweils eine einzelne Zelle enthalten. Dann bestimmt ein Detektor, ob von jedem Tröpfchen fluoreszierendes Licht emittiert wird, und auf der Grundlage dieser Informationen gibt ein Elektromagnet jeder Zelle eine negative oder positive Ladung. Als nächstes sortiert ein starkes elektrisches Feld die unterschiedlich geladenen Tröpfchen in separate Behälter. Letztlich wird einer der Behälter eine homogene Population von Zellen enthalten, die auf der Expression eines bestimmten Zelloberflächenmoleküls basiert.
In diesem Video erfahren Sie, wie Sie die Durchflusszytometrie verwenden, um Leukozyten aus Mausmilzgewebe und FACS zu isolieren, um für B-Lymphozyten auszuwählen.
Zunächst laborhandschuhe und die entsprechende Schutzkleidung anziehen. Als nächstes waschen Sie eine Schere und zange zuerst mit Waschmittel und dann mit 70% Ethanol und trocknen Sie sie dann mit einem sauberen Papiertuch.
Fügen Sie dann 49 Milliliter von Hanks Balanced Salt Solution, oder HBSS, zu einem 50 Milliliter Rohr hinzu. Fügen Sie einen Milliliter Fetal Calf Serum oder FCS hinzu, um eine HBSS 2% FCS-Lösung zu erstellen und durch sanftes Pipetieren von etwa 10 Mal nach oben und unten zu mischen.
Als nächstes legen Sie eine eingeschläferte Maus in die Supine-Position auf einer Sezierplatte. Führen Sie mit der Schere und der Zange eine Längs-Laparotomie durch, um auf die Bauchhöhle zuzugreifen. Verwenden Sie die Zange, um den Darm auf der rechten Seite des Bauches auf eine Seite zu bewegen, um den Magen und milden zu belichten. Die Milz ist am Magen befestigt. Dann, mit einer Pipette, legen Sie fünf Milliliter der HBSS 2% FCS in eine Petrischale. Mit Zangen die Milz vorsichtig vom Magen lösen und die Milz in die Petrischale legen.
Um die Immunzellen zu isolieren, legen Sie zuerst die Milz auf ein 40 Mikron Zellsieb in einer Petrischale. Crush die Milz mit einem Kolben, um es in die Schale zu dissoziieren. Dann pipette die dissoziierte Milz und Flüssigkeit aus der Petrischale in ein 15 Milliliter Zentrifugenrohr. Zentrifugieren Sie das Rohr bei 370 mal g für sieben Minuten bei 10 Grad Celsius und holen Sie das Rohr dann vorsichtig ab, um das Pellet nicht zu stören.
Entfernen Sie nun den Überstand, vermeiden Sie das Pellet, und entsorgen Sie die Flüssigkeit in einem geeigneten Abfallbehälter. Fügen Sie dann zwei Milliliter ACK-Lysing-Puffer in das Zentrifugenrohr ein, um die Erythrozyten wieder aufzuhängen und zu lysen. Warten Sie zwei Minuten und fügen Sie dann HBSS 2% FCS hinzu, um ein Gesamtvolumen von 15 Millilitern zu erhalten. Wiederholen Sie die Zentrifugation. Holen Sie sich das Rohr sorgfältig und entsorgen Sie den Überstand. Setzen Sie das Pellet in fünf Millilitern HBSS 2% FCS wieder aus.
Um die resuspendierten Zellen zu zählen, verdünnen Sie fünf Mikroliter der Zellsuspension mit fünf Mikroliter trypan Blue. Dann legen Sie vorsichtig einen fünf Mikroliter Tropfen dieser verdünnten Zellsuspension zwischen dem Deckglas und der Malassez-Rutsche ab. Zählen Sie nun unter dem Mikroskop bei 40-facher Vergrößerung die Anzahl der vorhandenen Zellen. Passen Sie dann die Zellkonzentration auf 10 auf die siebten Zellen pro Milliliter an, indem Sie das entsprechende Volumen von HBSS 2% FCS hinzufügen.
Um die Immunzellen zu färben, beginnen Sie mit der Kennzeichnung von sechs FACS-Röhren von eins bis sechs. Dann 200 Mikroliter der Zelllösung in jede der sechs Röhren übertragen. Zentrifugieren Sie diese Rohre bei 370 mal g für sieben Minuten bei 10 Grad Celsius und entfernen Sie den Überstand.
Dann beschriften Sie sechs neue FACS-Rohre als eins bis sechs und Pipette 200 Mikroliter HBSS 2% FCS in jedem. Bereiten Sie die sechs neuartigen Antikörpermischungen vor, indem Sie jedem Rohr gemäß Tabelle 1 die entsprechende Menge an Antikörpern hinzufügen. Mix one ist für ungefärbte Zellen ohne Zugabe von Antikörpern. Mischungen von zwei bis fünf enthalten jeweils einen anderen Einzelantikörper für Kompensationseinstellungen. Mix six enthält alle vier Antikörper für mehrbefleckte Zellen, die zum Sortieren verwendet werden.
Als Nächstes übertragen Sie diese Antikörpermischungen auf die entsprechenden nummerierten FACS-Rohre. Inkubieren Sie diese Lösungen für 20 Minuten bei vier Grad Celsius oder auf Eis im Dunkeln. Als nächstes fügen Sie jedem Rohr einen Milliliter HBSS 2% FCS hinzu und zentrieren Sie dann erneut. Entsorgen Sie den Überstand und setzen Sie die Pellets in 200 Mikroliter HBSS 2% FCS wieder aus. Schließlich übertragen Sie die resuspendierten Pellets in neue markierte FACS-Rohre.
Um FACS auszuführen, schalten Sie zuerst die Sortierung ein. Wählen Sie dann das Zytometermenü aus, und klicken Sie auf Fluidics-Start. Folgen Sie den Anweisungen auf dem Bildschirm.
Klicken Sie auf der Registerkarte Stream auf das rote Kreuz, um den Stream einzuschalten, und warten Sie dann 15 Minuten, bis sich der Stream stabilisiert. Passen Sie die Amplitude des Streams an, bis auf der Registerkarte Stream ein klarer, getrennter Abwurf angezeigt wird. Klicken Sie dann auf Sweet Spot, um die Amplitudenanpassung abzuschließen. Legen Sie den Filter Neutral Dichte oder ND 1.0 vor den Laser ein.
Öffnen Sie das Zytometer-Menü oben auf dem Bildschirm und wählen Sie CST, das für Cytometer Setup and Tracking steht. Um die tägliche Qualitätskontrolle durchzuführen, verdünnen Sie zuerst CST-Perlen mit FACS-Medium in einem FACS-Rohr nach den Anweisungen des Herstellers. Laden Sie dann das Rohr in die Maschine und führen Sie die CST-Steuerung aus, indem Sie auf die Registerkarte CST auf Ausführen klicken.
Wenn das CST-Steuerelement abgeschlossen ist, ersetzen Sie den ND 1.0-Filter durch den ND 2.0-Filter am Zytometer. Anschließend werden die Tropfenverzögerungsperlen in FACS-Medium nach den Anweisungen des Herstellers verdünnt und anschließend in das FACS geladen. Um eine ordnungsgemäße Sortierung sicherzustellen, führen Sie die Drop-Delay durch erstes Klicken auf Spannung und dann optischen Filter durch. Der rechte Quadrant des optischen Filters sollte 100 % betragen, was darauf hindeutet, dass 100% der Tropfen von der Maschine registriert werden. Stellen Sie bei Bedarf die rote Laserschraube am Zytometer links oder rechts ein, um 100% im rechten Quadranten zu erhalten. Es ist wichtig, sicherzustellen, dass der Strom in das Sammelrohr fällt. Führen Sie dazu eine Testsortierung durch, indem Sie auf die Abfallschublade und dann auf die Sortierung klicken. Überprüfen Sie, ob die Seitenströme in die Sammelrohre fallen. Wenn dies nicht der Fall ist, stellen Sie die Spannung unter der Sortierregisterkarte ein, bis sie dies tun.
Navigieren Sie zur experimentellen Vorlage, indem Sie die Browser-Registerkarte auswählen und auf die freigegebene Ansicht klicken. Öffnen Sie dann das Accudrop_DROP DELAY-Experiment, und klicken Sie auf die Schaltfläche "Sortierlayout". Ändern Sie nun die Schwellenwertrate im Erfassungsdashboard, indem Sie die Durchflussrate so lange bearbeiten, bis sie 3.000 Ereignisse pro Sekunde erreicht. Klicken Sie auf Spannung und dann auf optischen Filter. Der linke Quadrant sollte gleich Null und der rechte Quadrant gleich 100 sein.
Klicken Sie schließlich im Sortierlayoutfenster auf Sortieren, und klicken Sie dann auf Abbrechen. Der linke Quadrant sollte gleich 100 und der rechte Quadrant gleich Null sein. Wenn der linke Quadrant kleiner als 95 ist, klicken Sie auf Autoverzögerung, um die Software anzuweisen, die Spannung automatisch zu erhöhen, um 100% der Tropfen im linken Quadranten zu erhalten.
Um mit der Durchflusszytometrie zu beginnen, werden wir zunächst ungefärbte Zellen verwenden, um die Zellmorphologie und die negativen Spitzen der Fluorchrome zu definieren. Um dies zu tun, platzieren Sie Rohr eins, das ungefärbte Zellen enthält, in der Maschine und klicken Sie unter der Registerkarte Erfassungs-Dashboard auf Laden. Passen Sie in der Zytometer-Registerkarte die vorwärts- und seitlichen Streuspannungen an, bis Sie Ihre Zellpopulation als dichte Konzentration von Punkten auf dem Bildschirm sehen. Lymphozyten sind kleine Zellen, so dass sie eine niedrige Vorwärtsstreuung und eine niedrige Seitenstreuung haben.
Entfernen Sie als Nächstes die Hintergrundfluoreszenz, indem Sie die Spannung für die Fluorchrome in der Zytometer-Registerkarte anpassen, bis die Zellpopulationen auf negativem Niveau in den ersten zehn Jahren auf der globalen Arbeitsblatt-Registerkarte sind. Klicken Sie im Cytometer-Menü auf die Ansichtskonfiguration und überprüfen Sie, ob alle Fluorchrome vorhanden sind. Als nächstes legen Sie Rohr zwei in das Zytometer und klicken Sie auf Last. Passen Sie die Spektralüberlappung auf der Registerkarte Zytometer an, bis die medianen negativen und positiven Grundgesamtheiten auf der Registerkarte Global Arbeitsblatt ausgerichtet sind. Legen Sie auf der Registerkarte "Erfassung" die Ereignisse auf 10.000 fest, und klicken Sie auf Datensatz. Wiederholen Sie diese Schritte mit den Rohren drei, vier und fünf.
Als nächstes Lastrohr sechs, das die multi-befleckten Zellen enthält. Um B-Lymphozyten zu isolieren, richten Sie zunächst die Parameter ein, um die Zellen basierend auf ihrer Morphologie zu sortieren. Zeichnen Sie im ersten Fenster den FSC-A-Vorwärtsstreubereich auf der y-Achse und den SSC-A-Seitenstreubereich auf der x-Achse. Im Streudiagramm stellt jeder Punkt eine Zelle dar. Klicken Sie auf das Polygontor im globalen Arbeitsblatt, und wählen Sie dann die Grundgesamtheit mit einer niedrigen Vorwärtsstreuung und einer Zwischenseite aus. Klicken Sie in einem neuen Punktplot-Fenster mit der rechten Maustaste auf das Fenster, und wählen Sie Populationen aus dem Menü anzeigen und klicken Sie auf P1.
Dann, im neuen Fenster, Gate die lebensfähigen CD45 positive Zellen durch Plotten der Lebensfähigkeit auf der y-Achse und CD45 auf der x-Achse. Verwenden Sie Polygon-Gate, um die Zellen mit einer geringen Lebensfähigkeit und einem hohen CD45-Signal zu umkreisen, und wählen Sie P2 aus, um die ausgewählten Zellen in einem neuen Fenster anzuzeigen. Im nächsten Fenster, Tor für CD45 positive Leukozyten, ohne T-Lymphozyten. Mit CD45 auf der x-Achse und CD3 auf der y-Achse, kreisen Sie die Population mit einem hohen CD45-Signal und niedrigem negativen CD3-Signal und wählen Sie P3. Schließlich Gate für CD19-positive Zellen, die die B-Lymphozyten identifizieren. Mit CD19 auf der y-Achse und CD3 auf der x-Achse, kreisen Sie die Population mit einem hohen CD19-Signal und einem niedrigen negativen CD3-Signal und wählen Sie P4.
Alle Sortierparameter sind nun festgelegt. Als Nächstes wählen Sie im Sortierlayoutfenster Ihre Zellpopulation von Interesse aus- P4, die die vierte Population, die abgesperrt wurde, und weist die Maschine an, nur B-Lymphozyten zu sortieren. Legen Sie Zielereignisse auf 10.000 Zellen fest und legen Sie die Genauigkeit auf Reinheit fest. Wir sortieren nur eine Bevölkerung. Bis zu vier verschiedene Populationen können jedoch gleichzeitig sortiert werden. Sobald Sie bereit sind, klicken Sie auf Sortieren und OK. Warten Sie dann auf die Zellensortierung.
Sobald die Zellsortierung abgeschlossen ist, führen Sie eine Reinheitskontrolle durch, indem Sie 10 Mikroliter der sortierten Zellen in ein neues FACS-Rohr mit 90 MikroliterHBSS 2% FCS pipetieren. Legen Sie die Röhre in das Zytometer, klicken Sie auf Last, und klicken Sie dann auf Datensatz, um die Phänotypen der Zellen zu analysieren, um zu überprüfen, ob die Gating-Strategie wie beabsichtigt funktioniert hat.
Nun werden wir die sortierten Zellen analysieren, um den Prozentsatz der B-Lymphozyten unter den Leukozyten zu bestimmen, die von der Mausmilz isoliert wurden. Um zu beginnen, doppelklicken Sie auf das FlowJo-Symbol und ziehen Sie die Dateien für jede Röhre in das gesamte Beispielfenster.
Klicken Sie auf Polygon, und erstellen Sie die Imvorherigen Abschnitt verwendeten Gating-Strategien neu. Als Nächstes klicken Sie auf Layout-Editor und ziehen Sie die B-Lymphozytenpopulationen von Interesse aus Tube sechs und die Reinheitskontrolle in den Layout-Editor-Tab. Punktdiagramme, die B-Lymphozyten darstellen, werden angezeigt. In diesem Beispiel stellt das Diagramm oben rechts die sortierten B-Lymphozyten aus der gesamten Milzzellsuspension dar, und das Diagramm unten rechts ist die Reinheitskontrolle. Zellen sollten nur in der Population erscheinen, die an der Reinheitskontrolle interessiert ist.
Um die Reinheit der B-Lymphozyten in den sortierten Zellen zu überprüfen, klicken Sie auf den Tabelleneditor. Ziehen Sie die B-Lymphozytenpopulation aus Tube sechs und Reinheitskontrolle in der Tabelle. Wählen Sie im Statistikmenü die Frequenz der CD45-positiven Zellen aus, um die Reinheit dieser Zellpopulation zu testen. Klicken Sie dann auf Tabelle erstellen. Parameterwerte werden in einer neuen Tabelle angezeigt. Überprüfen Sie im Reinheitskontrollfenster die Häufigkeit von B-Lymphozyten innerhalb der CD45-positiven Zellen, die höher als 98 % sein sollte.
Subscription Required. Please recommend JoVE to your librarian.
Results
In diesem Protokoll gereinigten wir Milz-B-Lymphozyten mit FACS-Technologie. Wir isolierten zunächst Leukozyten aus der Milz und färbten sie. Mit einer Kombination von B-Zelloberflächenmarkern haben wir eine Gating-Strategie zum Sortieren erstellt (Abbildung 2, oberes Panel). Am Ende des Experiments haben wir über einen "Reinheitstest" überprüft, ob Zellen im Sammelrohr B-Zellen waren. Wir behielten die gleiche Gating-Strategie und beobachteten, dass mehr als 98% der Zellen tatsächlich B-Zellen waren (Abbildung 2, untere Platte). Daher ist FACS ein effektives Protokoll, um Immunzellpopulationen mit einem hohen Reinheitsgrad zu isolieren. Gesammelte Zellen können dann für nachgelagerte Experimente wie Zellkultur, RT-qPCR und Zytotoxizitätstests verwendet werden.

Abbildung 2: Gating-Strategie und Testen der Reinheit nach der Sortierung. (A) Zellen wurden zuerst basierend auf ihrer Morphologie (links: FSC-A, SSC-A) abgegrenzt, dann nur noch lebendig (Mitte links: Lebensfähigkeit, CD45), CD45+ Zellen (CD45, CD3) wurden gegen CD19 und CD3 geplottet. Nur CD19+ Zellen wurden sortiert. (B) Reinheitstestergebnisse eines Zellanteils, der nach der Zellsortierung gewonnen wurde. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
Durchflusszytometrie ist eine Technik aus erster Hand, um Immunzellpopulationen mit einem hohen Reinheitsgrad zu charakterisieren und zu sortieren. Es ist ein Urwerkzeug im Forschungsbereich, da es die Anreicherung bestimmter Zellpopulationen und die Entschlüsselung der Immunantwort auf Krankheitserreger ermöglicht. Mit der Erhöhung der Anzahl der verfügbaren Fluorchrome und Zytometer wird die Anzahl der nachweisbaren Parameter stark erhöht. Infolgedessen hat die bioinformatische Analyse von FACS-Daten begonnen und neue Horizonte für die Zytometrie eröffnet (3). Die Durchflusszytometrie bietet weitere Anwendungen in der Hämatologie und Onkologie (4), wo sie für die Entwicklung von Diagnosetools verwendet wird.
Subscription Required. Please recommend JoVE to your librarian.
References
- Lanier, L. L. Just the FACS. The Journal of Immunology, 193 (5), 2043-2044 (2014).
- Walker, J. M. Epiblast Stem Cells IN Series Editor.
- Tung, J. W., Heydari, K., Tirouvanziam, R., Sahaf, B., Parks. D. R., Herzenberg, L. A., and Herzenberg. L. A. Modern Flow Cytometry: A Practical Approach. Clinics in Laboratory Medicine. 27 (3), 453-468 (2007).
- Walker, J. M. Tumor Angiogenesis Assays IN Series Editor.




