Overview
资料来源: 穆尼尔·西尔万1,2,3,佩尔切特·蒂鲍特1,2,3,苏菲·诺沃4,雷切尔·戈卢布1,2,3
1法国巴黎巴斯德研究所免疫学系淋巴病系
2 INSERM U1223, 巴黎, 法国
3巴黎迪德罗大学,索邦巴黎城,大提琴巴斯德,巴黎,法国
4流式细胞测定,细胞学和生物标志物 UtechS,转化科学中心,巴斯德研究所,法国巴黎
预防病原体取决于免疫系统的监测。该系统很复杂,包括许多细胞类型,每种类型都有特定的功能。这种复杂的组成能够对大量病原体和损伤进行免疫反应。适应性免疫允许对特定病原体作出特定反应。负责这种免疫的大多数细胞是淋巴细胞(B细胞和T细胞)。通常,B细胞对细胞外感染(如细菌感染)作出反应,T细胞对细胞内感染(如病毒感染)作出反应。淋巴细胞群中不同类型的细胞可以通过它们表达的细胞表面蛋白和/或分泌细胞因子的面板的组合来表示。
磁性分选允许使用磁性特性和一个或多个细胞表面蛋白的表达来丰富目标细胞群(1,2)。此技术包括三个步骤。首先,细胞用磁珠孵育,磁珠与一个或多个单克隆特异性抗体结合。表达与这些抗体结合的表面蛋白的细胞附着在磁珠上。然后,用磁铁捕获目标细胞群。最后,目标细胞从磁铁中洗脱。最后,获得两个分拣产品,一个包含未标记的细胞,第二个包含与磁珠结合的目标细胞。列可用于提高磁分拣效率。在列中,非磁性元素延长细胞穿过列的路径。因此,细胞流减慢,促进细胞捕获的磁铁。
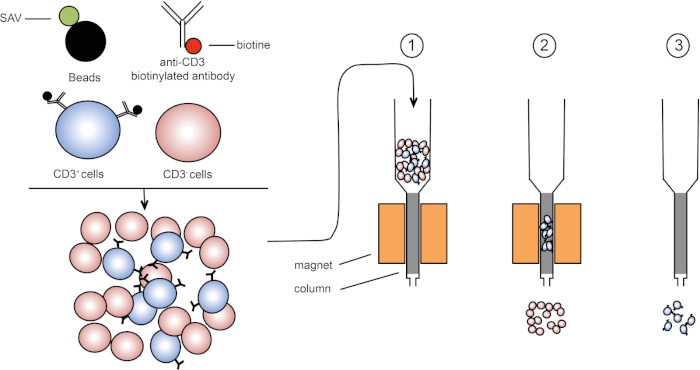
图1:磁分离的原理表示。双核白细胞被染色的抗CD3生物素化抗体。洗涤后,链球菌(SAV)耦合珠子在抗CD3抗体上专门固定生物链。(1) 单元格在列中传输。(2) 磁体不保留未标记的细胞,而CD3阳性细胞则保留在柱中。最后,将柱与磁体分离,(3)CD3阳性细胞在介质中洗脱。请点击此处查看此图的较大版本。
有两种类型的磁性分拣 (3)。在正排序中,感兴趣的细胞被磁珠捕获。在负排序中,通过捕获携带相应抗体的磁珠来去除不需要的细胞。这种MACS技术允许目标细胞的良好富集,并将器官中回收的细胞的百分比从1-20%提高到60-98%。分拣后,有必要用不同的方法(例如流式细胞测定)验证细胞纯度和分拣。MACS 技术是丰富目标人群的理想,用于其他实验,如细胞培养或细胞周期分析。
在本实验练习中,我们演示如何分离胸腺白细胞,然后使用磁细胞分选技术从混合物中丰富胸腺CD3阳性细胞。
Procedure
1. 准备
- 开始之前,戴上实验室手套和适当的防护服。
- 清洗所有解剖工具,首先用洗涤剂,然后用70%乙醇,然后用干净的纸巾擦干。
- 准备 200 mL 的汉克平衡盐溶液 (HBSS), 含有 2% 的胎儿小牛血清 (FCS)。
2. 解剖
- 将安乐死小鼠固定在解剖板上。
- 使用剪刀和钳子进行纵向腹腔切除术进入胸腔。
- 取出心脏,进入位于心脏上方的胸腺。然后,识别胸腺,由两个白色叶组成,位于心脏上方的胸腔。
- 使用钳子小心地分离胸腺,并将其放在培养皿与 5 mL 的 HBSS 2% FCS。
3. 免疫细胞分离
- 将胸腺放在40μm细胞滤网上,放在同一个培养皿上。用柱塞粉碎胸腺,使其在同一菜中分离。
- 分离胸腺和液体转移到15 mL离心管中。
- 用 5 mL 的 HBSS 2% FCS 清洗培养皿,并将洗涤介质也转移到同一离心管中。
- 在 20°C 下将管在 370 x g下离心 7 分钟,并丢弃上清液,避免颗粒。
- 将颗粒重新悬浮在2 mL的醋酸钾中,以赖解红细胞。等待 2 分钟,然后用 HBSS 2% FCS 将音量补至 14 mL。
- 在 20°C 下,在 370 x g下再次将管离心 7 分钟。丢弃上清液,将颗粒重新悬浮在 5 mL 的 HBSS 2% FCS 中。
- 使用锥蓝色染色测定估计细胞浓度,并使用适当的HBSS 2%FCS调整最终细胞浓度至107细胞/mL。
4. 免疫细胞的磁性标记
- 取两个 FACS 管。将一个管标为"非富集T细胞",另一管"富集T细胞",使用磁性标记分离。
- 将细胞溶液分配到两个FACS管中。
- 在 370 x g下将"富集 T 细胞"管在 20°C 下离心 3 分钟,并丢弃上清液,避免颗粒。
- 在250 μL的抗CD3生物异位抗体混合物中重新悬浮颗粒(表1,混合1)。
| 混合 | 标记试剂 | 稀释 |
| 1 | 抗CD3生物仿当抗体 | 1/400 (在哈佛商学院 2% FCS) |
| 2 | 链球菌结合珠 | 1/5 (在哈佛商学院 2% FCS) |
| 3 | 防 CD3 BV421 | 1/200 (在哈佛商学院 2% FCS) |
表1:抗体混合组合。混合1和2用于磁分离。混合3用于评估磁分离后的细胞富集。
- 在黑暗中4°C下孵育细胞悬浮抗体混合物15分钟。
- 在20°C下,在370 x g下再次向管中加入3 mL的HBSS 2%FCS,然后再次离心。
- 丢弃上清液,在 250 μL 链球蛋白耦合珠中重新悬浮颗粒(表 1,混合 2)。
- 在冰上孵育细胞混合物和珠子20分钟。
- 接下来,加入 3 mL 的 HBSS 2% FCS,在 370 x g 下再次混合,在 20°C 下再离心 3 分钟。
- 在 2 mL 的 HBSS 2% FCS 中重新悬浮颗粒。
5. CD3-正细胞的磁性分离
- 将柱放在磁铁上,加入 3 mL 的 HBSS 2% FCS,使系统加湿。等待 5 分钟。
- 接下来,将标记的单元格移入列中。
- 细胞悬浮液通过柱后,用3 mL的HBSS 2%FCS清洗柱X3。
- 然后,从磁铁上取下柱子,并将其放入 15 mL 收集管中。
- 要洗至目标细胞,将 5 mL 的 HBSS 2% FCS 添加到柱中,然后用柱塞冲洗柱塞。
- 重复洗脱步骤与另外 5 mL 的 HBSS 2% FCS。
6. 流量细胞测定对靶细胞富集的评价
- 将500μL的洗脱细胞悬浮液转移到标有"富集T细胞"的FACS管中。将200μL的"非富集T细胞"悬浮液转移到第二个FACS。
- 然后,在20°C下以370 x g将两个管离心7分钟。
- 丢弃上清液,然后向两管中加入100 μL荧光抗体混合3(见表1)。
- 在黑暗中4°C下孵育两个管子20分钟。
- 接下来,在管中加入 3 mL 的 HBSS 2% FCS,并在 370 x g下在 20°C 下将其离心 3 分钟。
- 丢弃上清液,然后将每根管重新悬浮在 250 μL 的 HBSS 2% FCS 中。
- 现在,通过流动细胞测定法评估CD3阳性细胞富集率。
7. 数据分析
- 打开"FlowJo"图标,在"所有样本"窗口中拖动每个管的文件。
- 双击"富集 T 单元格"文件,显示 Y 轴上向前散点 (FSC-A) 和 Y 轴上的侧散射 (SSC-A) 显示的点图。
- 点击"多边形"圈出淋巴细胞群。
- 接下来,双击圆圈填充以创建新窗口。
- 在 Y 轴上选择"FSC-W",在 X 轴上选择"FSC-A",然后圈出 FSA-W 负数。在"子人口标识"窗口中,将单元格群命名为"单个单元格"。
- 双击圆圈填充以创建新窗口。在 Y 轴上选择"CD3",然后圈出 CD3 阳性细胞。在"亚人口标识"窗口中命名您的单元格群"T 单元格"。
- 重复"非富集T细胞"。
- 要可视化单元格群,请单击"布局编辑器",并将"T单元格"填充从"富集 T 单元格"和"非富集 T 单元格"文件拖到选项卡中。
- 将显示表示 CD3+ 淋巴细胞的点图。CD3+ 细胞应只出现在 CD3+ 浓缩管的感兴趣人群中。
- 要评估已排序单元格中 CD3+ 淋巴细胞的富集性,请单击"表编辑器",然后将"富集 T 细胞"和"非富集 T 细胞"文件的"T 细胞"总体拖到表中。
- 在"统计"菜单上,选择"淋巴细胞的频率"细胞以检查所有淋巴细胞中CD3+细胞的百分比,然后单击"创建表"。
- 参数值将显示在新表中。对于"富集T细胞",CD3+细胞的频率应在80%左右。
磁活细胞分类(MACS)是一种技术,允许研究人员根据表面表达的特定表位分离细胞。
这个过程通常从提取器官或组织开始,如胸腺。然后,细胞被机械地分离,通常是通过粉碎,直到组织分离成单个细胞。在这个阶段,可以通过添加化学物质来去除不需要的细胞。例如,氯化铵-钾,或ACK缓冲液,可用于解说不需要的红细胞。
接下来,与一种称为生物锡的分子结合的抗体被添加到悬浮液中,这些复合物与目标细胞表面的表皮结合。生物锡对另一种叫做链球菌的分子具有很高的亲和力。在下一步中,与磁珠融合的链球菌分子被添加到抗体标记细胞中。当生物锡和链球菌接触时,它们紧密结合。结果是感兴趣的细胞被涂上磁珠。这个复合物有时被称为三明治。在这种情况下,CD3在细胞膜的底部,然后抗CD3结合生物素,最后,链球菌素结合磁珠。
这些标记的细胞现在可以放入一个包含矩阵的列中,在重力的辅助下,允许细胞通过磁铁缓慢地通过。当它们这样做时,磁珠标记的细胞将粘在离磁铁最近的管的边缘,而未标记的细胞将继续进入下面的收集管中。接下来,只需去除磁铁、添加润液和用柱塞施加温和压力,将标记的细胞从柱状物中排出并放入新的收集管,即可从柱状体中取出标记的细胞。最终,这个过程允许60-98%的感兴趣的细胞检索。
在此过程中,我们将从小鼠中分离胸腺白细胞,并使用 MACS 对 CD3 阳性 T 细胞进行排序,然后再确认使用 FACS 进行分拣的效率。
首先,穿上任何适当的防护设备,包括实验室外套和手套。接下来,用70%乙醇洗一把解剖剪刀和钳子,用干净的纸巾擦干。然后,通过将 4 毫升 FCS 与 196 毫升 HBSS 混合,制备 200 毫升 HBSS 2% 胎儿小牛血清(FCS)。
将安乐死小鼠固定在解剖板上的苏平位置。使用剪刀和钳子,进行纵向腹腔切除术进入胸腔。首先,取出心脏,以进入位于心脏上方的胸腺。然后识别胸腺,由两个白色叶组成。使用钳子,小心地分离胸腺,并将其放在五毫升的HBSS 2%FCS的培养皿上。
要分离免疫细胞,首先将胸腺放在培养皿中的40微米细胞过滤器上。用柱塞粉碎组织,将其分离到盘子里。在此之后,用 HBSS 2% FCS 冲洗柱塞和滤网,以恢复任何粘附细胞。然后,将分离的胸腺细胞和液体从培养皿移入15毫升的离心管中。用5毫升的HBSS 2%FCS清洗培养皿,并将这种洗涤溶液转移到15毫升的离心管中。
接下来,在20摄氏度的温度下,以370次g将管离心7分钟。丢弃上清液,将颗粒重新悬浮在两毫升ACK解毒缓冲液中,以赖解红细胞。在室温下在台面孵育两分钟。然后,使用 HBSS 2% FCS 将音量调至 14 毫升。在20摄氏度下,以370次g将管离心7分钟。然后,丢弃上清液,将细胞重新悬浮在5毫升的HBSS 2%FCS中。
使用 Malasez 幻灯片估计细胞浓度,如 B 淋巴细胞 FACS 分离协议所示,并使用 HBSS 2% FCS 将细胞浓度调整到每毫升 10 至第 7 个细胞。
将500微升的细胞溶液转移到两个FACS管中。将一管非富集T细胞和另一管富集T细胞贴上标签,使用磁性标记分离。
在20摄氏度下,以370次g将浓缩T细胞管离心3分钟。在 HBSS 2% FCS 中,丢弃上清液并重新悬浮在 250 微升生物蛋白结合抗 CD3 抗体中稀释的 400 分之一的颗粒。在冰上和黑暗中孵育细胞20分钟。在管中加入三毫升HBSS 2%FCS,并在20摄氏度下以370次g再次离心3分钟。丢弃上清液,在 250 微升链球蛋白耦合珠中重新悬浮在 HBSS 2% FCS 中五分之一稀释的颗粒中。在冰上孵育细胞和珠子的混合物20分钟。接下来,在管中加入三毫升的HBSS 2%FCS,上下移液混合,并在20摄氏度的温度下以370次g再次离心3分钟。将颗粒重新悬浮在两毫升的 HBSS 2% FCS 中。
将柱放在磁铁上,加入三毫升的 HBSS 2% FCS 来加湿系统。然后,将染色的细胞移入柱中。细胞悬浮液通过柱后,用三毫升的HBSS 2%FCS清洗柱三次。接下来,从磁铁上取下柱子,并将其放入 15 毫升的管子中。要洗去目标细胞,在柱中加入五毫升的HBSS 2%FCS,用柱塞冲洗柱塞。再用五毫升的哈佛商学院 2% FCS 重复此步骤。
为了评估靶细胞分离的有效性,首先将500微升的洗脱细胞悬浮液转移到FACS管中,并将其标记为富集T细胞。然后,在20摄氏度的温度下,以370倍g将浓缩管和非富集管离心7分钟。丢弃上清液,然后将100微升荧光抗体稀释在HBSS 2%FCS中的200分之一添加到两个管中。在冰上和黑暗中孵育细胞20分钟。接下来,在管中加入三毫升HBSS 2%FCS,在20摄氏度的温度下以370次g将其离心3分钟。丢弃上清液,然后重新悬浮在 250 微升的 HBSS 2% FCS 中的颗粒。现在,使用流式细胞测定法评估CD3阳性细胞富集率,如FACS协议所示。
现在,我们将确定从小鼠胸腺分离的所有胸腺细胞中CD3阳性淋巴细胞的频率。要开始,双击 FlowJo 图标,并拖动所有示例窗口中每个管的文件。然后,双击富集的 T 细胞文件,在显示 x 轴上的正向散点、FSCA 和 y 轴上的侧散射 SSCA 的点图上显示从该样本记录的单元格。
单击多边形以圈出淋巴细胞群。接下来,双击圆圈填充以创建新窗口。在 y 轴上选择 FSC-W,在 x 轴上选择 FSC-A,然后圈出 FSA-W 负数。在子人口标识窗口中,命名单元格填充单个单元格。接下来,单击子填充标识窗口上的"确定",然后双击圈填充以创建新窗口。在 y 轴上选择 CD3,然后圈出 CD3 阳性细胞。在子总体标识窗口中,命名单元格群 T 细胞。对未富集的 T 细胞文件重复上述操作。要可视化单元格群,请单击"布局编辑器",并将丰富的 T 细胞和未富集的 T 细胞文件中的 T 细胞填充拖动到选项卡中。
将显示表示 CD3 阳性淋巴细胞的点图。CD3阳性细胞应只出现在CD3阳性浓缩管的感兴趣人群中。要评估已排序细胞中 CD3 阳性淋巴细胞的富集性,请单击表编辑器,然后将富集的 T 细胞和非富集 T 细胞文件中的 T 细胞群拖到表中。在统计菜单上,选择淋巴细胞的频率以检查所有淋巴细胞中CD3阳性细胞的百分比。然后,单击"创建表"。参数值将显示在新表中。对于富集的T细胞,CD3阳性细胞的频率应在80%或以上。
Subscription Required. Please recommend JoVE to your librarian.
Results
在此协议中,CD3阳性细胞通过磁细胞分拣从胸腺白细胞中富集(图1)。在磁细胞富集CD3阳性细胞之前,CD3阳性细胞占胸腺细胞总数的53.6%(图2,顶部面板)。磁细胞富集后,CD3阳性细胞的百分比增加到95%(图2,底部面板)。因此,MACS是一种简单、快速、高效的细胞浓缩技术,用于从细胞悬浮混合物中丰富所需的细胞群。

图2:浇注策略和纯度测试排序。首先根据细胞的形态(左:FSC-A、SSC-A)对细胞进行封闭,然后根据CD3(右图:CD3,SSC-A)绘制细胞。顶部面板表示细胞富集前的胸腺细胞悬浮液。底部面板表示磁细胞分类后的胸腺细胞悬浮液。请点击此处查看此图的较大版本。
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
磁分离技术是方便快速地对目标细胞群进行分类的常用方法。使用T细胞特异性抗体和磁珠,我们丰富了样品中的T细胞频率。实验结束时的纯度取决于初始细胞悬浮液中目标细胞的百分比。磁细胞分类后获得的细胞可用于各种用途,如细胞转移或细胞周期分析。另一种排序方法,使用流细胞测定法,可用于丰富细胞。这种技术在细胞分类后具有非常高的纯度,但它需要更多的步骤,需要更多的时间。
Subscription Required. Please recommend JoVE to your librarian.
References
- Owen, C. S. and Sykes, N. L. Magnetic labeling and cell sorting. Journal of Immunological Methods. 73 (1), 41-48 (1984).
- Miltenyi, S., Müller, W., Weichel, W. and Radbruch, A. High gradient magnetic cell separation with MACS. Cytometry. 11 (2), 231-238 (1990).
- Plouffe, B. D., Murthy, S. K. and Lewis, L. H. Fundamentals and application of magnetic particles in cell isolation and enrichment: a review. Reports on Progress in Physics. 78 (1), (2014).




