Overview
Fuente: Meunier Sylvain1,2,3, Perchet Thibaut1,2,3, Sophie Novault4, Rachel Golub1,2,3
1 Unidad de Linfopoyesis, Departamento de Inmunología, Instituto Pasteur, París, Francia
2 INSERM U1223, París, Francia
3 Université Paris Diderot, Sorbonne Paris Cité, Cellule Pasteur, París, Francia
4 Flow Cytometry Platfrom, Citometría y Biomarcadores UtechS, Centro de Ciencias Traslacionales, Instituto Pasteur, París, Francia
La transferencia de células adoptivas es un método para introducir células en un paciente u organismo de estudio con el fin de tratar una enfermedad o estudiar un proceso biológico, como la hematopoyesis. Los objetivos de la transferencia adoptiva son varios; se puede utilizar en biología fundamental, así como en ciencias médicas (1, 2). En los modelos de ratón, la migración y distribución de las celdas transferidas se puede estudiar y seguir un sistema de seguimiento (marcador de superficie celular, tinción por CFSE, etc.). En estudios de cáncer en modelos de ratón, la transferencia de poblaciones celulares específicas se puede utilizar como tratamiento experimental contra tumores. Otro ejemplo de esta técnica es la creación de ratones quiméricos mediante la transferencia de células de médula ósea a ratones irradiados o ratones con un fenotipo de inmunodeficiencia grave. Este modelo de ratón se puede utilizar para evaluar el impacto de la eliminación de genes en una población celular específica, por ejemplo. La transferencia de células de préstamo óseo también se utiliza en el tratamiento médico humano. Cuando los pacientes son irradiados en caso de terapia oncológica, la transferencia adoptiva de médula ósea permite la reconstitución del sistema inmunitario.
El primer paso en esta técnica es obtener la población celular de interés. La técnica elegida para aislar esta población depende del nivel de especificidad de la población objetivo. El mayor nivel de selección es todo el órgano, en el que se toman todas las poblaciones celulares presentes en el órgano. Un método más preciso es la selección de una población de celdas de destino, a menudo seleccionada por un marcador de superficie de celda. El método ideal para ordenar las células en este caso es por clasificación magnética. Finalmente, el nivel más estricto es la selección de celdas por varios marcadores de superficie celular para ordenar poblaciones celulares muy específicas. La clasificación de citometría de flujo es el método más popular para este nivel de selección. Una vez obtenida la población de interés, se puede transferir al anfitrión. Antes de la transferencia adoptiva es esencial garantizar la compatibilidad entre el host y el donante. De hecho, independientemente del objetivo de transferencia, la compatibilidad es crucial para asegurar la adopción de las células por el host sin rechazo de celdas.
En este ejercicio de laboratorio, demostramos la técnica de transferencia celular adoptiva mediante la transferencia de esplenocitos de un ratón CD45.2 a un ratón CD45.1 Rag-c (falta de linfocitos) y cuatro días más tarde confirmamos la transferencia de los esplenocitos utilizando citometría de flujo (ver Figura 1 ).
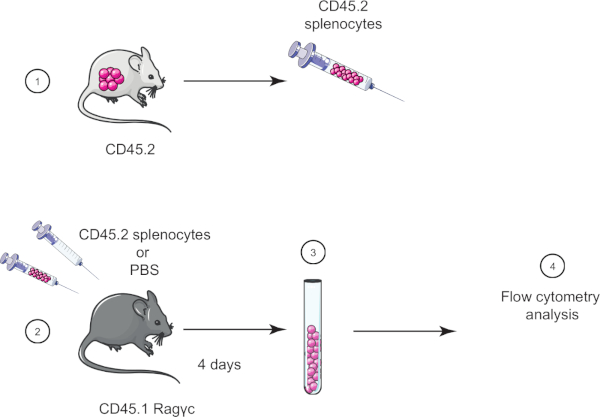
Figura 1: Representación esquemática de la transferencia adoptiva. (1) Los esplenocitos se aíslan de los ratones CD45.2 y (2) se transfieren en el ratón CD45.1 Rag-c, el ratón de control se inyecta con PBS solamente. (3) 4 días después de la transferencia adoptiva, los esplenocitos se recuperan de ratones y (4) se analizan mediante citometría de flujo. Haga clic aquí para ver una versión más grande de esta figura.
Procedure
1. Preparación
- Antes de comenzar, ponte guantes de laboratorio y la ropa protectora adecuada.
- Esterilice todas las herramientas de disección, primero con un detergente y luego con 70% de etanol y luego seque bien.
- Preparar 50 ml de la solución salina equilibrada de Hank (HBSS) que contiene un 2% de suero de becerro fetal (FCS).
2. Disección
- Usando un sistema de administración de dióxido de carbono, eutanasia el ratón por hipoxia. Asegure el ratón eutanasiado en una placa de disección en posición supina y realice una laparotomía longitudinal utilizando tijeras y fórceps.
- El uso de fórceps mueve los intestinos y el estómago en el lado derecho del abdomen para exponer el estómago y el bazo. El bazo está unido al estómago.
- Usando fórceps separa cuidadosamente el bazo del estómago y colócalo en la placa Petri que contiene 5 ml de HBSS 2% FCS.
3. Aislamiento celular inmune
- Coloque el bazo sobre un colador de células de 40 m sobre la placa Petri. Aplastar el bazo con un émbolo para disociarlo.
- Recupere las células adheridas encerrando el émbolo y el colador con 1 ml de HBSS 2% FCS.
- Transfiera el bazo disociado y el líquido a un tubo centrífugo de 15 ml.
- Lavar la placa Petri con 5 mililitros de HBSS 2% FCS y transferir el fluido al tubo de 15 ml.
- Centrifugar el tubo a 370 x g durante 7 min a 10oC y desechar el sobrenadante evitando el pellet.
- Resuspenda el pellet en 2 ml de pipeta de cloruro de amonio de potasio hacia arriba y hacia abajo para resuspender el pellet y lejar los eritrocitos.
- Espere 2 min y agregue HBSS 2% FCS al pellet resuspendido para obtener el volumen de hasta 14 ml.
- Centrifugar el tubo de nuevo a 370 x g durante 7 min a 10oC. Deseche el sobrenadante y resuspenda el pellet en 5 ml de HBSS 2% FCS pipeteando hacia arriba y hacia abajo.
- Cuente las células usando el ensayo de tinción azul trypan y ajuste la concentración celular final a 107 celdas/ml usando el volumen apropiado de HBSS 2% FCS.
4. Transferencia adoptiva
- Transferencia de 2 ml de suspensión celular obtenida en un tubo de recogida de 5 ml.
- Centrifugar el tubo a 370 x g durante 7 min a 10oC y luego desechar el sobrenadante.
- Resuspenda el pellet en 2 ml de PBS y centrifugar el tubo a 370 x g durante 7 min a 10oC.
- Deseche el sobrenadante y resuspenda el pellet en 200 ml de PBS.
- El uso de una jeringa de 0,5 ml con una aguja de 29 G inyectar 200 l de suspensión celular en el ratón experimental por vía intravenosa en el seno de la sangre retroorbital.
- Como control, inyectar un segundo ratón en el mismo seno de la sangre con 200 ml de solución salina tamponada de fosfato.
5. Cosecha y tinción de células
- Cuatro días después de la transferencia adoptiva, eutanasia a los ratones y extirpa el bazo.
- Cosecha los esplenocitos como se describe en la sección 3.
- Transfiera 100 l de suspensiones celulares de cada ratón a dos tubos FACS, etiquetados como "control" y "transferidos".
- Centrifugar el tubo a 370 x g durante 7 min a 10oC y luego desechar los sobrenadores.
- Preparar una mezcla que contenga los cuatro anticuerpos en las diluciones enumeradas en la Tabla 1.
| Anticuerpos | Fluorocromo | Dilución |
| CD45.1 | BV711 | 1/200 |
| CD45.2 | APCCy7 | 1/400 |
| CD4 | BV786 | 1/1600 |
| CD3 | BV421 | 1/200 |
Tabla 1: Los anticuerpos mezclan composición. Preparación de cuatro cocteles de anticuerpos utilizando conjugados concentrados de anticuerpos fluorescentes y HBSS.
- Añadir 100 l de la mezcla a cada tubo, y luego incubar durante 20 minutos en hielo en la oscuridad.
- Añadir 1 ml de HBSS 2%FCS y luego centrifugar los tubos a 370 x g durante 3 min a 10oC.
- Deseche los sobrenadores y resuspenda los pellets en 200 l de HBSS 2% FCS.
- Transfiera las celdas resuspendidas a nuevos tubos FACS etiquetados.
- Utilizando citometría de flujo, como se muestra en el protocolo FACS, evalúe la presencia de linfocitos positivos CD45.2.
6. Análisis de datos
- Abra el software "FlowJo" y arrastre los archivos para cada tubo en la ventana"Todos los muestras".
- Haga doble clic en el archivo "transferido"para mostrar las celdas registradas a partir de esa muestra en una gráfica de puntos que muestra la dispersión hacia adelante "SSC-A" en el eje Y y la dispersión lateral "FSC-A" en el eje X.
- Haga clic en "polígono" y cree una estrategia de gating para seleccionar linfocitos, luego distinga las células de donante y host usando marcadores de superficie celular (CD45.1, CD45.2), y luego caracterice CD45.2+ población celular (CD3, CD4).
- Repita los pasos del análisis con el archivo "control mouse".
- Para visualizar la población de celdas, haga clic en"Editor de diseño".
- Arrastre los archivos "celdas transferidas"y "celdas CD4 transferidas" de "transferidos" y "control" en la pestaña " Editor dediseño".
- Aparecerá una gráfica de puntos que representa CD45.2+ células y linfocitos CD4.
- Las celdas transferidas CD45.2 solo deben aparecer en la gráfica de puntos "ratón transferido".
La transferencia celular adoptiva es un método para introducir células de interés en un organismo. Es una técnica poderosa para estudiar varios mecanismos biológicos, incluyendo la acción de clases específicas de células inmunitarias. Además, la transferencia adoptiva es un tratamiento novedoso prometedor para numerosas afecciones, como las que requieren trasplantes de médula ósea o tratamientos oncológicos en los que las células T de un paciente pueden extraerse, modificarse para reconocer y destruir las células cancerosas, y luego regresó al cuerpo para combatir tumores.
En el laboratorio, los modelos animales se utilizan a menudo para estudiar la transferencia adoptiva. Por ejemplo, los ratones eliminatorios CD45.1 gamma-c rag carecen de receptores fundamentales para muchas citoquinas, que son esenciales para la diferenciación normal de las células madre hematopoyéticas en linfocitos. Como resultado, los ratones noqueadores tienen un desarrollo de linfocitos comprometido y no tienen muerte natural, o NK, células, células T o células B.
La transferencia adoptiva se puede utilizar para introducir las células inmunitarias que faltan en estos ratones comprometidos, mediante la primera cosecha de tejido de ratón donante que contiene altas concentraciones de células inmunitarias, como el bazo. Luego, el tejido se disocia y se aíslan una variedad de células del bazo, incluidas las células inmunitarias. A continuación, los eritrocitos no deseados, o glóbulos rojos, se pueden liscar mediante la adición de tampón de lisión de potasio de cloruro de amonio y los glóbulos blancos restantes, o esplenocitos, se separan de los desechos celulares mediante centrifugación.
Finalmente, los esplenocitos purificados se inyectan en los ratones inmunocomprometidos, facilitando estudios detallados de las funciones de estas células. Varios días más tarde, el éxito de la transferencia adoptiva de células inmunitarias se puede confirmar primero aislando y preparando los esplenoncitas del huésped de la misma manera que el tejido del donante. Luego, estas células se tiñen usando anticuerpos etiquetados contra los marcadores de células inmunitarias del donante para que puedan ser verificadas y ordenadas usando FACS.
Para empezar, ponte guantes de laboratorio y el equipo de protección adecuado. A continuación, lave un par de fórceps y diseccione las tijeras primero con un detergente y luego con 70% de etanol y luego séquelos con una toalla de papel limpia. Prepare 50 mililitros de solución de sal equilibrada de Hank, o HBSS, con 2% de suero de pantorrilla fetal, o FCS, combinando un mililitro de FCS con 49 mililitros de HBSS en un tubo de 50 mililitros. Mezcle pipeteando suavemente la solución hacia arriba y hacia abajo aproximadamente 10 veces.
Diseccionar el ratón eutanasiado y quitar su bazo como se demuestra en la tecnología FACS del protocolo de vídeo JoVE para la separación de linfocitos B esplénicos. Para aislar las células inmunitarias, coloque primero el bazo en un colador de células de 40 micrómetros en un plato de petri. Aplastar el bazo con un émbolo para disociarlo en el plato. Recupere las células adheridas encerrando el émbolo y el colador con 1 mililitro de HBSS 2% FCS. Luego, pipetee el bazo disociado y el líquido de la placa petri en un tubo centrífugo de 50 mililitros. Lavar la placa de petri con 5 mililitros de HBSS 2% FCS y transferir el fluido al tubo de 15 mililitros.
Centrifugar el tubo a 370 veces g durante siete minutos a 10 grados Centígrados y luego recuperar el tubo con cuidado para no molestar el pellet. Ahora, retire el sobrenadante sin molestar el pellet y deseche el líquido en un contenedor de residuos apropiado. A continuación, agregue dos mililitros de tampón de lising de potasio de cloruro de amonio al tubo de centrífuga y pipeta hacia arriba y hacia abajo para resuspender el pellet y lijar los eritrocitos. Espere dos minutos y luego agregue HBSS 2% FCS al pellet resuspendido para obtener un valor total de 14 mililitros. Repite la centrifugación. Recupere el tubo con cuidado y deseche el sobrenadante. A continuación, resuspender el pellet en 5 mililitros HBSS 2% FCS por pipeteo hacia arriba y hacia abajo. A continuación, cuente las celdas en suspensión. Agregue cinco microlitros de trippan azul a cinco microlitros de suspensión celular y mezcle bien pipeteando. A continuación, deposite suavemente una gota de cinco microlitros de suspensión de celda diluida entre el vidrio de la cubierta y el portaobjetos Malassez. Con el microscopio ajustado a aumento de 40X, cuente el número de células. Ajuste la concentración celular a 10 a las siete células por mililitro agregando el volumen apropiado de HBSS 2% FCS.
Para comenzar la transferencia adoptiva, transfiera dos mililitros de la suspensión celular a un tubo de recolección de cinco mililitros. Centrifugar el tubo a 370 veces g durante siete minutos a 10 grados Centígrados y luego desechar el sobrenadante. A continuación, resuspende el pellet en dos mililitros de solución salina tamponada de fosfato y centrifuga el tubo a 370 veces g durante siete minutos a 10 grados centígrados. Descarta el sobrenadante. A continuación, resuspenda el pellet en 200 microlitros de solución salina tamponada de fosfato. Usando una jeringa de 0,5 mililitros con una aguja de calibre 29, inyecte 200 microlitros de suspensión celular en el ratón experimental por vía intravenosa en el seno de la sangre retroorbital.
Cuatro días después de la transferencia adoptiva, eutanasia a los ratones y retire el bazo. Luego, cosecha las células inmunitarias como se describe en la sección tres. A continuación, transfiera 100 microlitros de suspensión celular de cada ratón a dos tubos FACS etiquetados como control y transferidos. Centrifugar los tubos a 370 veces g durante siete minutos a 10 grados centígrados y luego desechar los sobrenatonos. Ahora, prepare una mezcla que contenga los cuatro anticuerpos en la dilución enumerada en la tabla uno. Añadir 100 microlitros de la mezcla a cada tubo y luego incubar durante 20 minutos sobre hielo en la oscuridad. A continuación, agregue un mililitro de HBSS 2% FCS a cada tubo y luego centrifugar los tubos a 370 veces g durante tres minutos a 10 grados centígrados. Deseche los sobrenadores y luego resuspenda los pellets en 200 microlitros de HBSS 2% FCS. Transfiera las celdas resuspendidas a los nuevos tubos FACS etiquetados. Ahora, utilice la citometría de flujo como se muestra en el protocolo FACS para evaluar la presencia de CD45. 2 linfocitos positivos.
Ahora, determinaremos la presencia de linfocitos CD45.2 que fueron aislados del CD45. 1 bazo de host. Para empezar, haga doble clic en el icono FlowJo y arrastre los archivos para cada tubo en la ventana de muestra. A continuación, haga doble clic en el archivo transferido para mostrar las celdas registradas a partir de esa muestra en una gráfica de puntos que muestra la dispersión hacia delante FSCA en el eje X y la dispersión lateral SSCA en el eje Y. Haga clic en polígono para rodear las poblaciones de linfocitos. Aparece una nueva ventana de identificación de subpoblación. Haga clic en Aceptar. Ahora, establezca el eje Y en FSC-W y el eje X en FSC-A. Seleccione la población de celda única con la herramienta poligonal como se ha demostrado anteriormente.
A continuación, haga doble clic en la población en círculos para crear una nueva ventana para las celdas seleccionadas. En la nueva ventana, seleccione CD45.2 en Y y CD45.1 en la X. Haga clic en el icono T y personalice el eje para ampliar el trazado. A continuación, haga clic en polígono para rodear las celdas positivas CD45.2. En la ventana de identificación de subpoblación, asigne un nombre a las celdas transferidas de la población de celdas y haga clic en Aceptar. En la misma ventana, haga clic en rectángulo para seleccionar las celdas negativas CD45.2. En la ventana de identificación de subpoblación, asigne un nombre a las celdas de host de población de celdas y haga clic en Aceptar. A continuación, haga doble clic en la población en círculos CD45.2, población transferida, para crear una nueva ventana para las celdas seleccionadas. En la nueva ventana, seleccione CD3 en La Y y CD4 en la X.
A continuación, haga clic en polígono para rodear las celdas positivas CD4 CD3. En esta ventana de identificación de subpoblación, asigne un nombre a la población de celdas que transfiera las celdas CD4. A continuación, repita los pasos de análisis anteriores con el archivo de mouse de control. Por último, para visualizar las poblaciones de celdas, haga clic en Editor de diseño. Arrastre las celdas transferidas y la población de celdas CD4 transferidas desde archivos transferidos y de control a la pestaña Editor de diseño. Aparecerá una gráfica de puntos que representa células positivas CD45.2 y linfocitos CD4. CD45. 2 celdas transferidas solo deben aparecer en la gráfica de puntos del ratón transferida.
Subscription Required. Please recommend JoVE to your librarian.
Results
Los ratones de Ragác tienen una composición alterada del sistema inmunitario, principalmente carentes de linfocitos. La transferencia adoptiva de esplenocitos permite la introducción de la falta de población, como las células T y B. Nuestra tinción incluyó marcadores de superficie celular CD45.1 y CD45.2 para distinguir las células de host y donante respectivamente(Figura 2A). También incluyó otro marcador de superficie celular para resaltar las poblaciones celulares ausentes en ratones de Rag-c, como las células T CD4(Figura 2B). Como era de esperar, el ratón de control no tenía celdas CD45.2 positivas(Figura 2B, paneles superiores) y el ratón transferido lo hizo(Figura 2B,paneles inferiores, 71,2% del total de celdas). También podríamos detectar específicamente las células T CD4 dentro de las células transferidas (22.1% de las células CD45.2).

Figura 2: Resultados representativos de la transferencia adoptiva. (A) Histogramas de células CD45.2 de ratones inyectados con PBS (grupo de control) (dashed) y ratones inyectados con esplenocitos CD45.2 (grupo de prueba) (línea sólida). (B) Estrategia de ampliación de células CD45.2 positivas en ratones de control inyectados con PBS (paneles superiores) y ratones inyectados con esplenocitos CD45.2 (paneles inferiores). Las células donantes y anfitrionas se distinguen utilizando marcadores de superficie celular (CD45.1, CD45.2), luego se caracteriza la población celular cd45.2 positiva (CD3, CD4). Haga clic aquí para ver una versión más grande de esta figura.
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
La transferencia adoptiva es una técnica traslacional en diferentes campos de la ciencia, con aplicaciones en la medicina. Esta técnica se puede utilizar para estudiar la migración celular y el tropismo o la incidencia de deficiencia de proteínas en poblaciones celulares específicas. En el último caso, se pueden utilizar diferentes tecnologías, especialmente ratones OMG donde poblaciones celulares específicas son intrínsecamente deficientes. Sin embargo, la construcción genética para obtener ratones OMG puede ser un proceso muy complejo y largo. En este caso, la transferencia adoptiva de la población celular deficiente es más fácil y rápida.
Las transferencias adoptivas tienen aplicaciones directas en medicina. Por ejemplo, los injertos de médula ósea en pacientes irradiados durante la terapia oncológica se utilizan para reconstituir el sistema inmunitario. Recientemente, se han utilizado otras aplicaciones de transferencia adoptiva en el campo médico. Las células T artificiales (llamadas células T CAR) están diseñadas para reconocer y eliminar algunos tipos de cáncer. Además, estas células diseñadas se construyen para amortiguar el riesgo de rechazo por parte del host. La transferencia de células T CAR se prueba actualmente en ensayos clínicos.
Subscription Required. Please recommend JoVE to your librarian.
References
- Restifo, N. P., Dudley, M. E. and Rosenberg., S. A. Adoptive immunotherapy for cancer: harnessing the T cell response. Nature reviews. Immunology, 12 (4): 269-281, (2012).
- Bonini, C., and Mondino, A. Adoptive T-cell therapy for cancer: The era of engineered T cells. European journal of immunology, 45 (9): 2457-69, (2015).




