Overview
Fuente: Tilde Andersson1, Rolf Lood1
1 Departamento de Ciencias Clínicas Lund, División de Medicina de Infecciones, Centro Biomédico, Universidad de Lund, 221 00 Lund, Suecia
Aparentemente imposible de determinar, la biodiversidad microbiana es realmente sorprendente con un billón de especies coexistentes (1,2). Aunque climas particularmente duros, como el ambiente ácido del estómago humano (3) o los lagos subglaciales de la Antártida (4), pueden estar dominados por una especie específica, las bacterias se encuentran típicamente en cultivos mixtos. Como cada cepa puede influir en el crecimiento de otra (5), la capacidad de separar y cultivar colonias "puras" (que consisten sólo en un tipo) las colonias se ha vuelto esencial tanto en entornos clínicos como académicos. Los cultivos puros permiten más exámenes genéticos (6) y proteómicos (7), análisis de la pureza de la muestra y, tal vez más notable, la identificación y caracterización de agentes infecciosos a partir de muestras clínicas.
Las bacterias tienen una amplia gama de requisitos de crecimiento y hay numerosos tipos de medios nutritivos diseñados para sostener tanto a las especies poco exigentes como a las fastidiosas (8). Los medios de crecimiento se pueden preparar en forma líquida (como caldo) o en una forma sólida típicamente a base de agar (un agente gelificante derivado de algas rojas). Mientras que la inoculación directa en el caldo conlleva el riesgo de generar una población bacteriana genéticamente diversa o incluso mixta, el revestimiento y el re-streaking crea un cultivo más puro donde cada célula tiene una composición genética muy similar. La técnica de la placa de rayas se basa en la dilución progresiva de una muestra(Figura 1),con el objetivo de separar las células individuales entre sí. Cualquier célula viable (en lo sucesivo, una unidad formadoa de colonias, CFU) sostenida por los medios de comunicación y el entorno designado puede posteriormente encontrar una colonia aislada de células hijas a través de la fisión binaria. A pesar de las rápidas tasas de mutación dentro de las comunidades bacterianas, este grupo celular es generalmente considerado como clonal. La recolección y re-streaking de esta población garantiza que el trabajo posterior implica sólo un solo tipo de bacteria.
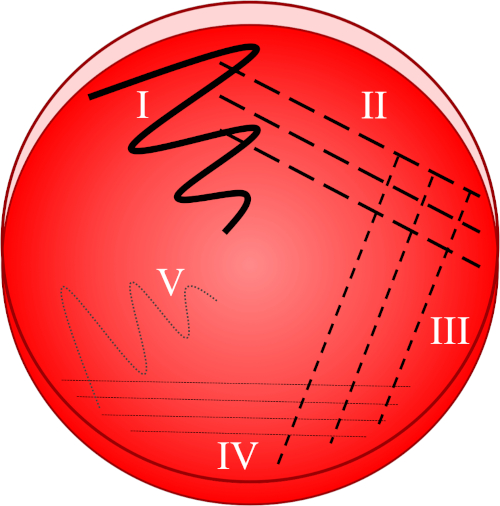
Figura 1: Una placa de rayas se basa en la dilución progresiva de la muestra original. I) El inóculo se dispersa inicialmente usando un movimiento en zig-zag, creando un área con una población bacteriana relativamente densa. II-IV) Las rayas se extraen del área anterior, utilizando un bucle de inoculación estéril cada vez, hasta que se alcanza el cuarto cuadrante. V) Un movimiento final en zig-zag dirigido hacia el centro de la placa forma una región donde el inóculo se ha diluido notablemente, permitiendo que las colonias aparezcan separadas unas de otras.
La técnica de la placa de rayas también se puede combinar con el uso de medios selectivos y/o diferenciales. Un medio selectivo inhibirá el crecimiento de ciertos organismos(por ejemplo, mediante la adición de antibióticos), mientras que un medio diferencial sólo ayudará a distinguirse unos de otros(por ejemplo, a través de la hemólisis en placas de agar en sangre).
Detrás de todo el trabajo en microbiología es el uso de técnicas asépticas (estériles). Cada cultivo bacteriano debe considerarse potencialmente patógeno, ya que existe un riesgo de crecimiento involuntario de cepas traicioneras, formación de aerosoles y contaminación de equipos/personal. Para minimizar estos riesgos, todos los medios, plásticos, metales y vidrio-ware se esterilizan típicamente a través de autoclave antes y después de su uso, sometiéndolos a vapor saturado de alta presión a alrededor de 121 oC que elimina eficazmente las células persistentes. El espacio de trabajo generalmente se desinfecta con etanol antes y después del uso. La capa de laboratorio y los guantes siempre se usan durante el trabajo con agentes infecciosos.
Procedure
1. Configurar
- Todos los microbios deben tratarse como si fueran peligrosos. Use siempre una capa de laboratorio y guantes, ate el cabello largo y asegúrese de que las heridas estén particularmente bien protegidas.
- Preparar el espacio de trabajo esterilizando con 70% de etanol.
- Asegúrese de que las placas de agar, la solución(s) de muestra y una caja de bucles de inoculación de plástico preesterilizados o un bucle de metal más una llama Bunsen, estén cerca. Los bucles de plástico desechables suelen estar preesterilizados. Los bucles metálicos deben sumergirse en 70% de etanol, y luego mantenerse cerca de la zona azul de una llama Bunsen y calentarse hasta que esté ardientemente caliente. Deje que el cable se enfríe elevando la tapa de la placa (sólo ligeramente para evitar la contaminación) y golpeándola contra el medio solidificado.
- Finalice cada procedimiento con una esterilización repetida del espacio de trabajo y un lavado/esterilización exhaustivo de manos y muñecas.
2. Protocolo
- Preparación de medios
- Identificar y preparar un medio sólido (normalmente contiene 1,5% (p/v) agar) que sostendrá las especies/strain bacterianas utilizadas. Mezclar el medio en una botella capaz de sostener el doble del volumen final para evitar el desbordamiento al autoclave.
- Esterilice el soporte colocando el frasco, con una tapa semiapretada, en un autoclave ajustado a 121oC durante 20 min.
- Cierre la tapa correctamente tan pronto como se retire la botella del autoclave. Si el medio se va a utilizar en breve, coloque la botella en un baño de agua ajustado a 45 oC para conservarla en estado líquido. De lo contrario, el agar se solidifique a menos de 32-40 oC, y posteriormente se puede volver a calentar (normalmente usando un microondas) a un punto de fusión a 85 oC.
- Preparación de la(s) placa(s) de cultivo(s)
- Marque la base de los platos estériles de Petri (normalmente 100 x 15 mm) en el lado o en la parte inferior con el nombre del experimentador, la fecha y el tipo de soporte.
- Vierta 20-25 ml de medio de cultivo de agar a 45oC (previamente preparado) en cada una de las placas etiquetadas. Si la espuma aparece a lo largo de los bordes, esto debe ser eliminado rápidamente usando una pipeta regular y una punta estéril.
- Coloque inmediatamente todas las tapas de nuevo en los platos para evitar la contaminación.
- Deje que el agar se solidifique durante aproximadamente 2 horas a temperatura ambiente o durante la noche a 4oC. Una vez establecidas, las placas de cultivo bacterianos deben almacenarse posteriormente boca abajo a 4oC para minimizar la condensación en la superficie media.
- Revestimiento de rayas
- Sumerja un bucle estéril en el inóculo deseado e disperse inmediatamente la muestra recogida en el primer cuadrante de la placa utilizando un movimiento en zig-zag(Figura 1, I).
- Cierre la tapa y vuelva a esterilizar el bucle de inoculación o recoja un nuevo lazo desechable estéril.
- Hacer 3-4 trazos irradiando desde el primer cuadrante (que contiene una población bacteriana relativamente densa) hacia el segundo cuadrante de la placa(Figura 1, II).
- Cierre la tapa y vuelva a esterilizar el bucle de inoculación o deseche el bucle desechable y recoja uno nuevo estéril.
- Repita este rayado de 3-4 golpes desde el segundo hasta el tercer cuadrante, y luego del tercer al cuarto cuadrante, utilizando un bucle estéril cada vez(Figura 1, III - IV).
- Usando un lazo estéril, haga un golpe final en un patrón en zig-zag desde el cuarto cuadrante hacia el centro de la placa(Figura 1, V). La prevalencia bacteriana será menor en esta área, lo ideal es permitir que se establezcan colonias individuales a partir de una sola célula madre viable.
- Cierre la tapa y (si así lo requiere la especie bacteriana) cierre con parafilm para evitar el flujo de aire.
- Dependiendo de las especies bacterianas/strain, coloque la placa de cultivo boca abajo en un ambiente adecuado e incubar hasta que las colonias bacterianas sean visibles (las colonias segregadas pueden aparecer en cualquiera de las áreas de la placa, ya que la concentración inicial puede variar).
- Para generar una población bacteriana clonal, saque otra placa, intercambiando el inóculo chapado en la placa original por células aisladas de una sola colonia de la placa original.
En un plato de Petri, si una sola bacteria se somete a múltiples rondas de reproducción asexual, conducirá a la formación de una colonia clonal. Sin embargo, obtener una sola bacteria de una muestra mixta, como una suspensión del suelo, puede ser difícil. Si se toma un bucle lleno de este cultivo heterogéneo, puede contener hasta un billón de bacterias individuales. Para esparcir estas muchas bacterias en la superficie de una placa de agar y obtener una sola colonia, incluso usando un patrón en zig-zag, el bucle tendría que ser arrastrado continuamente sobre la superficie de suficientes placas establecidas una al lado de la otra para rodear la totalidad de Liberty Island. Obviamente, los científicos no usan tantas placas. En su lugar, utilizan una técnica llamada revestimiento de rayas.
La técnica de la placa de raya se basa en la dilución progresiva de una muestra bacteriana, y se realiza sobre la superficie de medios sólidos de una sola placa De Petri. Para empezar, la superficie del medio se divide visualmente en cinco secciones asignando cuatro fragmentos de la circunferencia como las primeras cuatro secciones, y el centro de la placa como la quinta. Esto creará efectivamente cinco placas de medios de un solo plato de Petri. A continuación, usando un bucle lleno de inóculo deseado, la primera sección se raya usando un patrón en zig-zag. Luego, ya sea un nuevo bucle desechable se utiliza, o en el caso de un bucle de alambre, se esteriliza con un quemador Bunsen, quese quema hasta que está rojo caliente a lo largo de la longitud del alambre. Este uso de un nuevo bucle, o bucle de esterilización de llama, elimina las células bacterianas restantes, ayudando en la dilución de las bacterias. El bucle caliente se enfría en el aire durante unos segundos antes de ser arrastrado a través de la primera sección para crear de tres a cuatro líneas separadas, cada una llevando sólo una fracción de bacterias en la segunda sección. Las secciones restantes se rayan de la misma manera, usando un bucle estéril cada vez, y un solo paso a través de la raya anterior.
Usando este ciclo de rayado y esterilización, la concentración bacteriana en cada sección posterior debe diluirse de modo que la sección final contenga sólo unas pocas bacterias discretamente localizadas. Tras la incubación, estas bacterias discretas se multiplican para producir colonias clonales aisladas de células hijas, que se conocen como Unidades formadoras de colonias, o UFC. Estos pueden ser cosechados y re-streaked para asegurar que el trabajo posterior implica sólo un solo tipo de bacteria, conocido como un cultivo puro. Además de aislar colonias individuales de un cultivo mixto-bacteriano, la técnica de revestimiento de rayas también se utiliza para seleccionar cepas específicas de medios, determinar la morfología de colonias bacterianas o identificar diferentes especies bacterianas. En este video, demostraremos cómo aislar colonias monobacterianas de una suspensión de muestra smezclar-bacteriana a través de la técnica de revestimiento de rayas.
Para empezar, ponte guantes de laboratorio y un abrigo de laboratorio. A continuación, esterilizar el espacio de trabajo con 70% de etanol. A continuación, seleccione un medio adecuado que sostenga las especies bacterianas o cepas utilizadas y comience a preparar los medios. Aquí, el agar LB común se prepara pesando diez gramos de medios pre-formulados en polvo y 7,5 gramos de agar. Agregue los componentes pesados y secos a una botella de vidrio que es capaz de sostener el doble del volumen final para evitar el desbordamiento. Luego, agregue 500 mililitros de agua a la botella, y colóquela semi-firmemente. Esterilice el medio colocando la botella en un autoclave ajustado a 121 grados centígrados durante veinte minutos. Después de la finalización, use guantes a prueba de calor o una almohadilla caliente para quitar el medio de la máquina y luego gire inmediatamente la tapa de la botella para cerrarla firmemente.
Para el uso en el mismo día, deje que el medio se enfríe colocando la botella en un baño de agua calentado a aproximadamente 45 grados centígrados, para preservar los medios en estado líquido. Alternativamente, el medio se puede dejar a temperatura ambiente para almacenar en estado sólido. Cuando sea necesario, microonda la botella con la tapa ligeramente abierta para derretir el medio, y deje que el medio se enfríe con un baño de agua celsius de 45 grados.
A continuación, tome una manga de platos estériles de Petri, y con un marcador permanente, etiquételos con el investigador y los nombres de los medios de comunicación, así como la fecha. A continuación, transfiera el volumen requerido de medios a un recipiente estéril y agregue antibióticos u otros componentes sensibles si es necesario. Aquí, 50 mililitros de medios se mezclan con 100 microlitros de Kanamicina para una concentración final de 25 microgramos por mililitro. Gire el tubo para asegurar una distribución uniforme de los componentes añadidos en todo el soporte. Lentamente, para evitar la formación de burbujas, verter 20 a 25 mililitros de aproximadamente 45 grados celsius medio de cultivo en cada una de las placas. Si aparecen burbujas o espuma, retírelo rápidamente con una pipeta normal y una punta estéril. A continuación, sustituya inmediatamente todas las tapas para evitar la contaminación. Deje que el agar se solidifique a temperatura ambiente durante al menos dos horas o durante la noche. Una vez solidificado, guarde las placas de cultivo boca abajo a cuatro grados centígrados para minimizar la condensación en la superficie del medio.
Para rayar el cultivo de elección, primero tome una placa de cultivo limpia y retire la tapa. Trabajando rápidamente, sumerja un lazo desechable y estéril en el inóculo deseado y luego frote inmediatamente el lazo sobre el primer cuadrante de la placa usando un movimiento en zig-zag. Reemplace la tapa del plato, deseche el bucle de inoculación usado y, a continuación, seleccione un nuevo lazo estéril. Usando el nuevo bucle, haz de tres a cuatro golpes cruzando la línea original del hisopo que irradia desde el primer cuadrante, que debe contener una población de bacterias relativamente densa en el segundo cuadrante. Cierre la tapa una vez más y deseche el lazo. Con un nuevo bucle, repita esta acción de nuevo, pero esta vez rayando desde el segundo hasta el tercer cuadrante. Luego, con un nuevo lazo de nuevo, hacer otra raya desde la tercera en la cuarta sección de la placa. Finalmente, con un lazo fresco, haz un último trazo en un patrón en zig-zag desde el cuarto cuadrante hacia el centro de la placa. La prevalencia bacteriana será menor en esta área, lo ideal es permitir que se establezcan colonias individuales a partir de una sola célula madre viable.
Sustituya la tapa de la placa y, si es apropiado para las especies bacterianas, selle la placa con para película para evitar el flujo de aire. Gire la placa de cultivo al revés para evitar goteos de condensación y, a continuación, colóquela a una temperatura adecuada para el crecimiento. Aquí, una incubadora se establece en 37 grados Celsius. Deje que la placa se incuba hasta que las colonias bacterianas sean visibles. Para generar una población bacteriana clonal, seleccione una colonia discreta de esta placa. Ahora, con el lazo estéril, toque la colonia objetivo, y como antes, haga una raya en el primer cuadrante de una placa nueva. Continúe esterilizando alternativamente el lazo y raye los cuadrantes restantes de la placa como se demostró anteriormente, terminando con el zig-zag hacia el centro. Cierre la placa y colóquela para incubar la cual se formen colonias discretas. Una vez que estas colonias se cultivan, por lo general representan cepas clonales puras.
La placa de raya inicial puede contener colonias originarias de células de diferentes especies bacterianas o células con diferente composición genética, dependiendo de la pureza de la muestra. A través del aislamiento posterior de una sola colonia, donde todas las unidades se derivan de una célula madre común, el segundo procedimiento de rayado genera una población bacteriana relativamente clonal, adecuada para una mayor caracterización o inoculación en caldo.
Subscription Required. Please recommend JoVE to your librarian.
Results
La placa de rayas inicial puede contener colonias originarias de células con diferente composición genética o (dependiendo de la pureza de la muestra) de diferentes especies bacterianas(Figura 2A).
A través del aislamiento posterior de una sola colonia, donde todas las unidades se derivan de una célula madre común, el segundo procedimiento de rayado genera una población bacteriana relativamente clonal, adecuada para una mayor caracterización o inoculación en caldo ( Figura 2B).

Figura 2: Se puede generar un cultivo puro a partir de una muestra mixta a través del aislamiento de una sola colonia aislada. A) El crecimiento de una sola célula bacteriana (CFU) generó una colonia clonal, separada de las de otras especies y cepas. Esta CFU se utilizó para posteriorizar el rayado en una nueva placa B) Una segunda placa, donde la población bacteriana consiste únicamente en células derivadas de la CFU inicial.
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
La capacidad de obtener y cultivar una colonia bacteriana pura es esencial, tanto en entornos clínicos como académicos. El revestimiento de rayas permite el aislamiento de una población celular relativamente clonal, originada a partir de una CFU compartida, que puede ser de particular interés durante el diagnóstico o para la caracterización adicional del aislado. Una muestra se extiende sobre un medio nutritivo a base de agar adecuado y se incuba hasta que las colonias se hacen visibles. Una colonia aislada es posteriormente cosechada y re-rayada en un segundo plato.
Subscription Required. Please recommend JoVE to your librarian.
References
- The Human Microbiome Project C. Structure, Function and Diversity of the Healthy Human Microbiome. Nature. 486:207-214. (2012)
- Locey KJ, Lennon JT. Scaling laws predict global microbial diversity. Proceedings of the National Academy of Sciences. 113 (21) 5970-5975 (2016)
- Skouloubris S, Thiberge JM, Labigne A, De Reuse H. The Helicobacter pylori UreI protein is not involved in urease activity but is essential for bacterial survival in vivo. Infection and Immunity. 66:4517-21. (1998)
- Mikucki JA, Auken E, Tulaczyk S, Virginia RA, Schamper C, Sørensen KI, Doran PT, Dugan H, Foley N. Deep groundwater and potential subsurface habitats beneath an Antarctic dry valley. Nature Communications. 6:6831. (2015)
- Mullineaux-Sanders C, Suez J, Elinav E, Frankel G. Sieving through gut models of colonization resistance. Nature Microbiology. 3:132-140. (2018)
- Fournier PE, Drancourt M, Raoult D. Bacterial genome sequencing and its use in infectious diseases. Lancet Infectious Diseases. 7:711-23 (2007)
- Yao Z, Li W, Lin Y, Wu Q, Yu F, Lin W, Lin X. Proteomic Analysis Reveals That Metabolic Flows Affect the Susceptibility of Aeromonas hydrophila to Antibiotics. Scientific Reports. 6:39413 (2016)
- Medina D, Walke JB, Gajewski Z, Becker MH, Swartwout MC, Belden LK. Culture Media and Individual Hosts Affect the Recovery of Culturable Bacterial Diversity from Amphibian Skin. Frontiers in Microbiology. 8:1574 (2017)




