Overview
Fuente: Andrew J. Van Alst1, Rhiannon M. LeVeque1, Natalia Martin1, y Victor J. DiRita1
1 Departamento de Microbiología y Genética Molecular, Universidad Estatal de Michigan, East Lansing, Michigan, Estados Unidos de América
Las curvas de crecimiento proporcionan información valiosa sobre la cinética del crecimiento bacteriano y la fisiología celular. Nos permiten determinar cómo responden las bacterias en condiciones de crecimiento variables, así como definir parámetros de crecimiento óptimos para una bacteria determinada. Una curva de crecimiento arquetípico progresa a través de cuatro etapas de crecimiento: retraso, exponencial, estacionario y muerte (1).
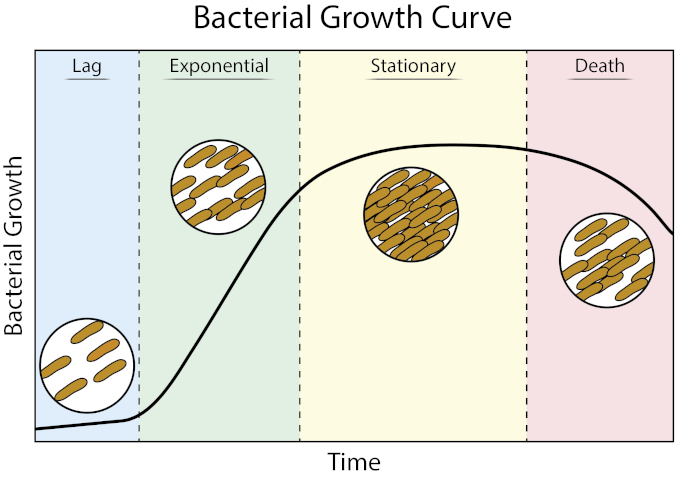
Figura 1: Curva de crecimiento bacteriana. Las bacterias cultivadas en el cultivo por lotes progresan a través de cuatro fases de crecimiento: retraso, exponencial, estacionario y muerte. Fase de retraso es el período de tiempo que tarda la bacteria en alcanzar un estado fisiológico capaz de crecimiento celular rápido y división. La fase exponencial es la etapa de crecimiento y división celular más rápido durante la cual la replicación del ADN, la transcripción del ARN y la producción de proteínas se producen a un ritmo constante y rápido. La fase estacionaria se caracteriza por una ralentización y meseta del crecimiento bacteriano debido a la limitación de nutrientes y/o acumulación intermedia tóxica. La fase de muerte es la etapa durante la cual la lisis celular ocurre como resultado de una limitación severa de nutrientes.
Fase de retraso es el período de tiempo que tarda la bacteria en alcanzar un estado fisiológico capaz de crecimiento celular rápido y división. Este retraso se produce porque las bacterias tardan tiempo en adaptarse a su nuevo entorno. Una vez que los componentes celulares necesarios se generan en fase de retraso, las bacterias entran en la fase exponencial del crecimiento donde se producen la replicación del ADN, la transcripción del ARN y la producción de proteínas
Procedure
1. Configuración
- Materiales de laboratorio requeridos: medios líquidos, medios de agar solidificados, matraces Erlenmeyer, tubos de ensayo de 15 ml, solución salina tamponada de fosfato (PBS), esparcidor celular bacteriano, 70% etanol y un espectrofotómetro. Todas las soluciones y cristalería deben esterilizarse antes de su uso.
- Preparar la estación de trabajo esterilizando con 70% de etanol. Trabaje cerca de un quemador Bunsen para evitar la contaminación de los medios.
- Cuando se trabaja con bacterias, se debe utilizar el equipo de protección personal adecuado y la técnica aséptica. Se requiere una capa de laboratorio y guantes cuando se trabaja con cultivos bacterianos.
- Recetas para búferes, soluciones y reactivos
- Solución salina tamponada de fosfato (PBS) (8).
- Caldo Luria-Bertani (LB) (9).
2. Protocolo
- Preparación de medios
- Identificar los medios de crecimiento con los que cultivar las bacterias y preparar tanto caldo líquido como agar sólido (1,5% p/v agar) en botellas autoclavables separadas. Aquí, el caldo LB y el agar LB se prepararon para el crecimiento de Escherichia coli.
- Esterilice el soporte con una tapa semiapretada en un autoclave ajustado a 121 oC durante 35 min.
- Para los medios de agar, después de la autoclave, colóquelo en un baño de agua ajustado a 50 oC durante 30 minutos para enfriar. Una vez enfriado, vierta los medios de agar de 20-25 ml en platos circulares Petri de 100x15 mm. Deje que las placas se ajusten 24 horas a temperatura ambiente antes de su uso.
- Preparación inicial de bacterias
- A partir de las existencias congeladas, las bacterias de la raya para el aislamiento en el agar de medios seleccionados para obtener aislados de una sola colonia. Incubar en condiciones de crecimiento permisibles para las bacterias elegidas. Aquí, E. coli se extiende sobre el agar LB y se incuba a 37 oC durante la noche (16-18h).
- Usando un bucle de inoculación estéril, seleccione una sola colonia de la placa de raya e inocular medios líquidos de 4 ml en un tubo de ensayo de 15 ml y crezca en condiciones permisibles para las bacterias elegidas. Aquí, E. coli se cultiva a 37 oC con temblores a 210 rpm durante la noche (16-18h).
- Configuración de la curva de crecimiento
- Preparación del matraz de crecimiento
- Autoclave frascos Erlenmeyer de tamaño adecuado. Normalmente, se utiliza una proporción de 1:5 entre el volumen total del matraz. Aquí, los medios LB de 100 ml se utilizan en un matraz de 500 ml.
- Con una pipeta serológica, transfiera medios estériles al matraz Erlenmeyer.
- Preparación de la serie de dilución
- Etiqueta 15 mL tubos de ensayo: -1, -2, -3, -4, -5, -6, -7, -8 y -9, distribuyendo 9ml PBS en cada uno. Estos números corresponden al factor de dilución utilizado para calcular la CFU/ml. Se necesita un nuevo conjunto de tubos para cada punto de tiempo de recolección. (Figura 2)
- Preparación de la placa de agar
- Placas de etiqueta con tiempo de recolección y factor de dilución. Por cada punto de tiempo habrá una placa para cada dilución.
- Preparación del matraz de crecimiento
- Protocolo de curva de crecimiento
- Inoculación de medios
- Utilizando el cultivo líquido nocturno preparado como parte del paso 2.2.2, inocular los medios de matraz con 1:1000 volumen de cultivo. Aquí, se añade un cultivo líquido nocturno de 100 ml a los medios LB de 100 ml.
- Gire los medios para distribuir uniformemente las bacterias.
- Colección Timepoint
- Configuración de la condición de crecimiento
- Coloque el matraz en condiciones de crecimiento experimental elegidas para las bacterias dadas. Los plazos deben tomarse con frecuencia para las bacterias de rápido crecimiento y se pueden tomar en intervalos más largos para las bacterias de crecimiento lento. Aquí, E. coli se cultiva a 37oC con temblores a 210 revoluciones por minuto (rpm) y puntos de tiempo tomados cada 1 hora.
- Medición de densidad óptica (OD600)
- En cada punto de tiempo, incluido el punto de inactividad de inicio (t a 0), retire 1 ml de cultivo bacteriano y dispensar en una cubeta de espectrofotómetro.
- Limpie la cubeta y registre la densidad óptica a una longitud de onda de 600 nm. Si la lectura de la densidad óptica es mayor que 1,0, diluir 100 ml de cultivo 1:10 con medios frescos de 900 ml, registrar la densidad óptica y multiplicar este valor por 10 para la medición OD600.
- Medición de la unidad formadoras de colonias (CFU/ml)
- En cada punto de tiempo, retirar 1 ml de cultivo bacteriano y dispensar en el tubo de ensayo de vidrio -1 que contiene 9 ml de PBS.
- Para la serie de dilución, transfiera en serie 1 ml desde el tubo -1 por todos los tubos de dilución hasta el -9, vórtice después de cada transferencia. (Figura 2)
- Para cada dilución, dispensar 100 ml de suspensión celular a la placa de agar de medios sólidos etiquetada correspondientemente. (Figura 2)
- Usando un esparcidor celular que ha sido esterilizado en etanol, pasado a través de una llama del quemador Bunsen, y enfriado tocando la superficie del agar, esparza los 100 s de suspensión celular hasta que la superficie de la placa de agar se seque.
- Incubar las placas de propagación boca abajo a una temperatura que apoya el crecimiento de las bacterias. Aquí, E. coli se incuba a 37oC.
- Después de la incubación, una vez que surgen colonias visibles, contar el número de colonias bacterianas en cada placa y registrar estos valores junto con su factor de dilución asociado para todas las placas en cada punto de tiempo.
- Configuración de la condición de crecimiento
- Inoculación de medios
3. Análisis de datos y resultados
- Gráfica de curva de crecimiento de densidad óptica (OD600)
- Trazar la densidad óptica (OD600) frente al tiempo en una escala de semiregistro. (Figura 3)
- Unidad formadoras de colonias (CFU/mL) Gráfica de curva de crecimiento
- Para cada punto de tiempo, elija la placa de dilución donde el recuento de colonias cayó dentro del rango de 30-300 bacterias. Multiplique el número de recuento de colonias por el factor de dilución y luego por 10, ya que la dispersión de 100 l se considera una dilución adicional de 1:10 al calcular CFU/ml.

- Trazar las unidades formadoras de colonias en comparación con el tiempo en una escala de semi-registro. (Figura 4)
- Para cada punto de tiempo, elija la placa de dilución donde el recuento de colonias cayó dentro del rango de 30-300 bacterias. Multiplique el número de recuento de colonias por el factor de dilución y luego por 10, ya que la dispersión de 100 l se considera una dilución adicional de 1:10 al calcular CFU/ml.
- Relación de densidad óptica y unidades formadoras de colonias
- Trazar las unidades formadoras de colonias frente a la densidad óptica en una escala lineal para las lecturas OD600 menor o igual a 1.0 OD600 ya que la relación entre OD600 y CFU/mL es menos precisa más allá de 1.0 OD600. Aquí, se trazan los primeros seis puntos de tiempo. (Figura 5)
- Genere una línea de tendencia de regresión lineal que muestre la ecuación y el valor R2.
- Determinar el tiempo de duplicación de bacterias
- Usando la gráfica de curva de crecimiento de la unidad de formación de colonias, durante la fase exponencial, identifique dos puntos en el gráfico con la pendiente más pronunciada entre ellos para calcular el tiempo de duplicación.
- Cálculo del tiempo de duplicación

- •Tiempo s 2 - t1, donde t1 - Punto de tiempo 1 y t2 - Punto de tiempo 2
-
 , donde b es el número de bacterias en t2, B - número de bacterias en t1, y n número de generaciones. Derivado de:
, donde b es el número de bacterias en t2, B - número de bacterias en t1, y n número de generaciones. Derivado de: .
- Calcular el tiempo de duplicación utilizando:

Las bacterias se reproducen a través de un proceso llamado división celular, que resulta en dos células hijas idénticas. Si las condiciones de crecimiento son favorables, las poblaciones bacterianas crecerán exponencialmente.
Las curvas de crecimiento bacteriana trazan la cantidad de bacterias en un cultivo en función del tiempo. Una curva de crecimiento típica progresa a través de cuatro etapas: fase de retraso, fase exponencial, fase estacionaria y fase de muerte. La fase de retraso es el tiempo que tardan las bacterias en llegar a un estado en el que pueden crecer y dividirse rápidamente. Después de esto, la transición de las bacterias a la fase exponencial, caracterizada por el rápido crecimiento celular y la división. La tasa de crecimiento exponencial del cultivo bacteriano durante esta fase se puede expresar como el tiempo de duplicación, la tasa más rápida a la que las bacterias pueden reproducirse en condiciones específicas. La fase estacionaria viene a continuación, donde las mesetas de crecimiento celular bacteriano y las tasas de crecimiento y mortalidad incluso hacia fuera debido al agotamiento de nutrientes ambientales. Finalmente, las bacterias entran en la fase de muerte. Aquí es donde el crecimiento bacteriano disminuye bruscamente y el agotamiento severo de nutrientes conduce a la lising de las células.
Se pueden utilizar dos técnicas para cuantificar la cantidad de bacterias presentes en un cultivo y trazar una curva de crecimiento. El primero de ellos es a través de unidades formadoras de colonias, o UFC. Para obtener UFC se realiza una serie de nueve diluciones en puntos de tiempo regulares. La primera de estas diluciones, negativa en este ejemplo, contiene 9 ml de PBS y 1 ml del cultivo bacteriano. Resultando en un factor de dilución 1:10. A continuación, 1 ml de esta solución se transfiere al siguiente tubo, dos negativos, lo que resulta en un factor de dilución 1:100. Este proceso continúa a través del último tubo, nueve negativo, resultando en un factor de dilución final de 1:1 mil millones. Después de esto, 100 microlitros de cada dilución se chapa. Las placas se incuban y se cuentan las colonias clonales. La placa de dilución para un punto de tiempo dado que crece entre 30 y 300 colonias se utiliza para calcular las UFC por mililitro para ese punto de tiempo.
El segundo método común de medición de la concentración bacteriana es la densidad óptica. La densidad óptica de un cultivo se puede medir instantáneamente, en relación con un medio en blanco, con un espectrofotómetro. Típicamente una longitud de onda de 600 nanómetros, también conocido como OD600, se utiliza para estas mediciones, que aumentan a medida que aumenta la densidad celular. Mientras que la densidad óptica es menos precisa que las UFC, es conveniente porque se puede obtener instantáneamente y requiere relativamente pocos reactivos. Ambas técnicas se pueden utilizar juntas para crear una curva estándar que se aproxime con mayor precisión al recuento de células bacterianas de un cultivo. En este vídeo, aprenderá cómo obtener mediciones de UFC y OD600 a partir de diluciones seriales cronometradas de E. coli. A continuación, se trazarán dos curvas de crecimiento utilizando las mediciones CFU y OD600, respectivamente, antes de ser relacionadas por una curva estándar.
Cuando se trabaja con bacterias, es importante utilizar el equipo de protección personal adecuado, como una capa de laboratorio y guantes, y observar la técnica aséptica adecuada.
Después de esto, esterilizar la estación de trabajo con 70% de etanol. Primero, prepare el caldo LB y los medios de agar sólidos LB en botellas autoclavebles separadas. Después de cerrar parcialmente las tapas de las botellas, esterilizar el medio en un autoclave establecido a 121 grados Celsius durante 35 minutos. A continuación, deje que el medio de agar se enfríe en un baño de agua ajustado a 50 grados Celsius durante 30 minutos. Una vez enfriado, vierta de 20 a 25 ml en cada plato de Petri. Después de esto, deje que las placas se ajusten durante 24 horas a temperatura ambiente.
Para preparar los aislados de una sola colonia que más tarde se utilizarán para producir un cultivo bacteriano líquido, utilice el caldo previamente congelado y la técnica de revestimiento de rayas adecuada para rayar E. coli para el aislamiento en el agar LB. Incubar el plato a 37 grados Celsius durante la noche. Después de esto, enfríe un bucle de inoculación esterilizado por llama en el agar antes de seleccionar una sola colonia de la placa rayada. Inocular 4 ml de medios líquidos en un tubo de ensayo de 15 ml. Luego, haga crecer la E. coli a 37 grados centígrados durante la noche con agitación a 210 rpm.
Para configurar el volumen 1:1000 del cultivo bacteriano que se utilizará en la curva de crecimiento, primero obtenga un matraz Erlenmeyer autoclavedo de 500 ml. A continuación, utilice una pipeta serológica de 50 ml para transferir 100 ml de medios estériles al matraz. A continuación, etiquetar nueve tubos de ensayo de 15 ml consecutivamente como uno a nueve. Estos números corresponden al factor de dilución que se utilizará para calcular la unidad formadoa de colonias, o CFU. A continuación, agregue 9 ml de 1X PBS a cada tubo. Después de esto, etiquetar las placas de agar preparadas con los puntos de tiempo y factores de dilución correspondientes que se cultivarán. En este ejemplo con E. coli, después del punto de tiempo de inicio, los puntos de tiempo se toman una vez cada hora. Utilizando el cultivo líquido de E. coli durante la noche previamente preparado, inocular los medios en el matraz Erlenmeyer de 500 ml de autoclave con volumen de cultivo 1:1000. Gire los medios para distribuir uniformemente las bacterias.
Después de borrar un espectrofotómetro, limpie la cubeta con una toallita sin pelusas. A continuación, dispensar 1 ml del cultivo en la cubeta y colocarlo en el espectrofotómetro para obtener la densidad óptica del cultivo en el punto de tiempo cero. Luego, crecer la E. coli a 37 grados Centígrados con agitación a 210 rpm. En cada momento después del punto de tiempo cero, retire otro 1 ml de cultivo bacteriano del matraz y repita la medición de densidad óptica. Si la lectura de densidad óptica es mayor que 1.0, diluir 100 microlitros de cultivo bacteriano con 900 microlitros de medios frescos y luego medir la densidad óptica una vez más. Este valor se puede multiplicar por 10 para la medición OD 600.
Para obtener la medida de la unidad de formación de colonias para cada punto de tiempo, retire 1 ml adicional de cultivo bacteriano del matraz en cada punto de tiempo. Dispensar el cultivo bacteriano en el tubo de ensayo negativo y el vórtice para mezclar. A continuación, realice la serie de dilución transfiriendo primero 1 ml del tubo negativo al tubo negativo de dos tubos y vórtice para mezclar. Transfiera 1 ml desde el tubo negativo de dos tubos al tres tubos negativos y el vórtice para mezclar. Continúe esta transferencia serial por todos los tubos de dilución al tubo negativo de nueve. Dispensar 100 microlitros de suspensión celular en la placa etiquetada correspondientemente para cada dilución. Para cada dilución, esterilizar un esparcidor celular en etanol, pasarlo a través de una llama de quemador Bunsen, y enfriarto tocando la superficie del agar lejos del inoculado. Luego, usa el esparcidor celular para extender la suspensión celular hasta que la superficie de la placa de agar se seque. Incubar las placas al revés a 37 grados centígrados. Una vez que surgen colonias visibles, contar el número de colonias bacterianas en cada plato. Registre estos valores y sus factores de dilución asociados para cada placa en cada punto de tiempo.
Para crear una curva de crecimiento OD 600, después de asegurarse de que todos los puntos de datos se introducen correctamente en una tabla, seleccione todos los puntos de tiempo y sus datos correspondientes. Para generar una parcela de curva de crecimiento de unidad de formación de colonias, elija la placa de dilución donde el recuento de colonias cayó dentro del rango de 30 a 300 bacterias para cada punto de tiempo. Multiplique el número de recuento de colonias por el factor de dilución y, a continuación, por diez. Esto se debe a que la propagación de 100 microlitros se considera una dilución adicional de 1:10 al calcular unidades formadoras de colonias por mililitro. Después de esto, trazar las unidades formadoras de colonias frente al tiempo en una escala de semi-registro.
Estas parcelas producidas con mediciones de OD 600 y CFU, respectivamente, pueden proporcionar información valiosa sobre la cinética de crecimiento de E. coli. La densidad óptica y las unidades formadoras de colonias pueden estar relacionadas, de modo que los UFC por mililitro se pueden estimar a partir de mediciones de 600 OD, ahorrando tiempo y materiales en futuros experimentos.
Para ello, trazar las unidades formadoras de colonias contra la densidad óptica en una escala lineal para OD 600 lecturas menores o iguales a 1. 0. Después de esto, genere una línea de tendencia de regresión lineal en formato Y - MX + B, donde M es la pendiente y B es la intercepción y. Haga clic con el botón derecho en los puntos de datos y seleccione añadir línea de tendencia y lineal. A continuación, marque la casilla para mostrar la ecuación en el gráfico y mostrar el valor cuadrado R en el gráfico. El valor R al cuadrado es la medida estadística de la distancia con la que los datos coinciden con la línea de regresión ajustada. En este ejemplo, los primeros 6 puntos de tiempo se trazan con OD 600 en el eje x y UFC por mililitro en el eje y. En experimentos futuros con las mismas condiciones de crecimiento, estos valores de pendiente e intercepción y se pueden conectar a esta ecuación para estimar las UFC a partir de las lecturas OD 600. A continuación, mire la parcela de la curva de crecimiento de la unidad de formación de colonias. Durante la fase exponencial, identifique dos puntos de tiempo con la pendiente más pronunciada entre ellos. Para calcular el tiempo de duplicación, primero calcule el cambio de tiempo entre los puntos de tiempo seleccionados. A continuación, calcule el cambio en las generaciones utilizando la ecuación que se muestra aquí. Aquí, el caso inferior b es el número de bacterias en el punto de tiempo tres y el caso superior B es el número de bacterias en el punto de tiempo dos. Por último, divida el cambio en el tiempo por el cambio en las generaciones. En este ejemplo, el tiempo de duplicación es 0. 26 horas o 15 minutos y 19 segundos. Comparar los tiempos de duplicación en diferentes tratamientos experimentales nos permite identificar las mejores condiciones de crecimiento para una determinada especie bacteriana. Por lo tanto, el tratamiento con el menor tiempo de duplicación será el más óptimo de las condiciones probadas.
Subscription Required. Please recommend JoVE to your librarian.
Results
Las parcelas de las unidades formadoras de colonias y la densidad óptica son dos formas de visualizar la cinética del crecimiento. Al determinar la relación entre CFU/mL y OD600, la gráfica de densidad óptica también proporciona una estimación de CFU/ml a lo largo del tiempo. Las condiciones que resultan en el menor tiempo de duplicación se consideran óptimas para el crecimiento de las bacterias dadas.
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
Las curvas de crecimiento son valiosas para entender la cinética de crecimiento y la fisiología de las bacterias. Nos permiten determinar cómo responden las bacterias en condiciones de crecimiento variables, así como definir los parámetros de crecimiento óptimos para una bacteria dada. Las gráficas de unidad de formación de colonias y densidad óptica contienen información valiosa que muestra la duración de la fase de retraso, la densidad celular máxima alcanzada y permite el cálculo del tiempo de duplicación bacteriana. Las curvas de crecimiento también permiten la comparación entre diferentes bacterias en las mismas condiciones de crecimiento. Además, la densidad óptica proporciona un medio para estandarizar los inóculos iniciales, mejorando la consistencia en otros experimentos.
Determinar qué enfoque utilizar al diseñar un experimento de curva de crecimiento requiere consideración. Como método preferido para generar curvas de crecimiento, las gráficas unitarias formadoras de colonias reflejan con mayor precisión los recuentos de celdas viables en el cultivo por lotes. Las parcelas unitarias formadoras de colonias también permiten medir el crecimiento bacteriano en condiciones que de otro modo interferirían con una medición de densidad óptica. Sin embargo, es un proceso que consume más tiempo, que requiere un uso extensivo de reactivos, y debe realizarse manualmente. Las gráficas de densidad óptica son menos precisas y proporcionan sólo una estimación de las unidades formadoras de colonias, lo que requiere una curva estándar que se generará para cada bacteria única. La densidad óptica se utiliza principalmente para su comodidad, ya que consume mucho menos tiempo y no requiere muchos reactivos para funcionar. Lo más atractivo para la densidad óptica, es que las incubadoras espectrofotométricas pueden generar automáticamente curvas de crecimiento, aumentando enormemente el número de condiciones de cultivo que se pueden probar a la vez y eliminando la necesidad de asistir constantemente a la cultura.
Subscription Required. Please recommend JoVE to your librarian.
References
- R. E. Buchanan. 1918. Life Phases in a Bacterial Culture. J Infect Dis 23:109-125.
- CAMPBELL A. 1957. Synchronization of cell division. Bacteriol Rev 21:263-72.
- Wang P, Robert L, Pelletier J, Dang WL, Taddei F, Wright A, Jun S. 2010. Robust growth of Escherichia coli. Curr Biol 20:1099-103.
- Goldman E, Green LH. 2015. Practical Handbook of Microbiology, Third Edition. CRC Press.
- Ben-David A, Davidson CE. 2014. Estimation method for serial dilution experiments. J Microbiol Methods 107:214-221.
- Koch AL. 1968. Theory of the angular dependence of light scattered by bacteria and similar-sized biological objects. J Theor Biol 18:133-156.
- Sezonov G, Joseleau-Petit D, D'Ari R. 2007. Escherichia coli physiology in Luria-Bertani broth. J Bacteriol 189:8746-9.







 , donde b es el número de bacterias en t2, B - número de bacterias en t1, y n número de generaciones. Derivado de:
, donde b es el número de bacterias en t2, B - número de bacterias en t1, y n número de generaciones. Derivado de: