Summary
Nous décrivons une technique pour la préparation de clarifier humaine homogénats corticaux, la séparation des protéines par SDS-PAGE, la récupération d'antigène et immunoblot avec un anticorps dirigé contre le peptide Aß. En utilisant ce protocole, nous avons constamment de détecter Aßi monomère et multimère dans le tissu cortical des humains à la pathologie d'Alzheimer.
Abstract
Le pliage anormal et la polymérisation de la β-amyloïde (Aß) peptide est pensé pour initier la cascade dans la pathogenèse de maladies neurodégénératives maladie d'Alzheimer
Protocol
Partie 1: Préparation des homogénats de tissus clarifié
- Dounce homogénéiser non fixée tissu cortical en 4 fois le volume du tampon glacé (0,1 M tampon phosphate salin [Ca + + - et Mg + + libre] plus un cocktail 2x inhibiteur de la protéase [Santa Cruz]), avec environ 30 coups, même un pilon (c'est à dire ajouter des tampons 400μl à 100mg de tissu).
- Homogénats Spin pendant 5 minutes à 3000 g (4 ° C). Retirez délicatement surnageants clarifiés et stocker des aliquotes de ces extraits à -80 ° C jusqu'à utilisation.
- Déterminer la concentration en protéines totales (pg / pl) pour homogénats clarifiés à l'aide d'un acide bicinchoninique (BCA) dosage, selon les instructions du fabricant (ThermoFisher).
Partie 2: Préparation des échantillons SDS-PAGE
- Avec un puits 10, 10-20% de gel tricine (Invitrogen), le volume maximal qui peut être chargé par puits est ~ 25 pi. Le volume total comprend 2x tampon d'échantillon SDS et 10x agent réducteur, de sorte que le volume maximal d'homogénat clarifié qui peuvent être chargés par puits est 10 ul. Clarification de 20% (p / v) homogénats corticaux doit avoir une concentration totale en protéines supérieure à 5 pg / pl, permettant de 50μg de protéines totales par puits. Échantillons contenant moins de protéines 5mg/ml nécessitera de chargement moins de protéines totales par puits. Toutefois, les taux de protéines élevé sont optimales pour la détection de Aß monomérique et agrégée (protéines totales 50-60μg est optimal).
Toujours charger la même quantité de protéines totales par puits. - Pour chaque gel, la charge d'au moins un bien avec 10 ul d'un marqueur de poids moléculaire telles que SeeBlue Plus2 (Invitrogen). Comme contrôle positif, course de 10 100 ng de synthèse Aß40 ou Aß42 peptide (dilué dans 1xPBS) dans un autre puits.
- Préparer des mélanges de réaction sur la glace, en utilisant fraîchement décongelé, homogénats clarifiés. Tubes vortex pendant 5-10 secondes, de la chaleur dans un bain à sec à 100 ° C pendant 5 minutes, puis rapidement tourner tous les échantillons pour enlever la condensation dans le bouchon.
Partie 3: L'électrophorèse sur gel SDS-PAGE
- Charger les échantillons au vortex sur un gel tricine 10-20% dans l'XCell Sure Lock mini-cellule Gelbox, en utilisant Tricine tampon SDS courir, conformément aux instructions du fabricant (Invitrogen),
- Exécuter gel à une tension constante de 125V pendant environ 90 minutes. Laissez échantillons courir jusqu'à la bande de marqueur 4KDa est d'environ 1 cm du bas du gel.
Partie 4: Protéines Transfert à partir de gels d'Membranes
- Retirez délicatement les gels de boîtier en plastique et d'assembler les sandwichs le transfert à l'intérieur du module XCell II Blot, conformément aux instructions du fabricant (Invitrogen). Pré-humide buvard plaquettes et des membranes de nitrocellulose 0,2 um avec du Tris-Glycine transfert de mémoire tampon (20% de méthanol), et éliminer les bulles d'coussinets buvard ou papier filtre / membrane sandwich.
- Dans le Gelbox XCell, remplir la chambre intérieure avec un tampon de transfert et de remplir la chambre extérieure avec DIH 2 O (exposition méthanol peut s'user l'gelbox en plastique au cours du temps).
- Exécuter le transfert pendant 2-3 heures à une intensité constante de 25mA.
- Lorsque le transfert est terminé, déconstruire le sandwich et le lieu des gels en DIH 2 O et les membranes dans 1xPBS, à la fois dans le carré des boîtes de Pétri en plastique (ou un autre récipient approprié).
- Pour visualiser l'efficacité du transfert de protéines, les gels peuvent être colorés avec Simply Blue SafeStain (Invitrogen), et les membranes avec du Ponceau S tache rouge (Aldrich Sigma), à la fois selon les instructions du fabricant. Cette coloration ne pas interférer avec immunoblot. Si la coloration révèle la protéine de transfert inefficaces, de modifier le temps de transfert à l'étape 3.
Partie 5. Antigène-épitope de récupération & immunoblot
- Récupération d'antigène est une étape importante en révélant les épitopes Aßi sur la membrane pour la liaison des anticorps au cours immunoblot. Toute bain vapeur, micro-ondes, ou de l'eau qui maintient une température constante de 100 ° C suffisent. Pour la récupération d'antigène dans un bateau à vapeur, la chaleur de la membrane d'étanchéité dans une pochette en plastique robuste Kapak rempli 1xPBS, à température ambiante. Posez le plat dans un sachet vapeur préchauffé, une fois le sachet commence à se dilater, incuber pendant 15 minutes supplémentaires. Laisser la membrane à refroidir lentement avant de le retirer de la poche, pour éviter le froissement excessif.
- A température ambiante, retirez soigneusement la membrane de la poche vapeur et rincer la membrane pendant 5 minutes dans 1xPBS, suivie d'un rinçage de 5 minutes dans du TBS-T (Tris-Buffered Saline, pH 8,0 avec 0,05% de Tween-20 [Sigma] ), sur un agitateur orbital. Incuber la membrane dans une solution de blocage (lait écrémé 2,5% dans du TBS-T) pour une heure, je tremblais. Sans rinçage, le transfert de la membrane d'un plat ou d'un sachet en plastique contenant l'anticorps primaire dilué dans une solution de blocage (6E10 au 1:1000 [1μg/ml] 1:5.000 [0.2μg/ml] dilution, Covance), bulle en évitants. Incuber sur un agitateur orbital à température ambiante pendant une heure puis 24-48 heures d'agitation à 4 ° C (incubation plus longue peut donner un meilleur signal).
- Rincer la membrane pendant 30 minutes dans du TBS-T (un rinçage rapide suivie par rinçages x 3 minutes 10).
- Incuber la membrane dans HRP-anticorps secondaire conjugué (Amersham ECL mouton anti-souris, GE Healthcare), dilué au 1:10000 en solution de blocage, pendant 90 minutes sur l'agitateur à température ambiante.
- Rincer la membrane pendant 30 minutes dans du TBS-T (un rinçage rapide suivie par rinçages x 3 minutes 10).
- Sur le shaker, incuber la membrane fraîchement faite SuperSignal Ouest réactif électrochimioluminescence Pico (ThermoFisher) pendant 5 minutes, éponger l'excès de réactif sur off non pelucheux papier filtre et placer la membrane dans une cassette de film, entre les protecteurs feuille de plastique. Blot hors supplémentaires réactif SuperSignal avec de la poussière sans Kimwipes si nécessaire.
- Exposer à Kodak Biomax MR film pour des intervalles de 30 secondes jusqu'à 30 minutes et se développer dans un développeur film. Après 5 minutes, les bandes monomère Aßi sera probablement saturé.
- Les membranes peuvent être dépouillé (après rinçage dans du TBS-T) en agitant dans Restore Plus de décapage de tampon pendant 30 minutes à température ambiante et sondé avec des anticorps supplémentaires, si désiré.
Partie 6: Représentant Immunoblot:
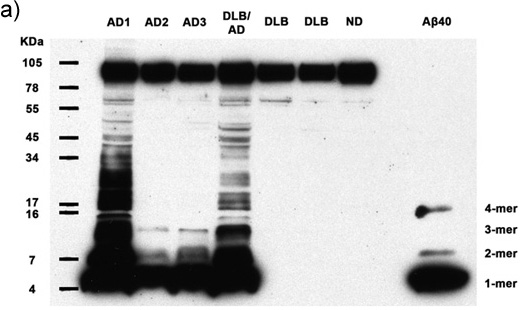


Les figures 1a-c. Homogénats clarifié contenant 50μg de protéines totales de 7 sujets humains sont analysés pour la présence de Aßi multimérique et APP. Immunoblot avec des anticorps 6E10 révèle monomères Aßi, dimères, trimères, tétramères, et l'APP (bande supérieure) dans tous les cas d'Alzheimer, ainsi que plus abondante moléculaires multimères Aßi poids dans 2 cas après JC. Synthétique Aß40 confirme l'identité des bandes plus faible poids moléculaire. AD: La maladie d'Alzheimer, DLB: La démence à corps de Lewy, ND: non déments humaine (a) l'exposition du film de 30 minutes, (b) l'exposition du film de 5 minutes, (c) une exposition de 30 secondes du film..
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Malgré l'importance de l'agrégation Aßi dans la pathogenèse de la maladie d'Alzheimer 1,4,5, peu d'études ont décrit ou quantifié la distribution de divers multimères Aßi dans des échantillons de tissu cortical 2. Communément utilisé des techniques d'immunohistochimie ne permettent pas la discrimination des espèces distinctes Aßi multimérique dans le tissu cortical fixe. En non fixée homogénats de tissus corticaux, multimères Aßi peuvent être séparés et évalués à l'aide biochimiquement électrophorèse sur gel et les méthodes de détection à base d'anticorps. Cependant, les épitopes Aßi qui sont ciblés peuvent être cachés dans agrégées et modifications post-traductionnelles des structures peptidiques, empêchant la détection et la quantification précise de Aß agrégé. En utilisant la chaleur induite par l'antigène démas combiné avec SDS-PAGE et immunoblot avec un anticorps dirigé contre la région N-terminale de 6,7 Aßi, nous sommes en mesure de séparer et de détecter naturellement multimères Aßi isolée de cerveaux humains. Populations distinctes multimère Aßi dans des homogénats de tissu peuvent alors être clarifiés quantifiée par densitométrie. En outre, la combinaison de gel ou de la membrane-extraction avec Aßi immunoblot permettra pour la caractérisation structurale des autres naturellement, modifications post-traductionnelles multimères Aßi de tissus humains. Il sera important de déterminer si des multimères Aßi dans le cerveau humain sont SDS-résistant, ou si elles sont de SDS-sensibles et donc décomposée en petits agrégats dénaturation par le SDS dans des conditions définies. La caractérisation des diverses formes de Aß agrégé dans le cerveau humain va faciliter la recherche de thérapies et des biomarqueurs pour la maladie d'Alzheimer.
Subscription Required. Please recommend JoVE to your librarian.
Acknowledgments
Un grand merci à Elaine Pranski et Carolyn Suwyn d'assistance technique excellente et à Harry LeVine III, M. Paul Murphy, et se prépare pour des conversations importantes Marla. Le financement a été fourni par RR-00165, PO1AG026423, P50AG025688, AG030539, la Fondation Woodruff et le Comité de recherche de l'Université Emory.
Materials
| Name | Company | Catalog Number | Comments |
| Complete Protease Inhibitor Cocktail Tablets | Santa Cruz Biotechnology, Inc. | Sc-29130 | 1 tablet in 25ml buffer |
| BCA Protein Assay kit | Thermo Fisher Scientific, Inc. | 23225 | |
| XCell SureLock Mini-Cell and XCell II Blot Module Kit CE Mark | Invitrogen | EI0002 | |
| Novex Tricine SDS Sample Buffer (2X) | Invitrogen | LC1676 | |
| NuPAGE Sample Reducing Agent (10X) | Invitrogen | NP0004 | |
| SeeBlue Plus2 Pre-Stained Standard | Invitrogen | LC5925 | |
| Novex 10-20% Tricine Gel 1.0 mm, 10 well | Invitrogen | EC6625BOX | |
| Nitrocellulose membranes, 0.2 μm pore size | Invitrogen | LC2000 | |
| Novex Tricine SDS Running Buffer (10X) | Invitrogen | LC1675 | |
| Novex Tris-Glycine Transfer Buffer (25X) | Invitrogen | LC3675 | |
| SimplyBlue SafeStain | Invitrogen | LC6060 | Will not interfere with immunostaining |
| ATX Ponceau S Red staining solution | Sigma-Aldrich | 09276 | Will not interfere with immunostaining |
| Kapak heat sealable plastic sample pouches | Fisher Scientific | 0181225AA | |
| 6E10 mouse monoclonal antibody to Aβ(1-16) | Covance | SIG-39320 | Dilute 1:1,000 up to 1:5,000 for WB |
| Tween 20 | Sigma-Aldrich | P2287 | |
| ECL Mouse IgG, HRP-Linked Whole Aβ (from sheep) | GE Healthcare | NA931-1ML | Dilute at 1:10,000 |
| SuperSignal West Pico Chemiluminescent Substrate | Thermo Fisher Scientific, Inc. | 34077 | |
| Kodak Biomax MR Film | Carestream Health | 870 1302 |
References
- Hardy, J., Selkoe, D. J. The amyloid hypothesis of Alzheimer's disease: progress and problems on the road to therapeutics. Science. 297, 353-356 (2002).
- Haass, C., Selkoe, D. J. Soluble protein oligomers in neurodegeneration: lessons from the Alzheimer's amyloid beta-peptide. Nat. Rev. Mol. Cell. Biol. 8, 101-112 (2007).
- Walker, L. C., LeVine, H. The cerebral proteopathies. Neurobiol. Aging. 21, 559-561 (2000).
- Selkoe, D. J. Aging, amyloid, and Alzheimer's disease: a perspective in honor. of Carl Cotman. Neurochem. Res. 28, 1705-1713 (2003).
- Walsh, D. M., Selkoe, D. J. Abeta oligomers - a decade of discovery. J. Neurochem. 101, 1172-1184 (2007).
- Swerdlow, P. S., Finley, D., Varshavsky, A. Enhancement of immunoblot sensitivity by heating of hydrated filters. Anal. Biochem. 156, 147-153 (1986).
- Ida, N., Hartmann, T., Pantel, J., Schröder, J., Zerfass, R., Förstl, H., Sandbrink, R., Masters, C. L., Beyreuther, K. Analysis of hetergeneous A4 peptides in human cerebrospinal fuid and blood by a newly developed sensitive Western blot assay. J. Biol. Chem. 271, 22908-22914 (1996).



