Summary
Nós descrevemos uma técnica para a preparação de esclarecer humanos homogeneizados cortical, separação de proteínas por SDS-PAGE, recuperação antigênica e immunoblotting com um anticorpo para o peptídeo Aâ. Usando este protocolo, que consistentemente detectar Aâ monomérica e multimérica no tecido cortical dos seres humanos com a patologia de Alzheimer.
Abstract
O dobramento anômala e polimerização da β-amilóide (Aâ) peptídeo é pensado para iniciar a cascata neurodegenerativa na patogênese da doença de Alzheimer
Protocol
Parte 1: Preparação dos homogeneizados de tecido esclarecidas
- Dounce homogeneizar o tecido cortical unfixed no volume 4 vezes de gelada tampão (0,1 M tampão fosfato [Ca + + - e Mg + + livre] mais 2x coquetel inibidor de protease [Santa Cruz]) com aproximadamente 30 golpes mesmo pilão (ie tampão adicionar 400μl a 100 mg de tecido).
- Homogeneizados rodada por 5 minutos a 3.000 g (4 ° C). Remova cuidadosamente sobrenadante clarificado e alíquotas loja de extractos a -80 ° C até o uso.
- Determinar a concentração de proteína total (mg / mL) para homogenatos esclareceu usando um ácido bicinchoninic (BCA) de ensaio, de acordo com as instruções do fabricante (ThermoFisher).
Parte 2: SDS-PAGE Preparação da amostra
- Com um 10 bem, 10-20% tricine gel (Invitrogen), o volume máximo que pode ser carregado por poço é de aproximadamente 25μl. Volume total inclui tampão de amostra 2x SDS e agente redutor de 10x, de modo que o volume máximo de homogenato esclareceu que pode ser carregado por bem é 10μl. Esclareceu 20% (w / v) homogeneizados cortical deve ter uma concentração de proteína total superior a 5 mg / mL, permitindo a proteína total 50μg por poço. Amostras com menos de 5mg/ml proteína exigirá carregar menos proteína total por bem. No entanto, os níveis de proteína são ideais para a detecção de Aâ monomérica e agregados (50-60μg de proteína total é o ideal).
Sempre carregue a mesma quantidade de proteína total por poço. - Para cada gel, carregar pelo menos um bem com 10μl de um marcador de peso molecular, tais como SeeBlue Plus2 (Invitrogen). Como um controle positivo, corrida de 10 100ng de Aβ40 sintéticos ou Aβ42 peptídeo (diluído em 1xPBS) em outro poço.
- Prepare misturas de reação sobre o gelo, usando recém-descongelado, homogeneizados esclarecidas. Tubos de vórtice por 5-10 segundos, o calor em banho seco a 100 ° C por 5 minutos, em seguida, gire rapidamente todas as amostras para remover a condensação na tampa.
Parte 3: SDS-PAGE de eletroforese em gel
- Carregar amostras agitadas em um gel tricine 10-20% na Gelbox XCell Bloqueio Celular Mini-Sure, usando tricine tampão SDS execução, de acordo com as instruções do fabricante (Invitrogen),
- Executar gel a uma tensão constante de 125V por cerca de 90 minutos. Vamos executar amostras até que a banda marcador 4KDa é de cerca de 1 cm do fundo do gel.
Parte 4: Proteínas de Transferência Géis para Membranas
- Remova cuidadosamente géis de caixa de plástico e montar o sanduíche de transferência dentro do Módulo II XCell Blot, de acordo com as instruções do fabricante (Invitrogen). Pré-molhada blotting almofadas e membranas de nitrocelulose com tampão de transferência de 0,2 Hm Tris-Glicina (20% metanol), e retire as bolhas de almofadas blotting ou o sanduíche de papel / filtro de membrana.
- No Gelbox XCell, encha a câmara interna com tampão de transferência e encha a câmara externa com DIH 2 O (exposição ao metanol pode desgastar o plástico gelbox ao longo do tempo).
- Executar a transferência por 2-3 horas em uma amperagem constante de 25mA.
- Quando a transferência estiver completa, desconstruir o sanduíche e coloque o gel em DIH 2 O e as membranas em 1xPBS, tanto em pratos de plástico quadrado petri (ou outro recipiente adequado).
- Para visualizar a eficiência da transferência de proteína, gel pode ser marcadas com SafeStain Simply Blue (Invitrogen), e as membranas com mancha vermelha Ponceau S (Sigma Aldrich), ambos de acordo com as instruções do fabricante. Esta coloração não irá interferir com immunoblotting. Se a coloração revela ineficiente transferência de proteína, modificar o tempo de transferência na Etapa 3.
Parte 5. Antígeno-epítopo de recuperação e Immunoblotting
- Recuperação antigênica é um passo importante para revelar a epítopos Aâ na membrana para a ligação de anticorpos durante immunoblotting. Qualquer vapor, microondas ou banho de água que mantém uma temperatura constante de 100 ° C será suficiente. Para recuperação antigênica em um navio a vapor, calor selar a membrana em uma bolsa de plástico resistente Kapak preenchido com 1xPBS, à temperatura ambiente. Lay a bolsa apartamento em um navio a vapor pré-aquecido, uma vez que a bolsa começa a se expandir, incubar por mais 15 minutos. Permitir que a membrana para esfriar lentamente antes de removê-lo da bolsa, para evitar enrugamento excessivo.
- À temperatura ambiente, remova cuidadosamente a membrana da bolsa vapor e enxaguar a membrana por 5 minutos em 1xPBS, seguido de um enxágüe de 5 minutos em TBS-T (Tris-Buffered pH, solução salina 8,0 com 0,05% Tween-20 [Sigma] ), em um agitador orbital. Incubar a membrana em solução de bloqueio (leite desnatado 2,5% em TBS-T) por uma hora, agitando. Sem enxaguar, transferência de membrana para um prato ou bolsa de plástico contendo o anticorpo primário diluído em solução de bloqueio (6E10 em 1:1.000 [1μg/ml] 1:5.000 [0.2μg/ml] diluição, Covance) bolha, evitandos. Incubar no agitador orbital em temperatura ambiente por uma hora e depois de 24-48 horas sacudindo a 4 ° C (mais de incubação pode dar um melhor sinal).
- Lavar a membrana por 30 minutos em TBS-T (uma rápida lavagem seguido por 3 x 10 lavagens minuto).
- Incubar a membrana no HRP-conjugado anticorpo secundário (Amersham ECL ovelhas anti-mouse, GE Healthcare), diluído 1:10000 em solução de bloqueio, por 90 minutos no agitador à temperatura ambiente.
- Lavar a membrana por 30 minutos em TBS-T (uma rápida lavagem seguido por 3 x 10 lavagens minuto).
- No agitador, incubar a membrana em recém-made SuperSignal reagente eletroquimioluminescência Pico West (ThermoFisher) por 5 minutos, limpe o excesso de reagente em papel que não solte fiapos do filtro e colocar a membrana em um cassete de filme, entre protetores da folha de plástico. Seque o reagente SuperSignal adicionais com poeira Kimwipes se necessário.
- Expor a Kodak filme MR Biomax para intervalos de 30 segundos até 30 minutos e se desenvolver em um desenvolvedor de filme. Após 5 minutos, as faixas de monômero Aâ provavelmente será saturada.
- Membranas pode ser despojado (após lavagem em TBS-T) por agitação em Restore Plus stripping tampão por 30 minutos em temperatura ambiente e reprobed com anticorpos adicionais se desejar.
Parte 6: Representante Immunoblot:
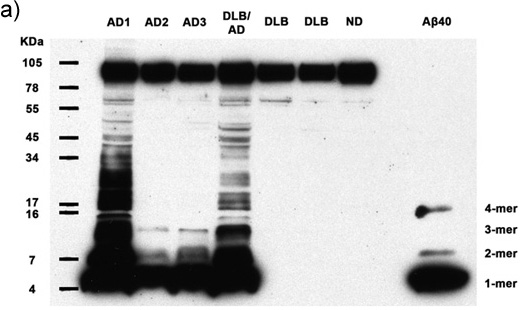


Figuras 1a-c. Homogeneizados Esclarecido contendo 50μg de proteína total de 7 seres humanos são analisados para a presença de Aâ multimérica e APP. Immunoblotting com anticorpo 6E10 revela Aâ monômeros, dímeros, trímeros, tetrâmeros e APP (faixa superior) em todos os casos de Alzheimer, bem como abundantes maior multímeros de peso molecular Aâ em 2 casos AD. Sintéticos Aβ40 confirma a identidade do menor bandas de peso molecular. AD: doença de Alzheimer, DLB: demência com corpos de Lewy, ND: Nondemented humano (a) exposição do filme de 30 minutos, (b) a exposição de filmes de 5 minutos, (c) 30 a exposição segundo filme..
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Apesar da importância da agregação Aâ na patogênese da doença de Alzheimer 1,4,5, poucos estudos têm descrito ou quantificado a distribuição de diversos multímeros Aâ humana em amostras de tecido cortical 2. Comumente usado técnicas de imunohistoquímica não permitem a discriminação de distintas espécies Aâ multimérica no tecido cortical fixo. Em unfixed homogeneizados de tecido cortical, multímeros Aâ podem ser separados e bioquimicamente avaliada através de eletroforese em gel e métodos baseados em anticorpos de detecção. Entretanto, os epítopos Aâ que são direcionados podem ser escondidas dentro agregados e pós-traducionalmente modificada estruturas peptídicas, impedindo a detecção e quantificação precisa dos Aâ agregados. Usando induzidas pelo calor recuperação antigênica epítopo combinado com SDS-PAGE e immunoblotting com um anticorpo para a região N-terminal de Aâ 6,7, somos capazes de separar e detectar que ocorrem naturalmente multímeros Aâ isolado de cérebros humanos. Distintas populações multimer Aâ dos homogeneizados de tecido esclareceu pode então ser quantificado por densitometria. Além disso, a combinação de gel ou membrana de extração com Aâ immunoblotting permitirá a caracterização estrutural de mais natural, pós-traducionalmente modificada multímeros Aâ a partir de tecido humano. Será importante para determinar se multímeros Aâ no cérebro humano são SDS-resistentes, ou se eles são SDS-sensíveis e, portanto, dividido em agregados menores por SDS desnaturação sob condições definidas. A caracterização de diversas formas de Aâ agregados no cérebro humano vai facilitar a busca de terapias e biomarcadores para a doença de Alzheimer.
Subscription Required. Please recommend JoVE to your librarian.
Acknowledgments
Muito obrigado a Elaine Pranski e Suwyn Carolyn para assistência técnica excelente e Harry LeVine III, Paul M. Murphy, e Marla Orientar para conversas importantes. O financiamento foi fornecido pela RR-00165, PO1AG026423, P50AG025688, AG030539, a Fundação Woodruff e da Emory University Research Committee.
Materials
| Name | Company | Catalog Number | Comments |
| Complete Protease Inhibitor Cocktail Tablets | Santa Cruz Biotechnology, Inc. | Sc-29130 | 1 tablet in 25ml buffer |
| BCA Protein Assay kit | Thermo Fisher Scientific, Inc. | 23225 | |
| XCell SureLock Mini-Cell and XCell II Blot Module Kit CE Mark | Invitrogen | EI0002 | |
| Novex Tricine SDS Sample Buffer (2X) | Invitrogen | LC1676 | |
| NuPAGE Sample Reducing Agent (10X) | Invitrogen | NP0004 | |
| SeeBlue Plus2 Pre-Stained Standard | Invitrogen | LC5925 | |
| Novex 10-20% Tricine Gel 1.0 mm, 10 well | Invitrogen | EC6625BOX | |
| Nitrocellulose membranes, 0.2 μm pore size | Invitrogen | LC2000 | |
| Novex Tricine SDS Running Buffer (10X) | Invitrogen | LC1675 | |
| Novex Tris-Glycine Transfer Buffer (25X) | Invitrogen | LC3675 | |
| SimplyBlue SafeStain | Invitrogen | LC6060 | Will not interfere with immunostaining |
| ATX Ponceau S Red staining solution | Sigma-Aldrich | 09276 | Will not interfere with immunostaining |
| Kapak heat sealable plastic sample pouches | Fisher Scientific | 0181225AA | |
| 6E10 mouse monoclonal antibody to Aβ(1-16) | Covance | SIG-39320 | Dilute 1:1,000 up to 1:5,000 for WB |
| Tween 20 | Sigma-Aldrich | P2287 | |
| ECL Mouse IgG, HRP-Linked Whole Aβ (from sheep) | GE Healthcare | NA931-1ML | Dilute at 1:10,000 |
| SuperSignal West Pico Chemiluminescent Substrate | Thermo Fisher Scientific, Inc. | 34077 | |
| Kodak Biomax MR Film | Carestream Health | 870 1302 |
References
- Hardy, J., Selkoe, D. J. The amyloid hypothesis of Alzheimer's disease: progress and problems on the road to therapeutics. Science. 297, 353-356 (2002).
- Haass, C., Selkoe, D. J. Soluble protein oligomers in neurodegeneration: lessons from the Alzheimer's amyloid beta-peptide. Nat. Rev. Mol. Cell. Biol. 8, 101-112 (2007).
- Walker, L. C., LeVine, H. The cerebral proteopathies. Neurobiol. Aging. 21, 559-561 (2000).
- Selkoe, D. J. Aging, amyloid, and Alzheimer's disease: a perspective in honor. of Carl Cotman. Neurochem. Res. 28, 1705-1713 (2003).
- Walsh, D. M., Selkoe, D. J. Abeta oligomers - a decade of discovery. J. Neurochem. 101, 1172-1184 (2007).
- Swerdlow, P. S., Finley, D., Varshavsky, A. Enhancement of immunoblot sensitivity by heating of hydrated filters. Anal. Biochem. 156, 147-153 (1986).
- Ida, N., Hartmann, T., Pantel, J., Schröder, J., Zerfass, R., Förstl, H., Sandbrink, R., Masters, C. L., Beyreuther, K. Analysis of hetergeneous A4 peptides in human cerebrospinal fuid and blood by a newly developed sensitive Western blot assay. J. Biol. Chem. 271, 22908-22914 (1996).



