Summary
我々は明らかに人間の皮質ホモジネート、SDS - PAGEによるタンパク質の分離、抗原の検索とAβペプチドに対する抗体でイムノブロットを調製するためのテクニックを説明します。このプロトコルを使用して、我々は一貫してアルツハイマー病の病理と人間からの皮質組織で単量体と多量体Aβを検出する。
Abstract
β-アミロイドの異常折り畳み及び重合(Aβ)ペプチドは、アルツハイマー病の発症の神経変性カスケードを開始すると考えられている
Protocol
パート1:明確に組織ホモジネートの調製
- 約30にも乳棒ストローク(すなわち400μlのバッファを追加すると - (プラス2倍プロテアーゼ阻害剤カクテル[サンタクルス] [およびMg + + -遊離Ca + +] 0.1Mリン酸緩衝生理食塩水)の氷冷緩衝液の4倍のボリュームで固定されていない皮質組織をホモジナイズダウンス100mgの組織への)。
- 3000グラム(4℃)で5分間ホモジェネートを回転させる。慎重に-80明確上澄み液と、これらの抽出物のストアアリコートを削除° Cを使用するまで。
- メーカーの指示(ThermoFisher)によると、ビシンコニン酸(BCA)アッセイを用いて明らかにホモジネートの総タンパク質濃度(μg/μl)を決定します。
パート2:SDS - PAGEのサンプル調製
- よく10、10から20パーセントトリシンゲル(Invitrogen)を用いて、ウェル毎にロードできる最大量は、〜25μlのです。総体積が2倍のSDSサンプルバッファーと10倍還元剤を含む、ウェル当たり読み込むことができる明確ホモジネートの最大量は10μlのですので。明らかに20%(w / v)の皮質ホモジネートは、ウェルあたり50μgの総蛋白質を考慮し、5μg/μLのより大きいの総タンパク質濃度を持つ必要があります。 5mg/mlのタンパク質より少ないサンプルでは、ウェルあたり少なく総タンパク質をロードする必要となります。しかし、高タンパク質レベルは、単量体および凝集したAβ(50 -60μgの総タンパク質が最適である)の検出に最適です。
常にウェルあたりの総タンパク質の同量をロードする。 - それぞれのゲルのため、負荷などSeeBlue Plus2(Invitrogen社)などの分子量マーカーの10μlを持つだけでなく少なくとも一つ。ポジティブコントロールとして、合成Aβ40または別の同様のAβ42ペプチド(1xPBSで希釈)を10 - 100ngを実行します。
- たての融解、明らかホモジネートを用いて、氷上で反応混合物を準備します。 5〜10秒間ボルテックスチューブ、100℃、乾燥槽内の熱℃で5分間、その後すぐにキャップで結露を除去するためにすべてのサンプルをスピン。
パート3:SDS - PAGEゲル電気泳動
- 、メーカーの指示(Invitrogen社)によると、トリシンSDSランニングバッファーを用いて、X細胞確かにロックミニセルGelboxで10〜20%トリシンゲル上にボルテックスのサンプルをロードする
- 約90分間125Vの定電圧で泳動する。 4KDaマーカーのバンドがゲルの下端から約1cmになるまでのサンプルが実行してみましょう。
パート4:ゲルから膜への転送タンパク質
- 慎重にメーカーの指示(Invitrogen社)によると、プラスチックケースからゲルを取り出して、X細胞IIブロットモジュール内部の転送サンドイッチを組み立てる。トリス - グリシントランスファーバッファー(20%メタノール)によるプリウェットブロッティングパッドおよび0.2μmのニトロセルロース膜、およびパッドまたはろ紙/メンブレンサンドイッチをブロッティングから気泡を取り除く。
- X細胞Gelboxでは、転送バッファで、内部チャンバーを記入し、DIH 2 O(メタノールへの暴露が時間をかけてプラスチックgelboxを身に着けることができる)と外室を埋める。
- 25mAの一定のアンペア数で2-3時間の転送を実行します。
- 転送が完了したら、サンドイッチを分解すると、両方の正方形のプラスチックペトリ皿で1xPBS、(または他の適当な容器)にDIH 2 Oと膜にゲルを置く。
- タンパク質の転送の効率を可視化するために、ゲルは単にブルーSafeStain(インビトロジェン社)で染色することができ、ポンソーSレッド染色(シグマアルドリッチ)を有する膜、両方の製造元の指示に従って。この染色は、免疫ブロット法に干渉することはありません。染色は、非効率的なタンパク質の転送があることが判明した場合は、手順3で転送時間を変更します。
第5部。抗原エピトープの検索&イムノ
- 抗原賦活化は、免疫ブロット中に抗体の結合のための膜にAβエピトープを明らかにする重要なステップです。どんな蒸し器、電子レンジ、または100の温度を一定に維持° Cで十分です水浴。蒸し器での抗原の検索の場合は、室温で、1xPBSで満たされたヘビーデューティKapakのプラスチック袋の膜を熱融着させる。あらかじめ温めておいた蒸し器のフラットポーチを置く、ポーチは、さらに15分間インキュベート、拡大して始まると。膜が過度のしわを防ぐため、袋から取り出す前に、ゆっくりと冷却してください。
- 室温で、慎重に蒸し袋からメンブレンを取り出し、5分(0.05%のTween - 20で生理食塩水、pH8.0のをTris緩衝TBS - Tで洗浄、続い1xPBSで5分間メンブレンを、すすぎ[シグマ] )、オービタルシェーカー上で。揺れ、一時間ブロッキング溶液で膜(TBS - Tで2.5%脱脂乳)をインキュベートする。洗浄せずに、泡を避け、(1:1,000で6E10 [1μg/mlの] 5,000 [0.2μg/ml]希釈、Covance)ブロッキング溶液で希釈した一次抗体を含んでいる皿やプラスチック製の袋に膜を転送S.一時間してから、4℃で振盪24〜48時間室温でオービタルシェーカー上でインキュベートする(より長いインキュベーションがより良好な信号を与えるかもしれない)。
- TBS - Tで30分間メンブレンをリンス(ワンクイック3 × 10分のリンスに続いてリンス)。
- 室温でシェーカー上で90分間ブロッキング溶液に1:10,000に希釈したHRP -標識二次抗体のメンブレン(Amersham ECLヒツジ抗マウス、GE Healthcare)を、、インキュベートする。
- TBS - Tで30分間メンブレンをリンス(ワンクイック3 × 10分のリンスに続いてリンス)。
- シェーカー上で、プラスチックシートプロテクターの間に、糸くずのろ紙上に余分な試薬をオフブロットおよびフィルムカセットにメンブレンを置き、5分間たてのSuperSignalウエストのピコの電気化学発光試薬(ThermoFisher)で膜をインキュベートする。ダストフリーキムワイプ、必要に応じて追加のSuperSignal試薬をオフに汚点。
- 最大30分30秒の間隔でコダックバイオマックスMRフィルムに感光させるとフィルムの開発者で開発する。 5分後、Aβモノマーのバンドは、おそらく飽和状態になることがあります。
- 膜は、室温で30分間の復元プラスストリッピングバッファーで振盪することによって(TBS - Tで洗浄後に)取り除かれ、必要に応じて追加の抗体で再プローブすることができます。
パート6:代表イムノブロット:
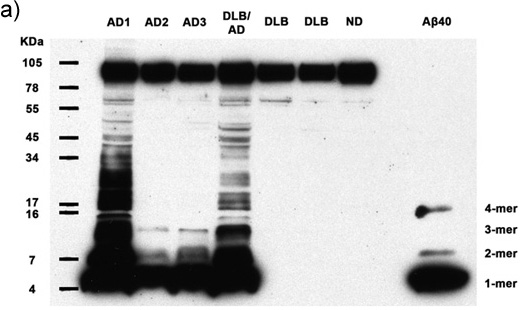


図1a - C。7ヒト被験者から50μgの総タンパク質を含む清澄ホモジネートは、多量体AβとAPPの存在について分析されています。抗体6E10でイムノブロッティングするAβモノマー、ダイマー、トリマー、テトラマー、およびすべてのアルツハイマー病のケースでAPP(上部バンド)、同様に2段のAD症例の豊富な高い分子量のAβの多量体を明らかにする。合成Aβ40は、低分子量のバンドのアイデンティティを確認する。 AD:アルツハイマー病、DLB:レビー小体型、NDと認知症:ヒトNondemented()30分のフィルム露光、(b)に 5分間のフィルム露光、(C)30秒のフィルム露光。
Subscription Required. Please recommend JoVE to your librarian.
Discussion
アルツハイマー病1,4,5の病因におけるAβ凝集の重要性にもかかわらず、いくつかの研究ではヒト皮質組織試料2に、多様なAβ多量体の分布を説明したり、定量化している。一般的に使用される免疫組織化学法は、固定皮質組織内で個別の多量Aβの種の識別のために許可されていません。固定されていない皮質組織ホモジネートでは、Aβ多量体を分離し、生化学的にゲル電気泳動と抗体ベースの検出方法を用いて評価することができる。しかし、対象とするAβエピトープを検出し、集約されたAβの正確な定量化を防止する、集約と翻訳後修飾ペプチドの構造内に隠されている場合があります。 SDS - PAGE及びAβ6,7のN末端 領域に対する抗体でイムノブロッティングと組み合わせた熱による抗原エピトープの検索を使用して、我々は分離し、自然に人間の脳から単離されたAβ多量体を発生する検出することができます。明らかに組織ホモジネート中の異なるAβ多量体の集団は、デンシトメトリーにより定量することができる。さらに、天然由来のさらなる構造特性評価を可能にするAβの免疫ブロットとゲルまたは膜抽出の組み合わせは、翻訳後にヒトの組織からAβ多量体を変更。それは人間の脳におけるAβ多量体は、SDS -耐性がある、またはそれらがSDSに敏感なため、定義された条件の下でSDS変性によって小さな集合体に分解されるかどうかどうかを判断することが重要になります。人間の脳で凝集したAβの多様な形態の特性評価は、アルツハイマー病の治療とバイオマーカーの検索を容易にするでしょう。
Subscription Required. Please recommend JoVE to your librarian.
Acknowledgments
エレインPranskiと優秀な技術支援のためのキャロラインSuwynへとハリーレヴァインIII、M.ポールマーフィー、および重要な会話のためにギアリングマーラに感謝します。資金は、RR - 00165、PO1AG026423、P50AG025688、AG030539、ウッドラフ財団、エモリー大学研究委員会によって提供されていました。
Materials
| Name | Company | Catalog Number | Comments |
| Complete Protease Inhibitor Cocktail Tablets | Santa Cruz Biotechnology, Inc. | Sc-29130 | 1 tablet in 25ml buffer |
| BCA Protein Assay kit | Thermo Fisher Scientific, Inc. | 23225 | |
| XCell SureLock Mini-Cell and XCell II Blot Module Kit CE Mark | Invitrogen | EI0002 | |
| Novex Tricine SDS Sample Buffer (2X) | Invitrogen | LC1676 | |
| NuPAGE Sample Reducing Agent (10X) | Invitrogen | NP0004 | |
| SeeBlue Plus2 Pre-Stained Standard | Invitrogen | LC5925 | |
| Novex 10-20% Tricine Gel 1.0 mm, 10 well | Invitrogen | EC6625BOX | |
| Nitrocellulose membranes, 0.2 μm pore size | Invitrogen | LC2000 | |
| Novex Tricine SDS Running Buffer (10X) | Invitrogen | LC1675 | |
| Novex Tris-Glycine Transfer Buffer (25X) | Invitrogen | LC3675 | |
| SimplyBlue SafeStain | Invitrogen | LC6060 | Will not interfere with immunostaining |
| ATX Ponceau S Red staining solution | Sigma-Aldrich | 09276 | Will not interfere with immunostaining |
| Kapak heat sealable plastic sample pouches | Fisher Scientific | 0181225AA | |
| 6E10 mouse monoclonal antibody to Aβ(1-16) | Covance | SIG-39320 | Dilute 1:1,000 up to 1:5,000 for WB |
| Tween 20 | Sigma-Aldrich | P2287 | |
| ECL Mouse IgG, HRP-Linked Whole Aβ (from sheep) | GE Healthcare | NA931-1ML | Dilute at 1:10,000 |
| SuperSignal West Pico Chemiluminescent Substrate | Thermo Fisher Scientific, Inc. | 34077 | |
| Kodak Biomax MR Film | Carestream Health | 870 1302 |
References
- Hardy, J., Selkoe, D. J. The amyloid hypothesis of Alzheimer's disease: progress and problems on the road to therapeutics. Science. 297, 353-356 (2002).
- Haass, C., Selkoe, D. J. Soluble protein oligomers in neurodegeneration: lessons from the Alzheimer's amyloid beta-peptide. Nat. Rev. Mol. Cell. Biol. 8, 101-112 (2007).
- Walker, L. C., LeVine, H. The cerebral proteopathies. Neurobiol. Aging. 21, 559-561 (2000).
- Selkoe, D. J. Aging, amyloid, and Alzheimer's disease: a perspective in honor. of Carl Cotman. Neurochem. Res. 28, 1705-1713 (2003).
- Walsh, D. M., Selkoe, D. J. Abeta oligomers - a decade of discovery. J. Neurochem. 101, 1172-1184 (2007).
- Swerdlow, P. S., Finley, D., Varshavsky, A. Enhancement of immunoblot sensitivity by heating of hydrated filters. Anal. Biochem. 156, 147-153 (1986).
- Ida, N., Hartmann, T., Pantel, J., Schröder, J., Zerfass, R., Förstl, H., Sandbrink, R., Masters, C. L., Beyreuther, K. Analysis of hetergeneous A4 peptides in human cerebrospinal fuid and blood by a newly developed sensitive Western blot assay. J. Biol. Chem. 271, 22908-22914 (1996).



