Summary
포유류의 달팽이관에있는 내부 헤어 셀 리본 버렸네에서 청각 신경 섬유 dendrites에서 전체 세포 패치 - 클램프 녹음.
Abstract
내부 머리카락 세포 (IHC) 및 청각 신경 섬유 사이의 수입 성의 버렸네은 단일 리본 버렸네 1-4 postsynaptic 활동을 녹음 electrophysiologically 접근할 사이트를 제공합니다. 감각 세포의 리본 시냅스가 지속적으로 신경 전달 물질을 출시, IHC 멤브레인 잠재 5 등급 변경에 대한 응답으로 변조된되는 비율. 리본 시냅스는 여러 vesicles가 amplitudes 1, 4, 6-11 변화의 흥분성의 postsynaptic 전류 (EPSCs)을 보여주고 동시에 공개 수 있습니다 multivesicular 릴리스에 의해 작동하도록 표시되었습니다. presynaptic 리본하거나 multivesicular 자료를 기본 메커니즘의 역할은 현재 잘 이해되지 않습니다 둘 다.
IHC는 단일 리본 버렸네를 형성 끝나는 unmyelinated 하나와 함께 10-20 청각 신경 섬유, 모든 섬유 연락처 IHC에 의해 innervated 있습니다. 수입 성의 부튼스 연락 IHCs (직경 약 1 μm의)의 작은 크기가 만들어 뛰어난 시간적 해상도로 녹음이 가능합니다. 또한, 기술은 버렸네에서 전달 함수 직접이 연구 수 있도록, 동시에 사전 및 postsynaptic 세포에서 기록하도록 적용할 수 있습니다. 이 방법은 따라서 multivesicular 릴리스에서 감각 세포에있는 리본의 어려운 기능, neurotransmission의 근본적인 측면을 연구 할 수있는 수단을 제공합니다.
Protocol
1. 솔루션
- 솔루션은 사전에 준비하실 수 있습니다. 세포외 솔루션은 최대 1 개월 4 ° C에 저장할 수 있습니다. 내부 솔루션의 Aliquots는 (-20 ° C) 냉동 저장할 수 있습니다. 솔루션은 실험을 시작하기 전에 실내 온도에 있는지 확인합니다.
- 해부 솔루션 및 세포외 녹화 솔루션 (㎜) : 5.8 KCl, 144 NaCl, 0.9 MgCl 2; 1.3 CaCl 2; 0.7 아니 2 PO 4; 5.6 포도당, 10 HEPES, 1 나의 pyruvate, 산도 7.4 (NaOH), 300 mOsm. IHC 칼슘 2 + 전류 절연은 세포 솔루션 표시로 수정할 수 있습니다 : 5.8 KCl, 114 NaCl, 0.9 MgCl 2; 1.3 CaCl 2; 0.7 아니 2 PO 4; 5.6 포도당, 10 HEPES, 30 차 Club 호텔, 산도 7.4 (NaOH ); 300 mOsm.
- 1-2 μm의의 테트로도톡신 (TTX)는 전압 게이 티드 나트륨 채널을 차단하고 흥분성의 postsynaptic 전류 또는 잠재력을 (EPSCs 또는 EPSPs) 분리 세포 솔루션에 추가할 수 있습니다.
- 세포내 녹화 솔루션 (㎜) : 20 KCl, 110 K - methanesulfonate, 5 MgCl 2; 0.1 CaCl 2, 5 EGTA, 5 HEPES, 5 나이 ATP, 0.3 나 2 GTP, 5 나이 phoshocreatine, 산도 7.2 (코) 290 mOsm, 또는 135 KCl, 3.5 MgCl 2; 0.1 CaCl 2, 5 EGTA, 5 HEPES, 4 나 2 ATP, 0.2 나 2 GTP, 산도 7.2 (코), 290 mOsm. IHC 칼슘 2 세포 솔루션 + 현재 격리 : 135 CsMeSO3, 13 차 Club 호텔, 3.5 MgCl 2; 2.5 나 2 ATP, 1 EGTA, pH는 7.2 (CsOH) 290 mOsm. 이 솔루션은 칼슘 2 떠난 + 현재 남은, 훨씬 더 큰 케이 +의 conductances의 상당 금액을 차단합니다.
2. 해부 조직을위한 홀더 만들기
- 녹음 동안의 준비를 개최하는 데 사용되는 수정 coverslips도 사전에 준비하실 수 있습니다.
- 원형 유리 coverslip (8~12mm)의 가장자리를 향해 Sylgard (다우 코닝, 미들랜드, MI)의 한 방울을 적용합니다. coverslip에 훌륭한 곤충 핀 (FST, 항목 없음 26002-10)의 두꺼운 끝을 놓으십시오. 포셉와 유리에 대한 단단히 곤충 핀을 보유하고 sylgard을 설정하는 가열 코일 근처시오.
3. 전극 만들기
- 각 실험 하루 밀폐 상자에서 저장소에 신선한 전극을 준비합니다. 각 준비 10-20 전극을 조작.
- 전극 유리를 선택, 우리는 1mm borosilicate 유리 모세관 (1B100F - 4 WPI, 사라소타, 플로리다에서)를 사용합니다.
- 약 2-3 μm의 (위에서 설명한 솔루션 MΩ ~ 6)의 팁 직경 전극을 잡아 다단계 풀러에서 프로그램을 디자인합니다. 우리는 셔터 P - 87 멀티 단계 수평 끌어당기는 또는 Narishige 수직 PC - 10 풀러를 사용합니다.
- 조심스럽게 코트는 Sylgard와 전극의 생크 가능한 한 팁을 닫습니다. 이것은 피펫의 용량을 최소화 레코딩 소음을 감소시킵니다.
- 화재 - 폴란드어 등 WPI에서 사용할 수로 가열 필라멘트와 microforge를 사용하여 전극. 소방 광택 전극은 약 1 μm의 (위에서 설명한 솔루션 MΩ 10-15)의 외부 팁 직경이 있어야합니다. 피펫 벽의 두께는 약 3분의 1 μm의 수 있습니다. 바깥 지름이 패치로 수입 성의 부통의 크기입니다.
- 동시 녹음을 구현하는 경우에는 : IHC 피펫은 화재 연마가 ~ 3 μm의 (- MΩ 8 6)의 큰 팁 직경 떠날 것을 구별과 같은 방식으로 (동일 유리, 같은 당기는 프로그램)에 건설되어야합니다.
4. 실험 설정
- 세포외 솔루션과 약물 또는 관심있는 독소를 포함하는 테스트 솔루션으로 중력 자란 재관류 시스템에 연결된 방을 채우십시오.
- 저 목욕 볼륨이 약 2 ML되도록 살포를 설정, 지속적으로 1.5 ML 분 - 1의 순서에 속도 perfuse.
- 다른 솔루션은 로컬 재관류 시스템과 실험 기간 동안 적용하는 경우, 솔루션 저수지를 입력합니다. 시스템을 통해 솔루션을 실행하고 기포가가 없다는 것을 확인하십시오.
5. 해부 및 샘플 준비
- 함께 영화는 이전 출생 후의 단계의보다 어렵습니다 3 주 된 쥐 (스프 라그 돌리, 찰스 강)에 대한 Corti의 기관의 절개를 보여줍니다. 다양한 연령대의 쥐에서 녹음의 장점과 단점은 토론에 검토하고 있습니다.
- 깊이 isoflurane 흡입하여 쥐를 마취시키다. 금단의 반사 신경은 결석하고 각막 반사가 심각하게 우울 때, 목을 베다. 이러한 절차는 존스 홉킨스 대학 동물 케어 및 사용위원회에 의해 승인되었습니다.
- 목 잘린 머리의 주둥이와 피부를 제거합니다. 머리를 이등분하고 시간적 뼈를 노출 두뇌를 제거합니다.
- 표준 세포외 용액을 포함한 청소 해부 요리 관자놀이 뼈 및 장소를 모두 제거합니다.
- 삭제달팽이관을 노출을 줄 수있는만큼 뼈를은 시간적 뼈가 캡슐. 포셉 한 쌍의와 기지에 안전하게 측두 골의 잡아. 원형과 타원형 창을 확인합니다. 난원 창과 달팽이관의 얼굴 위쪽으로 나선형의 측면과이 달팽이관 주위에 여분의 뼈를 제거되도록 달팽이관를 동쪽을 향하게하다.
- 실험을 위해 사용됩니다 혀끝의 코일을 보호하기 위해 간병, 감각 상피를 노출하는 달팽이관을 캡슐 뼈를 제거합니다. 뼈의 나머지 부분보다 더 투명 영역으로 시작, 달팽이관에서 직접 뼈 칩을 미세 포셉의 두 번째 쌍을 사용합니다. 여기 뼈가 얇고하고 제거하는 것이 더 쉽습니다. 혀끝의 코일 주위의 뼈를 제거 계속합니다.
- 혀끝의 설정 아래 modiolus 잘리는 마이크로 해부 가위를 사용합니다. 다음 달팽이관의 낮은 전환에서 혀끝의 설정을 분리합니다.
- 혀끝의 회전이 완전히 절단되도록하기 위해 필요한 경우, 다시 마이크로 해부 가위를 사용합니다. 혀끝의 코일을 보호하기 위해 부탁해, 그것은 뽑았거나 늘어해서는 안됩니다. 달팽이관의 나머지 부분에서 혀끝의 차례를 동축 케이블로 미세 집게를 사용하십시오.
- 혀끝의 회전 양쪽에서 뼈의 나머지 부분을 제거합니다.
- 조심스럽게 자국 vascularis, 헤어 셀 영역 (도식 1) 외부에 위치하고 조직의 반짝 이는 스트립을 제거합니다. 쉽게 자국의 vascularis와 함께 분리 될 수있는 감각 세포를 제거하지 않도록해야합니다.
- tectorial 멤브레인, 감각 세포 위에 앉아 반짝 이는, 반투명 막을 분리 미세 집게를 사용하십시오.
- 이제 초과 조직과 뼈가 트림 및 포셉과 준비를 평평하게. 이것은 조직이 핀 아래에 균등하게 배치 수 있도록, 필요합니다.
- 멀리 세포에서 핀 위치를 돌보는 coverslip (이전 준비)에 연결된 핀을 아래 준비를 놓습니다.
- 기록 챔버로 coverslip을 전송 집게를 사용하십시오. 달팽이 조직이 완전히 coverslip을 전송 반면 세포외 용액 한 방울로 덮여 있는지 확인합니다. 그것이 녹음 중에 이동하지 않도록하기 위해 챔버의 유리 바닥 위에 단단히 coverslip을 누르십시오.
- 즉시 준비 더 나은 생존을 보장하기 위해, 세포 솔루션 재관류를 시작합니다.
6. 녹음
- 10X와 40x 물 침지 DIC 목표를 사용하여 현미경 eyepieces을 통해 준비를 찾습니다. 기록 전극은 IHC의 측면 벽에 orthogonally IHCs 접근할 수 있도록 준비를 동쪽을 향하게하다.
- 준비가 IHCs의 기초 영역의 가시성을 제한을 통해 모습을 드러냅니다 경우, IHCs 자신을 눌러 피하기 위해 간병, 유리 coverslip에 대한 아래 준비의 바깥쪽 가장자리를 밀어 기록 전극을 사용합니다.
- *이 단계에서, 어린 쥐를 사용하여 세포 이상의 세포를 지원 두꺼운 층이 감각 세포 1, 12 액세스할 세척 피펫 (~ 10-20 μm의의 팁 직경)로 제거할 수있다면.
- 조직 건강 여부를 평가하기 위해 모니터를 사용하십시오. 현미경과 NC70 Newvicon 카메라 사이 4X 배율 렌즈를 사용하면 추가로 이미지와 프로젝트를 모니터에 4800에 대한 μm의 2 영역을 확대. 세포는 그대로 머리를 번들로 길쭉한해야합니다. 조직이 일이요 때, 세포가 팽창보다 투명하고 입자됩니다.
- IHCs의 기지 주변 도입 성의 부튼스을 집중하다. 부튼스은 직경 약 1 μm의 구형 또는 ellipsoidal하고 반짝 이는 외관과 색상에서 밝은 있습니다. 부튼스의 대부분은 핵의 수준 아래의 언어입니다. 조직은 건강하지 못한 부튼스가 아니라 반짝보다 약 4 배 정상적인 크기로 팽창하고 투명한 될 때.
- 세포내 솔루션으로 기록 전극을 채우기, 긍정적인 압력을 적용하고 준비하는 책략 전극에 micromanipulator를 사용합니다.
- 전극과 IHC 기지의 수준에서 준비를 절개합니다. IHCs의 기지에있는 영역에 액세스 경로를 위조하는 긍정적인 압력을 사용하여, 세포 및 IHCs 지원의 얇은 층 사이의 전극을 누르십시오. 이 단계는 도입 성의 부통에 도달하고 단단히 ensheath 수입 성의 엔딩 세포를 지원에서 기록되지 않습니다에 대해 "핵심"입니다.
- 조심스럽게 전극을 제거하고 신선한 가득 전극과 바꿉니다.
- IHC의 멤브레인에 액세스 구멍을 통해 깨끗한 전극 팁, 책략 전극을 유지하기 위해 긍정적인 압력을 사용합니다. 긍정적인 압력이 IHCs을 둘러싼 지원 세포 주위에 이동을 지원합니다.
- 로 함께 영화에 표시된 수입 성의 부통 (방향 인접지지 세포 주위에 전극을 이동합니다. 다른 접근 방법이 이동하여 수입 성의 부통에 접근하는 것입니다오래 IHC 막의 전극 끝까지) 부통를 감동. 전극 팁이 (부통과 피펫에 긍정적인 압력에 의한 전극 사이에 작은 차이가 여전히있다) 수입 성의 부통 바로 앞에 있는지 확인하십시오. 부튼스은지지 세포와 IHC 막보다 피펫의 움직임에 더 많은 저항을 제공하고, 그들은 실험자의 "느낌"가 될 수 있습니다.
- 아래 피펫과 이동 그리고 부통 이동하도록 밀어. 이것은 피펫 팁 및 부통 같은 Z - 비행기에 나타냅니다.
- 수입 성의 부통에 대한 누르면 전극으로 동시에 긍정적인 압력을 해제하고 GΩ 인감을 형성 흡입을 적용합니다. 수입 성의 부통에 GΩ 인감의 형성은 머리카락 세포에 그것과 비슷합니다. 인감 형성이 빠른가 될 수도 있고 아니면 천천히 발생할 수 있습니다.
- 전극 내에서 파열 막에 흡입의 부드러운 파열을 적용하고 전체 세포 녹화 설정을 입력합니다.
- 패치 세포가 도입 성의 부통 경우, 작은 capacitative 과도는 (그림 1 참조) 인감 형성하는 동안 모니터링 테스트 스퀘어 펄스에 나타납니다. 1.8 PF (3 참조 4) - 우리는 0.4로 도입 성의 결말의 용량을 예상했습니다. 패치 세포가 IHC 경우, 과도 액세스 저항에 따라 3-5 배 큰 순서에있을 것입니다.
- 세포가 도입 성의 부통 있는지 확인하려면, 전압 단계를 hyperpolarizing하고 depolarizing와 프로토콜을 실행합니다. 수입 성의 섬유 IHCs (수입 성의 부통를 목표로 할 때 자주 실수 패치)에 대한 현재의 전압 관계 (IVs) 각 세포 유형에 대한 특성이며, 그림 2에 표시됩니다.
- 멤브레인 가능성을 모니터링, 수입 성의 섬유, 그것은 -60에 -65 MV 주위에 일반적으로있다.
- 갓 가득 전극과 함께 13 - 세포 수입 성의 부통하지 않은 경우, 전극과 단계를 반복합니다 8 제거합니다. 각 시도에 대한 새로운 전극을 사용합니다.
- 봉인가 폐쇄되지 않도록 전압 단계를 적용하여 녹화 내내 모니터 시리즈 저항. 직렬 저항이 증가한다면, 그것은 흡입의 부드러운 펄스를 적용하거나 뒤로 약간 전극을 이동하는 도움이 될 수 있습니다. 시리즈 resistances은 약 30 MΩ 일반적입니다. 시냅스 활동을 분석하면, 우리는 MΩ 50보다 큰 시리즈 resistances와 함께 레코딩을 삭제.
- 이제 (그림 3 참조) 시냅스 활동을 기록할 수 있습니다. 어느 수입 성의 섬유 자발적인 활동을 전시하고, 또는 머리 세포는 송신기 출시를 활성화 depolarized해야합니다. 높은 칼륨 농도 (예를 들어 40 ㎜)과 세포 솔루션을 적용하면 머리 세포를 depolarize 및 트랜스 미터 출시의 속도를 종종 활성화하거나 증가합니다.
- IHCs 및 수입 성의 부튼스 2 동시 녹음의 경우 절차는 다음과 같은 방법으로 수정해야합니다 : 5 단계 1 단계를 수행하십시오. 칼슘 2에 해당 세포내 솔루션 + 현재 격리와 IHC 피펫을 입력하고 6 표시로하십시오. 에서 기록하는 IHC 가까운 "기다리고 위치"에 IHC 기록에 대한 피펫를 남겨주세요. 14 수입 성의 녹화 - 6 단계를 계속합니다. 수입 성의 피펫은 전체 세포 구성에 때 IHC 피펫를 계속합니다. 해당 IHC의 측면 벽을 향해 Manoeuvre 두 번째 피펫, 항상 긍정적인 압력을 유지. IHC는 압력에 의해 측면 벽에 들여쓰기를 표시해야하고 그것은 지원하는 세포가 그것에서 분리되는 보장해야합니다. 단계 12-13은뿐만 아니라 IHC 신청 수 있습니다. 으로 수입 성의 섬유에 비해, 14 표시, 큰 용량성 과도의 특성 IV 관계뿐만 아니라, IHC 녹음의 특징입니다. IHC로 씻어 세포 솔루션 - 일단 동시 녹음은 몇 시간 (5 분, 직렬 저항에 따라 3) 허용되어야 설립되었습니다. 이것은 큰 칼슘 2에 훨씬 더 큰 케이 +의 conductances의 증가로 인해 차단 + 전류를 발생합니다.
- 수행하기 위해서는 오히려 GΩ의 인감 만드는 것보다, 12 단계에서 세포 레코딩을 느슨한 - 날인, 수입 성의 부통에 MΩ 30 50의 느슨한 도장합니다. 이것은 긍정적인 압력을 방출하는 반면 적은 흡입을 적용하여 얻을 수 있습니다. P21 쥐를 수입 성의 부통에서 세포외 기록의 예를 들어 그림 5를 참조하십시오.
7. 트러블 슈팅
- 물개가 형성 될 수 있지만, 셀 연결에서 전체 셀 기록으로의 전환을 얻을 수없는 경우, 피펫의 내부 직경이 너무 좁은 수 있습니다.
- 꽉 물개가 형성되지 않을 경우, 내부 피펫 직경이 너무 크고 전체 부통이 전극에까지 빨려 수 있습니다.
- 모든 시냅스 이벤트가 작고 균일한 경우, 녹음이 도입 성의에 세포 수 있습니다. 긍정적인 막 잠재력에 이벤트의 반전을위한 시험; intracellularly 기록EPSCs 긍정적인 잠재력에 반대합니다.
- 시리즈 resistances은 지속적으로 높은 경우 패치 수입 성의 터미널은 전체 세포 구성에 뚫으려고 시도하기 전에 뒤로 피펫을 이동하려고 할 때. 이것은 피펫 막히는 높은 접속 저항을 방지하는 데 도움이됩니다.
- 두려움 피펫의 정확한 위치. 수입 성의에 인감을 "잃어버린"없이 높은 직렬 저항 또는 피펫 막히는을 줄이기 위해 전극을 이동 가능합니다. 동시 녹음 설립하는 동안, IHC는 대개 부통 대한 '강요'입니다. 수입 성의 피펫 위치는 적절하게 수정하실 수 있습니다.
8. 대표 결과
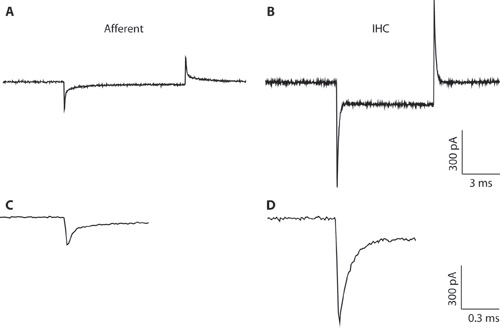
그림 1. AB. 일반 과도는 -94 뮤직 비디오의 개최 전압에서 전압 명령을 hyperpolarizing 10 뮤직 비디오에 대한 응답으로 수입 성의 섬유 (A) 및 IHC (B)에서 기록했다. 좁은 피펫 직경과 높은 접속 저항, IHC 녹음으로 인해 (B) 전체 셀 IHC 레코딩을위한 suboptimal입니다. 녹음은 IHCs 및 수입 성의 섬유에서 capacitative 과도 차이를 설명하기 위해 여기에 표시됩니다. 이것은 전체 세포 구성을 형성하면 세포 유형을 구별하는 데 도움이 될 수 있습니다. IHCs에서 전체 셀 capacitative 과도는 수입 성의 섬유에서보다 진폭 5 배 큰 순서에 있습니다. CD. A & B에서 과도는 확장 timescale에 표시됩니다. C. 수입 성의 응답의 부패 두 exponentials에 맞게 수 있습니다. 수입 성의 결말의 용량은 빠른 구성 요소에서 추정되었다.

수입 성의 부통 (A) 및 IHC (B)에서 그림 2. IV 관계. IV 관계는 -124 MV 뮤직 비디오에서 10 단위 (공칭 전압)에 + 36 MV 전압 단계 -84 뮤직 비디오의 개최 가능성에서 기록됩니다. 전압 어떤 흔적의 오른쪽에 표시됩니다. 이 음반은 상온에서 5.8 밀리미터 세포 KCl과 함께 진행되었다. 모두 규모 : 500 PA 200 MS.
19 출생 후의 하루를 도입 성의 섬유. IV 관계. EPSCs는 전압 단계의 대부분 동안 존재, EPSCs는 6 MV 긍정적인 리버스. 이 녹음은 전압 문이 나 + 전류를 차단하는 TTX의 면전에서 실시되었다. hyperpolarizing 전압 (I H)에서 천천히 안으로 전류를 활성화합니다. 이 전류는 IHCs 또는 지원 세포에 존재하지 않으며에서 기록된 세포 수입 성의 섬유 (3 참조)입니다. B 좋은 표시를 제공합니다. P19 IHC에서 IV 관계. 좁은 피펫 직경과 높은 접근 저항으로 인해, 녹음이 IHC 조류와 해류 예상보다 작은를 특성화를위한 suboptimal입니다. 녹음은 수입 성의 섬유 녹음이 시도되면 분명히 구분할 수 IHCs 및 수입 성의 섬유의 IV 관계를 보여주는 여기에 표시됩니다. 지연 정류기 K + 전류 13 다음 긍정적인 잠재력 (화살표)의 빠른 활성화 바깥쪽으로 K + 전류를합니다.

그림 3. IHC에서 릴리스의 속도를 증가 40 MM 세포외 K +를의 존재에 출생 후의 일 21 도입 성의 섬유에서 기록된 견본과 시냅스 전류. TTX가있는 방 온도, 전압 문이 나 + 전류를 차단하는 적용.. 스케일 200 PA, 5 MS는 EPSCs의 변수 크기와 모양을 확인합니다. EPSC 특성에 대한 자세한 설명 4를 참조하십시오. B는. (multiphasic, O : # monophasic)으로 표시된 두 EPSCs은 확장된 규모로 그림 : 규모 100 PA, 1 MS합니다.

그림 4. 동시 IHC의 기록 및 Corti, 출생 후의 일 10 (도 2 참조)의 excised 쥐 기관의 수입 성의 부통 문의. IHC를 depolarizing 전압 단계는 신경 전달 물질의 릴리스를 전달하고 수입 성의 부통에 EPSCs을 활성화 어퍼 추적 :. IHC의 탈분극에 대한 전압 프로토콜. 홀딩 가능성 : -79 뮤직 비디오, -29 MV 50 MS 단계 중간 추적 :. L - 타입 칼슘 2 IHC에서 기록된 + 전류는 일반적으로 약간의 불활 성화를 게재하고 부정적인 가능성에 활성화 아래 추적 :. 대응 수입 성의 섬유에 시냅틱 전류 IHC의 탈분극 수 있습니다. 50 MS IHC의 탈분극 동안 신경 우울증을 확인합니다.

그림 5. . 출생 후의 일 21 도입 성의 부통에서 견본 세포 기록. 이것은 방 온도에서 기록된5.8 MM 세포외 K +를 함께 진짜야. 이 녹음은 삼주 늙은 쥐에서 준비에서 레코딩을위한 잡음 비율 전형적인 신호를했습니다. B는. P20 수입 성의 부통에서 기록된 세포 이벤트에 대한 평균 파형. 이것은 10,272 사건에서 평균 파형이다.

개략도 1. 안쪽과 바깥쪽 세포, 나선 신경, 선 vascularis과 tectorial 막 사이의 해부 학적 관계를 설명하는 쥐 달팽이관 중 하나를 설정을 통해 단면보기를 크로스.
Discussion
이 절차의 중요한 단계는 해부이다. 조직이 늘어하거나 절개하는 동안 손상된 경우 수입 성의 섬유는 살아남지 못할 것이다. 젊은 쥐들이에서 조직은 더 탄력을 용서합니다. 우리는 출생 후의 일 10 ~ 11 해부하다하는 가장 쉬운 방법이며, 실험은 높은 성공률을 가지고 것을 발견했습니다. 달팽이 성숙의 중요한 과정은 12 14 일 출생 후의 주변의 의견을 시작 쥐와 postnatally 발생합니다. 따라서, 나이에 절개가 쉬운가 어디 있는지, 시냅스는 4 완전히 성숙되지 않을 수 있습니다.
쥐 위해 여기에서 설명한 해부는 기본적으로 마우스, 마우스 달팽이관의 작은 크기가되는 주요 차이점에 대해 동일합니다. 이 기술은 리본 시냅스의 속성이 transgenically 수정된 생쥐 15 심사 수 있습니다. 이 기법을 추가로 변경은 다음과 같습니다 라벨 섬유 3 세포내 솔루션에 형광 염료를 추가하고, presynaptic 내부 머리카락 세포와 postsynaptic 수입 성의 부통와 결합하여 녹음, 사전 및 사후 신경 세포 사이의 전달 함수가 2를 결정 수 있도록하고 느슨한 - 세포 무결성의 손실을 피하기 위해 도입 성의 부튼스에서 세포외 녹음 인감. 세포외 녹음 구성은 전체 세포 구성을보다 쉽게 얻을 수 있으며, 실험은 일반적으로 오래 지속됩니다.
Disclosures
관심 없음 충돌 선언하지 않습니다.
Acknowledgments
이 작품은 어이에 난청 연구 재단 연구 그랜트에 의해 지원 및 NIDCD DC005211에 의해 청력과 균형을위한 센터, 존스 홉킨스 대학 EG하고 DC006476을 NIDCD했다. 작품 저작권 팀 펠프스, 존스 홉킨스 대학.
LG가 초기 원고를 작성, 어이과 LG는 절개와 녹음을 촬영. 모든 저자는 표본의 수치를 제공하고 원고를 쓰기에 기여.
Materials
| Name | Company | Catalog Number | Comments |
| Air table | TMC | ||
| Gibraltar Stage with xy-table | Burleigh | ||
| Axioscope FS2 upright microscope DIC optics Green filter | Carl Zeiss, Inc. | ||
| Newvicon camera with controller | Dage | ||
| Monitor | Dage | ||
| Multiclamp 700B (or similar) | Molecular Devices | ||
| Digidata 1322A (or similar) | Molecular Devices | ||
| Manipulator MP285 | Sutter Instrument Co. | ||
| 6-channel valve application system for local perfusion (used with hand made perfusion pipettes) | Warner Instruments | ||
| PC with acquisition software (PClamp) | Molecular Devices | ||
| Above is the equipment in our electrophysiological setups used for recording from afferent terminals. | |||
References
- Glowatzki, E., Fuchs, P. A. Transmitter release at the hair cell ribbon synapse. Nat Neurosci. 5 (2), 147-154 (2002).
- Goutman, J. D., Glowatzki, E. Time course and calcium dependence of transmitter release at a single ribbon synapse. Proc Natl Acad Sci U S A. 104 (41), 16341-16346 (2007).
- Yi, E., Roux, I., Glowatzki, E. Dendritic HCN channels shape excitatory postsynaptic potentials at the inner hair cell afferent synapse in the mammalian cochlea. J Neurophysiol. 103 (5), 2532-2543 (2010).
- Grant, L., Yi, E., Glowatzki, E. Two modes of release shape the postsynaptic response at the inner hair cell ribbon synapse. J Neurosci. 30 (12), 4210-4220 (2010).
- LoGiudice, L., Matthews, G. The role of ribbons at sensory synapses. Neuroscientist. 15 (4), 380-391 (2009).
- Singer, J. H. Coordinated multivesicular release at a mammalian ribbon synapse. Nat Neurosci. 7 (8), 826-833 (2004).
- Keen, E. C., Hudspeth, A. J. Transfer characteristics of the hair cell's afferent synapse. Proc Natl Acad Sci U S A. 103 (14), 5537-5542 (2006).
- Li, G. L. The unitary event underlying multiquantal EPSCs at a hair cell's ribbon synapse. J Neurosci. 29 (23), 7558-7568 (2009).
- Singer, J. H., Diamond, J. S. Vesicle depletion and synaptic depression at a mammalian ribbon synapse. J Neurophysiol. 95 (5), 3191-3198 (2006).
- Suryanarayanan, A., Slaughter, M. M. Synaptic transmission mediated by internal calcium stores in rod photoreceptors. J Neurosci. 26 (6), 1759-1766 (2006).
- Neef, A. Probing the mechanism of exocytosis at the hair cell ribbon synapse. J Neurosci. 27 (47), 12933-12944 (2007).
- Tritsch, N. X. The origin of spontaneous activity in the developing auditory system. Nature. 450 (7166), 50-55 (2007).
- Kros, C. J., Ruppersberg, J. P. Expression of a potassium current in inner hair cells during development of hearing in mice. Nature. 394 (6690), 281-284 (1998).
- Muller, M. Developmental changes of frequency representation in the rat cochlea. Hear Res. 56 (1-2), 1-7 (1991).
- Seal, R. P. Sensorineural deafness and seizures in mice lacking vesicular glutamate transporter 3. Neuron. 57 (2), 263-275 (2008).



