Summary
Всего-клеточные патч-зажим записи из волокна слухового нерва дендритов на внутренней волосковых клеток ленты синапса в млекопитающих улитки.
Abstract
Афферентный синапс между внутренней волосковых клеток (IHC) и волокна слухового нерва обеспечивает электрофизиологически доступным сайт для записи постсинаптической активности одной лентой синапса 1-4. Лента синапсов сенсорные клетки выделяют нейромедиатор постоянно, скорость которого модулируется в ответ на изменения в градуированных IHC мембранного потенциала 5. Лента синапсов было показано, что действуют по мультивезикулярные релиз, в котором несколько пузырьков может быть выпущен одновременно вызывать возбуждающих постсинаптических токов (EPSCs) различной амплитуды 1, 4, 6-11. Ни роль пресинаптических ленты, ни механизм, лежащий мультивезикулярные выпуска в настоящее время хорошо изучены.
IHC иннервируется 10-20 слуховые нервные волокна, и каждое волокно контакты с IHC немиелинизированных один конец в единое синапса лентой. Небольшой размер афферентных boutons связавшись IHCS (около 1 мкм в диаметре) позволяет записей с исключительным временным разрешением быть сделаны. Кроме того, методика может быть адаптирована для записи как до, так и постсинаптические клетки одновременно, что позволяет функции передачи в синапсах, чтобы быть изучены непосредственно 2. Этот метод, следовательно, обеспечивает с помощью которого фундаментальные аспекты нейротрансмиссии могут быть изучены, от мультивезикулярные релиз неуловимого функции ленточку в чувствительных клеток.
Protocol
1. Решения
- Решения могут быть подготовлены заранее. Внеклеточный решения можно хранить при 4 ° С на срок до одного месяца. Аликвоты внутренний раствор можно хранить замороженными (-20 ° С). Убедитесь, что решения при комнатной температуре до начала экспериментов.
- Пройдя решение и внеклеточной решение для записи (мм): 5,8 KCl, NaCl 144; 0,9 MgCl 2, 1,3 CaCl 2; 0,7 NaH 2 PO 4, 5,6 глюкозы, 10 HEPES, 1 Na пируват, рН 7,4 (NaOH), 300 мОсм. Для IHC Са 2 + ток изоляции внеклеточной решение может быть изменено, как указано: 5,8 KCl, NaCl 114; 0,9 MgCl 2, 1,3 CaCl 2; 0,7 NaH 2 PO 4, 5,6 глюкозы, 10 HEPES, 30 ЧАЙ Cl, рН 7,4 (NaOH ), 300 мОсм.
- 1-2 мкМ тетродотоксин (TTX) могут быть добавлены к внеклеточной решение блокировать напряжения закрытого натриевые каналы и изолировать возбуждающих постсинаптических токов или потенциалов (EPSCs или ВПСП).
- Внутриклеточное решение для записи (мм): 20 KCl, 110 К-метансульфонат, 5 MgCl 2, 0,1 CaCl 2, 5 EGTA, 5 HEPES, 5 Na 2 СПС; 0,3 Na 2 ГТФ, 5 Na 2 phoshocreatine; рН 7,2 (КОН), 290 мОсм; или 135 KCl; 3,5 MgCl 2, 0,1 CaCl 2, 5 EGTA, 5 HEPES, 4 Na 2 СПС; 0,2 Na 2 ГТФ; рН 7,2 (КОН), 290 мОсм. Внутриклеточное решение для IHC Са 2 + ток изоляции: 135 CsMeSO3, 13 ЧАЙ Cl; 3,5 MgCl 2, 2,5 Na 2 СПС; 1 EGTA, рН 7,2 (CsOH); 290 мОсм. Это решение будет блокировать значительное количество значительно больше проводимости K +, оставив Са 2 + ток осталось.
2. Создание Держатели для расчлененный тканей
- Измененный покровные используется для хранения подготовки на месте во время записи может быть подготовлен заранее.
- Применять капли Sylgard (Dow Corning, Midland, MI) к краю покровного стекла круговой (8-12 мм). Место толстым концом тонкой контактный насекомых (ФСТ, арт 26002-10) на покровное. Держите насекомых контактный плотно к стеклу с щипцами и удерживать вблизи нагретой катушке установить sylgard.
3. Создание Электроды
- Подготовка электродов свежие на каждый опытный день и хранить в окна герметичны. Изготовление десяти до двадцати электроды для каждого препарата.
- Выберите стеклянный электрод, мы используем 1 мм боросиликатного стекла капилляров (1B100F-4 из WPI, Сарасоте, штат Флорида).
- Дизайн программы по многоступенчатой съемник тянуть электроды с диаметром кончика около 2-3 мкм (~ 6 МОм в растворах описано выше). Мы используем Саттер Р-87 многоступенчатый горизонтальный съемник или Narishige вертикальной PC-10 съемника.
- Тщательно пальто стержень электрода с Sylgard как можно ближе к кончику, насколько возможно. Это уменьшает емкость пипетки и минимизирует шумы записи.
- Пожар-польский электродов использованием microforge с подогревом накаливания такой, которая доступна из WPI. Пожар полированные электроды должны иметь наружный диаметр кончика около 1 мкм (10-15 МОм в растворах описано выше). Толщина стены пипетки около 1 / 3 мкм. Внешний диаметр около размер афферентных Bouton быть заделаны.
- В случае реализации одновременной записи: IHC пипетки должны быть построены в том же порядке (то же стекло, потянув же программы), с тем отличием, что огонь полировки следует оставлять большие чаевые диаметром ~ 3 мкм (6 - 8 МОм).
4. Настройка эксперимента
- Заполните камеры подключены к системе перфузии самотечных с внеклеточной решения и тестирования решений, содержащих наркотические средства или токсины, представляющих интерес.
- Установить перфузии, так что объем ванны составляет около 2 мл, постоянно заливать в размере порядка 1,5 мл мин-1.
- Если различные решения, которые будут применяться в ходе эксперимента с локальной системы перфузии, заполнить резервуары с решениями. Выполнить решения по системе и убедитесь, что Есть нет пузырьков воздуха.
5. Вскрытие и подготовка образцов
- Сопровождающих фильм иллюстрирует рассечение орган Корти в течение трех-недельных крыс (Sprague Dawley, Charles River), которая является более трудным, чем у более ранних послеродовых этапов. Преимущества и недостатки записи от крыс разного возраста рассматриваются в дискуссии.
- Глубоко анестезировать крысы по изофлуран ингаляции. При выводе рефлексы отсутствуют и роговицы рефлексы тяжелой депрессией, обезглавить. Эти процедуры были одобрены Университета Джонса Хопкинса уходу и использованию животных комитета.
- Удалить рыло и кожу от обезглавленной головы. Делить пополам голову и удалить мозг, чтобы разоблачить височных костей.
- Удалите обе височные кости и поместить в чистую рассекает блюд, содержащих стандартные внеклеточный раствор.
- Удалениекости инкапсуляции височной кости таким образом, чтобы разоблачить улитки. Держите височной кости надежно в основании с парой щипцов. Определить круглые и овальные окна. Ориентировать улитки, так что овальное окно и спирали сторону вверх улитки лицо и удалить лишнюю кость вокруг улитки.
- Удалить кости инкапсуляции улитки подвергать сенсорного эпителия, с учетом необходимости защиты апикальной катушки, которая будет использоваться для эксперимента. Используйте вторую пару тонких щипцов для чипа кости непосредственно от улитки, начиная с области, которая является более прозрачным, чем остальные кости. Здесь кости тоньше и легче удалить. Продолжить удаление кости со всего апикальной катушку.
- Использование микро-рассечение ножницами, чтобы прорваться через Modiolus под апикального оборота. Затем отсоедините апикальной свою очередь, из нижнего витков улитки.
- Использование микро-рассечение ножницами снова, если это необходимо, чтобы гарантировать, что апикальной свою очередь, полностью разорваны. Принять меры по защите апикальной катушку, она не должна быть выведены или растягивается. Используйте тонкий пинцет, чтобы уговорить апикального оборота от остальной части улитки.
- Удалить остальных костей с обеих сторон апикального оборота.
- Осторожно снимите полоски сосудистой, блестящая полоса ткани, расположенных за пределами региона волосковых клеток (Схема 1). Удостоверьтесь, чтобы избежать удаления волосковых клеток, которые легко отделяются вместе с сосудистой полоски.
- Используйте тонкий пинцет, чтобы отделить текториальной мембраны, блестящая, полупрозрачная оболочка, которая находится выше волосковых клеток.
- Теперь отделкой избыточной ткани и кости и придавить препарат с щипцами. Это необходимо, чтобы ткани могут быть размещены равномерно под штифт.
- Место препарата под штифт прилагается к покровным (подготовленные ранее), обращая внимание на позицию контактный от волосковых клеток.
- Используйте пинцет для передачи покровное к записи камеры. Обеспечить кохлеарной ткани полностью покрыт каплей внеклеточной решение в то время как передача покровное. Пресс покровное вниз твердо на стекло дна камеры, чтобы убедиться, что он не двигается во время записи.
- Немедленно начать перфузии с внеклеточной решения, для обеспечения лучшей выживаемости подготовки.
6. Запись
- Найдите подготовки через окуляры микроскопа использовании 10x и 40x целей погружением в воду ДВС. Ориентировать подготовку так, чтобы записи электродов может приблизиться IHCS перпендикулярно боковой стенке IHC.
- Если препарат закинут, ограничивая видимость базальной области IHCS, использование записи электрода подтолкнуть внешнего края подготовки вниз против стекло покровное, избегая нажатия IHCS себя.
- * При использовании молодых крыс, на этом этапе толстым слоем опорных клеток выше волосковые клетки могут быть удалены с помощью чистящей пипетки (с наконечником диаметром ~ 10-20 мкм), чтобы получить доступ к сенсорных клеток, 1, 12.
- Использование мониторинга для оценки того ткани здоровой. Использование 4-кратным увеличением между микроскопом и NC70 Newvicon камеры дальнейшего увеличивает изображение и проектов площадью около 4800 мкм 2 на мониторе. Волосы клетки должны быть удлиненные с неповрежденными пучки волос. Когда ткани ухудшается, волосковые клетки набухают и становятся более прозрачными и зернистым.
- Локализация афферентных boutons вокруг основания IHCS. Boutons сферические или эллиптические, около 1 мкм в диаметре и светлого цвета с блестящей внешностью. Большинство boutons локализуются ниже уровня ядра. Когда ткань нездорового boutons набухать приблизительно в 4 раза нормальных размеров и становятся прозрачными, а не блестящим.
- Заполните записи электрода с внутриклеточными решение, применять положительное давление и использовать микроманипулятора для маневра электрода к препарату.
- Сделайте разрез в подготовке на уровне базы IHC с электродом. Нажмите электрода между тонким слоем опорных клеток и IHCS, используя положительное давление подделать маршрут доступа в этот район на базе IHCS. Этот шаг является "ключом" для достижения афферентных Bouton и для не записи с поддержкой клеток, которые плотно ensheath афферентных окончаний.
- Осторожно выньте электрод и заменить свежей заполнены электрода.
- Использование положительного давления для поддержания чистой кончике электрода, маневр электрода через отверстие для доступа к мембране IHC. Положительное давление следует оказывать помощь в передвижении опорных клеток, окружающих IHCS.
- Перемещение электрода вокруг соседних опорных клеток, к афферентным Bouton (как показано в сопроводительной фильма. Альтернативный подход заключается в подходе афферентных Bouton, перемещаядолго мембраны IHC до кончика электрода касается Bouton). Убедитесь, что конец электрода непосредственно перед афферентных Бутон (есть еще небольшой зазор между Bouton и электродом из-за положительного давления на пипетку). Boutons предлагают больше сопротивление движению пипетки, чем опорных клеток и мембран IHC, они могут быть "чувствовал" экспериментатором.
- Перемещение пипетки вверх и вниз и нажать, чтобы убедиться, что Bouton движется. Это означает, что пипетки и Bouton находятся в том же Z-плоскости.
- С электрод прижимается афферентных Бутон, одновременно релиз положительного давления и применять всасывания сформировать ГОм печатью. Формирование ГОм печать на афферентные Bouton аналогична на волосковых клеток. Печать образование может быть быстрым или может происходить медленно.
- Применить нежная всплески всасывания к разрыву мембраны внутри электрода и введите всю конфигурацию записи клетки.
- Если ячейка является пропатчен афферентных Bouton, небольшой емкостной переходных появится на испытательного импульса квадратных контролируется во время уплотнения образованию (см. Рисунок 1). Мы оценили емкость афферентные окончания равным 0,4 - 1,8 пФ (см. 3, 4). Если ячейка является пропатчен IHC, переходные будет порядка 3-5 раза больше, в зависимости от доступа сопротивления.
- Чтобы убедиться, что ячейка афферентных Bouton, запустить протокол с гиперполяризующих и деполяризующего ступеней напряжения. Нынешние отношения напряжения (ИВС) для афферентных волокон и IHCS (часто ошибочно пропатчена при наведении на афферентные Bouton), характерные для отдельных типов клеток и показаны на рисунке 2.
- Монитор мембранного потенциала, ибо афферентные волокна, оно обычно составляет около -60 до -65 мВ.
- Если ячейка не афферентных Bouton, удаление электрода и повторите шаги 8 - 13 с только что заполненный электрода. Использование новых электродов для каждой попытки.
- Монитор последовательное сопротивление всей записи, применив напряжения шаги для обеспечения того, чтобы уплотнение не закрывает вверх. Если последовательное сопротивление увеличивается, это может быть полезно применять нежные импульсы всасывания или для перемещения электрода назад чуть-чуть. Серия сопротивления, как правило, около 30 МОм. При анализе синаптической активности, мы отбросим записи с последовательным сопротивлением более 50 МОм.
- Теперь вы можете записывать синаптической активности (см. Рисунок 3). Либо афферентные волокна экспонатов спонтанной активности, или волосковых клеток необходимо деполяризованного активировать передатчик релизе. Применение внеклеточного раствора с более высокой концентрации калия (например, 40 мМ) будет деполяризовать волосковых клеток и часто активировать или увеличить скорость передатчика релизе.
- Для одновременной записи IHCS и афферентных boutons 2, процедура должна быть изменена следующим образом: Выполните шаги с 1 по 5. Заполните IHC пипетки с соответствующим решением для внутриклеточного Са 2 + ток изоляции и следить, как указано в 6. Оставьте пипетки для IHC записи в "выжидательную позицию" близко к IHC быть записан с. Продолжайте шаги 6 - 14 для афферентных записи. Когда афферентные пипетки в целом конфигурации клетки продолжить IHC пипетки. Маневр второй пипетки к боковой стенке соответствующего IHC, всегда поддержание положительного давления. IHC должен показать углубление на боковой стене при помощи давления и оно должно быть обеспечено, чтобы поддерживающие клетки отделяются от него. Шаги 12 - 13 могут быть использованы для IHC, а также. Как указано в 14, по сравнению с афферентными волокнами, большие емкостные переходные процессы признаком записи IHC, в дополнение к характерным отношению IV. После одновременной записи создаются, какое-то время должно быть разрешено (3 - 5 мин, в зависимости от последовательное сопротивление) для внутриклеточных решения мыть в IHC. Это приведет к большей Са 2 + токи из-за увеличения блока значительно больше проводимости K +.
- Для того, чтобы выполнять свободную печать внеклеточной записей, на шаге 12, вместо того, чтобы печать ГОм, сделать свободную печать от 30 до 50 МОм на афферентные Bouton. Это может быть достигнуто путем применения менее всасывания в то время как выпуск положительным давлением. На рисунке 5 примере внеклеточной записи с P21 крысы афферентных Bouton.
7. Устранение неисправностей
- Если пломбы могут быть сформированы, но переход от клеточного придается все записи клетка не может быть достигнуто, внутренний диаметр пипетки может быть слишком узким.
- Если уплотнения не может быть сформирован, внутренний диаметр пипетки может быть слишком большой, и весь Bouton может выбрасываться в электроде.
- Если все синаптических событий малого и форме, запись может быть внеклеточной на афферентные. Тест для разворота событий на позитивный потенциал мембраны; внутриклеточно записаныEPSCs будут уменьшаться при положительных потенциалах.
- Если ряд сопротивлений неизменно высоким при обновлении афферентных терминалов, попробуйте перейти пипетку назад, прежде чем пытаться прорваться в целом конфигурация клетки. Это помогает предотвратить засорение пипетки и высокой стойкостью доступа.
- Правильное положение пипетки бесстрашно. Можно перемещать электрод к снижению высокого сопротивления серии или пипетки засорения без "потери" печать на афферентные. При одновременном создании записи, IHC, как правило, «толкнул» на Бутона. Афферентного позиции пипетки можно исправить соответствующим образом.
8. Представитель Результаты
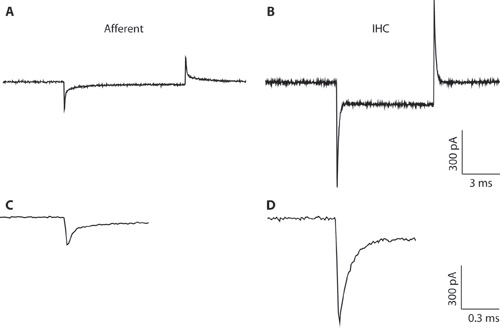
Рисунок 1. AB. Типичные переходных записан с афферентных волокон () и IHC (B) в ответ на 10 мВ гиперполяризующих напряжения команду из холдинга напряжение -94 мВ. Из-за узкого диаметра пипетки и высокой стойкостью доступа, записи IHC (В) неоптимальный для всей записи ячейки IHC. Записи показан здесь лишь для иллюстрации разницы между емкостной переходных от IHCS и афферентных волокон. Это может помочь различать типы клеток при формировании цельноклеточная конфигурации. Всего-клеточные емкостной переходных от IHCS находятся на порядка 5 раз больше по амплитуде, чем те, от афферентных волокон. Компакт-диска. Переходные от & B показано на расширила сроки. С распадом афферентных ответ может быть в форме с двумя экспонентами. Емкость афферентные окончания оценивалась по быстрой компоненты.

Рисунок 2. IV отношениях от афферентных Бутон () и IHC (B). IV отношения отражаются от проведения потенциал -84 мВ напряжение шагах от -124 мВ до + 36 мВ 10 мВ шагом (номинальное напряжение). Напряжения приведены справа какие-то следы. Эти записи были проведены с 5,8 мМ KCl внеклеточной при комнатной температуре. Шкала для обоих: 500 мкА, 200 мс.
. IV отношениях от афферентного волокна в послеродовой день 19. EPSCs присутствуют в большинстве ступеней напряжения; EPSCs обратный положительный до +6 мВ. Эта запись была проведена в присутствии ТТХ блокировать напряжения закрытого Na + токов. Обратите внимание, медленно активации внутрь ток при напряжении гиперполяризующих (я ч). Этот ток нет в IHCS или опорных клеток и обеспечивает хороший признак, что клетка является записанные с афферентного волокна (см. пункт 3). B. IV отношениях от P19 IHC. Из-за узкого диаметра пипетки и высокой стойкостью доступа, запись неоптимальных для характеристики IHC токи и токи меньше, чем ожидалось. Записи показан здесь только для демонстрации IV отношения IHCS и афферентные волокна могут быть четко отделены, когда афферентные волокна записи покушение. Обратите внимание, быстрая активация наружу K + токов при положительных потенциалах (стрелка) с последующей задержкой выпрямитель K + токов 13.

Рисунок 3. Воплощением синаптических токов записан с афферентного волокна на 21-й день послеродового в присутствии 40 мМ внеклеточный + K, чтобы увеличить скорость освобождения из IHC. Температура в помещении, с ТТХ применяемых для блокирования напряжения закрытого Na + токов.. Шкала 200 мкА, 5 мс, обратите внимание, переменный размер и форму EPSCs. Для подробного описания характеристик EPSC см. 4. B. Два EPSCs отмечается в (#: мультифазные, о: монофазные), показанные в расширенном масштабе: Масштаб 100 Па, 1 мс.

Рисунок 4. Одновременная запись IHC и связаться афферентных Bouton в вырезали крысы кортиева органа, послеродовой день 10 (также см. пункт 2). Напряжение шага деполяризующего IHC провоцирует освобождение нейромедиаторов и активирует EPSCs в афферентных Bouton Верхний след. Напряжение протокол для деполяризации IHC. Холдинг потенциал: -79 мВ, 50 мс шаг до -29 мВ Ближнем след. L-типа Ca 2 + токи записан с IHC обычно не проявляют большого инактивации и активировать при отрицательных потенциалах Нижний след. Synaptic токов в афферентные волокна в ответ к деполяризации IHC. Обратите внимание, синаптической депрессии во время деполяризации 50 мс IHC.

Рисунок 5. . Воплощением внеклеточной записи с афферентными Bouton в послеродовом 21 день. Это был записан при комнатной температуретуры, с 5,8 мм внеклеточного К +. Эта запись имеет типичный сигнал-шум для записи в подготовке от трех недель старая крыса. B. Средняя сигнала для внеклеточных события, записанные от P20 афферентных Bouton. Это средняя сигнала от 10272 событий.

Схема 1. Поперечное сечение через один оборот крысы улитки иллюстрирующий анатомическое соотношение между внутренним и внешним волосковых клеток, спирально ганглиев, полоски сосудистой и текториальной мембраны.
Discussion
Важным шагом в этой процедуре вскрытия. Если ткань растягивается или повреждены во время вскрытия, афферентные волокна не выживет. Ткани от младших крыс более упругой и прощать. Мы считаем, что день после рождения от 10 до 11 проще всего анализировать и эксперименты имеют более высокий уровень успеха. Значительная степень кохлеарной созревания происходит после рождения, с крысами начинают слышать со всего послеродового день 12 14. Таким образом, в эпоху, когда вскрытие легче, синапсы могут быть не полностью зрелые 4.
Рассечение, описанные здесь для крыс, по существу, то же самое для мышей, главного отличия: меньший размер улитки мыши. Эта техника позволяет свойства ленты синапсов должны быть рассмотрены в transgenically модифицированных мышей 15. Дальнейшие модификации данного метода относятся: добавление флуоресцентного красителя для внутриклеточных решение маркировать волокна 3; парных записей с пресинаптической внутренней клетки волос и постсинаптических афферентных Bouton, позволяя передаточной функции между пре-и пост синаптических клетки, которые будут определены 2 и свободную печать внеклеточной записи на афферентные boutons, чтобы избежать потери сотовых целостности. Внеклеточной конфигурации запись легче достичь, чем цельноклеточная конфигурации и эксперименты, как правило, более прочный.
Disclosures
Нет конфликта интересов объявлены.
Acknowledgments
Эта работа была поддержана Глухота исследовательский фонд исследовательских грантов для Е.Я. и NIDCD DC006476 Е. Г. и NIDCD DC005211 в Центр слуха и равновесия, Университет Джона Хопкинса. Работа авторского права Тим Фелпс, Университет Джона Хопкинса.
LG написал начальные рукописи; Е.Я. и LG снято вскрытие и записи. Все авторы, при условии, образцом цифры и внес вклад в написание статьи.
Materials
| Name | Company | Catalog Number | Comments |
| Air table | TMC | ||
| Gibraltar Stage with xy-table | Burleigh | ||
| Axioscope FS2 upright microscope DIC optics Green filter | Carl Zeiss, Inc. | ||
| Newvicon camera with controller | Dage | ||
| Monitor | Dage | ||
| Multiclamp 700B (or similar) | Molecular Devices | ||
| Digidata 1322A (or similar) | Molecular Devices | ||
| Manipulator MP285 | Sutter Instrument Co. | ||
| 6-channel valve application system for local perfusion (used with hand made perfusion pipettes) | Warner Instruments | ||
| PC with acquisition software (PClamp) | Molecular Devices | ||
| Above is the equipment in our electrophysiological setups used for recording from afferent terminals. | |||
References
- Glowatzki, E., Fuchs, P. A. Transmitter release at the hair cell ribbon synapse. Nat Neurosci. 5 (2), 147-154 (2002).
- Goutman, J. D., Glowatzki, E. Time course and calcium dependence of transmitter release at a single ribbon synapse. Proc Natl Acad Sci U S A. 104 (41), 16341-16346 (2007).
- Yi, E., Roux, I., Glowatzki, E. Dendritic HCN channels shape excitatory postsynaptic potentials at the inner hair cell afferent synapse in the mammalian cochlea. J Neurophysiol. 103 (5), 2532-2543 (2010).
- Grant, L., Yi, E., Glowatzki, E. Two modes of release shape the postsynaptic response at the inner hair cell ribbon synapse. J Neurosci. 30 (12), 4210-4220 (2010).
- LoGiudice, L., Matthews, G. The role of ribbons at sensory synapses. Neuroscientist. 15 (4), 380-391 (2009).
- Singer, J. H. Coordinated multivesicular release at a mammalian ribbon synapse. Nat Neurosci. 7 (8), 826-833 (2004).
- Keen, E. C., Hudspeth, A. J. Transfer characteristics of the hair cell's afferent synapse. Proc Natl Acad Sci U S A. 103 (14), 5537-5542 (2006).
- Li, G. L. The unitary event underlying multiquantal EPSCs at a hair cell's ribbon synapse. J Neurosci. 29 (23), 7558-7568 (2009).
- Singer, J. H., Diamond, J. S. Vesicle depletion and synaptic depression at a mammalian ribbon synapse. J Neurophysiol. 95 (5), 3191-3198 (2006).
- Suryanarayanan, A., Slaughter, M. M. Synaptic transmission mediated by internal calcium stores in rod photoreceptors. J Neurosci. 26 (6), 1759-1766 (2006).
- Neef, A. Probing the mechanism of exocytosis at the hair cell ribbon synapse. J Neurosci. 27 (47), 12933-12944 (2007).
- Tritsch, N. X. The origin of spontaneous activity in the developing auditory system. Nature. 450 (7166), 50-55 (2007).
- Kros, C. J., Ruppersberg, J. P. Expression of a potassium current in inner hair cells during development of hearing in mice. Nature. 394 (6690), 281-284 (1998).
- Muller, M. Developmental changes of frequency representation in the rat cochlea. Hear Res. 56 (1-2), 1-7 (1991).
- Seal, R. P. Sensorineural deafness and seizures in mice lacking vesicular glutamate transporter 3. Neuron. 57 (2), 263-275 (2008).



