Summary
Plenario de células patch-clamp grabaciones de las dendritas de fibras nerviosas auditivas en la sinapsis cinta del pelo interior de células de la cóclea de los mamíferos.
Abstract
La sinapsis aferente entre las células ciliadas internas (IHC) y la fibra del nervio auditivo proporciona un sitio electrofisiológicamente accesible para registrar la actividad postsináptica de una sola cinta sinapsis 1-4. Las sinapsis de las células sensoriales de la cinta la liberación de neurotransmisores, significa que la tasa de los cuales se modula en respuesta a cambios graduales en IHC potencial de membrana 5. Sinapsis de la cinta se ha demostrado que funcionan por la liberación multivesiculares, donde múltiples vesículas pueden ser liberados al mismo tiempo para evocar excitatorios postsinápticos corrientes (EPSCs) de diferentes amplitudes 1, 4, 6-11. Ni el papel de la cinta presináptica, ni el mecanismo subyacente a la liberación multivesiculares está bien entendido.
La IHC es inervado por 10-20 fibras del nervio auditivo, y todos los contactos de la fibra de la IHC con un solo amielínicas final para formar una sinapsis sola cinta. El pequeño tamaño de los centros de salud integrados boutons aferentes contacto (aproximadamente 1 m de diámetro) permite grabaciones con resolución temporal excepcional a realizar. Además, la técnica puede ser adaptada para registrar tanto las células pre-y post-sináptica de forma simultánea, lo que permite la función de transferencia en la sinapsis a ser estudiados directamente 2. Por lo tanto, este método proporciona un medio por el cual los aspectos fundamentales de la neurotransmisión puede ser estudiada, de la liberación multivesiculares a la función difícil de alcanzar de la cinta en las células sensoriales.
Protocol
1. Soluciones
- Las soluciones pueden ser preparadas con antelación. Soluciones extracelulares se puede almacenar a 4 ° C durante un máximo de un mes. Alícuotas de la solución interna se pueden almacenar congelados (-20 ° C). Asegurar que las soluciones están a temperatura ambiente antes de comenzar los experimentos.
- Solución de disección y una solución de registro extracelular (mM): KCl 5,8, NaCl 144; 0,9 MgCl2, CaCl2 1,3, 0,7 NaH 2 PO 4, 5,6 de glucosa, 10 HEPES, 1 piruvato Na, pH 7,4 (NaOH), 300 mOsm. Para IHC Ca 2 + aislamiento actual de la solución extracelular se puede modificar como se indica: 5,8 KCl, NaCl 114; 0,9 MgCl2, CaCl2 1,3, 0,7 NaH 2 PO 4, 5,6 de glucosa, 10 HEPES, 30 Cl TEA, pH 7,4 (NaOH ); 300 mOsm.
- 02.01 M tetrodotoxina (TTX) se puede agregar a la solución extracelular para bloquear canales de sodio voltaje cerrada y aislar excitatorios postsinápticos corrientes o potenciales (EPSCs o EPSPS).
- Solución de registro intracelular (mM): KCl 20 y 110 K-metanosulfonato, 5 de MgCl 2, 0,1 CaCl2, 5 EGTA, HEPES 5, 5 Na 2 ATP, GTP 0,3 Na 2, 5 Na 2 phoshocreatine, pH 7,2 (KOH), 290 mOsm, o 135 KCl, MgCl2 3,5, 0,1 CaCl2, 5 EGTA, HEPES 5, 4 Na 2 ATP, GTP 0,2 Na 2, pH 7,2 (KOH), 290 mOsm. Solución intracelular de Ca 2 + IHC aislamiento actual: 135 CsMeSO3, 13 Cl TEA; 3,5 MgCl2, 2,5 Na 2 ATP, 1 EGTA, pH 7,2 (CsOH); 290 mOsm. Esta solución se bloquean una cantidad significativa de las conductancias + K mucho más grande, dejando Ca 2 + restante actual.
2. Lo que los titulares de los tejidos disecados
- Cubreobjetos modificado se utiliza para mantener la preparación en el lugar durante las grabaciones también se pueden preparar con antelación.
- Aplique una gota de Sylgard (Dow Corning, Midland, MI) hacia el borde de un cubreobjetos circular (8-12 mm). Coloque el extremo más grueso de un alfiler de insectos muy bien (FST, n º 26002-10) sobre el cubreobjetos. Sostenga firmemente la clavija del insecto contra el cristal con pinzas y se mantiene cerca de una bobina de calefacción para establecer el Sylgard.
3. Hacer electrodos
- Preparar electrodos fresca cada día experimental y guardar en una caja hermética. Fabricar diez hasta veinte electrodos para cada preparación.
- Seleccione electrodo de vidrio, se utiliza 1 mm de vidrio de borosilicato capilares (1B100F-4 de WPI, Sarasota, FL).
- Diseño de un programa en un extractor de múltiples pasos para tirar de electrodos con un diámetro de la punta de aproximadamente 3.2 m (~ 6 mW en las soluciones descritas anteriormente). Utilizamos un Sutter P-87 de varios pasos extractor horizontal o vertical, Narishige extractor PC-10.
- Con cuidado, cubrir el vástago del electrodo con Sylgard tan cerca de la punta como sea posible. Esto disminuye la capacidad de pipeta y el ruido de la grabación minimiza.
- Fuego-pulido electrodos con una microforge con un filamento caliente como el que sucede a partir de WPI. Electrodos pulidas al fuego debe tener un diámetro de la punta exterior de aproximadamente 1 m (10 a 15 mW en las soluciones descritas anteriormente). El espesor de la pared de la pipeta es aproximadamente 1 / 3 micras. El diámetro exterior tiene aproximadamente el tamaño de la bouton aferentes a reparar.
- En el caso de la aplicación de registros simultáneos: IHC pipeta debe ser construido de la misma manera (mismo vaso, el mismo programa que tira), con la distinción que pulido al fuego debe dejar un mayor diámetro de la punta de ~ 3 m (6 - 8 MW).
4. Configuración del experimento
- Llene las cámaras conectadas al sistema de perfusión por gravedad alimentados con una solución extracelular y las soluciones de ensayo que contiene drogas o toxinas de interés.
- Set de perfusión para que el volumen de baño es de aproximadamente 2 ml, constantemente perfusión a un ritmo del orden de 1,5 ml min-1.
- Si se ofrecen soluciones diferentes que se aplicarán durante el experimento con un sistema de perfusión local, llenar los embalses con las soluciones. Ejecutar las soluciones a través del sistema y asegurarse de que no hay burbujas de aire.
5. La disección y preparación de la muestra
- La película acompaña ilustra la disección del órgano de Corti para las ratas de tres semanas de edad (Sprague Dawley, Charles River), que es más difícil que la de las primeras etapas después del parto. Ventajas y desventajas de la grabación de las ratas de diferentes edades se revisan en la discusión.
- Profundamente anestesiar la rata por inhalación de isoflurano. Cuando los reflejos de retirada están ausentes y los reflejos corneales están gravemente deprimidos, decapitar. Estos procedimientos han sido aprobados por el Cuidado de Animales de la Universidad Johns Hopkins y el empleo.
- Quitar el hocico y la piel de la cabeza decapitada. Dividir en dos la cabeza y sacar el cerebro para exponer el hueso temporal.
- Quite los dos huesos temporales y el lugar en limpiar los platos de disección con solución extracelular normal.
- Eliminarencapsulando el hueso del hueso temporal con el fin de exponer a la cóclea. Sostener el hueso temporal de forma segura en la base con un par de pinzas. Identificar las ventanas redonda y oval. Orientar la cóclea para que la ventana oval y secundarios en espiral de la cóclea boca arriba y retire el exceso de hueso alrededor de la cóclea.
- Quitar el hueso de encapsular la cóclea para exponer el epitelio sensorial, teniendo cuidado de proteger la bobina apical, que será utilizado para el experimento. Use un segundo par de pinzas finas de chips del hueso directamente en la cóclea, comenzando por el área que es más transparente que el resto de los huesos. Aquí el hueso es más delgado y más fácil de quitar. Continuar con la eliminación del hueso de alrededor de la bobina apical.
- El uso de micro-disección de las tijeras para cortar a través del modiolo debajo de la vuelta apical. A continuación, desconecte la vuelta apical de las vueltas más bajos de la cóclea.
- El uso de micro-Tijeras de disección de nuevo, si es necesario, para asegurar que la vuelta apical es cortado por completo. Tome precauciones para proteger la bobina apical, no se debe tirar o estirado. Use las pinzas finas para convencer a la vuelta apical del resto de la cóclea.
- Elimine los restos de los huesos de ambos lados de la vuelta apical.
- Retire con cuidado la estría vascular, la franja brillante de tejido situado fuera de la región de células ciliadas (Esquema 1). Asegúrese de evitar la eliminación de las células pilosas sensoriales, que pueden desprenderse a lo largo de la estría vascular.
- Use unas pinzas finas para separar la membrana tectoria, la brillante, semi-transparente que se encuentra por encima de la membrana de las células pilosas sensoriales.
- Ahora recortar el exceso de tejido y hueso y aplanar la preparación con las pinzas. Esto es necesario, para que el tejido se pueden colocar de manera uniforme en un alfiler.
- Colocar la preparación en el pin unido a un cubreobjetos (preparados previamente), teniendo cuidado de colocar el prisionero fuera de las células ciliadas.
- El uso de fórceps para transferir el cubreobjetos a la cámara de grabación. Garantizar que el tejido coclear está completamente cubierto con una gota de la solución extracelular, mientras que la transferencia de la cubreobjetos. Pulse el cubreobjetos con firmeza en el fondo de cristal de la cámara para asegurarse de que no se mueva durante la grabación.
- Comenzar inmediatamente la perfusión con solución extracelular, para garantizar una mejor supervivencia de la preparación.
6. Grabación
- Localice la preparación a través de los oculares de microscopio utilizando el 10x y 40x los objetivos de agua de inmersión DIC. Orientar la preparación para que los electrodos de registro pueden acercarse a centros de salud integrados ortogonal a la pared lateral de la IHC.
- Si la preparación está enroscada sobre, lo que limita la visibilidad de la región basal de centros de salud integrados, utilice un electrodo de registro para empujar el borde exterior de la preparación hacia abajo contra el cubreobjetos, teniendo cuidado de no presionar los propios centros de salud integrados.
- * Si utiliza ratas jóvenes, en esta etapa de la espesa capa de células de apoyo por encima de las células de pelo se puede quitar con una pipeta de limpieza (con un diámetro de la punta de ~ 10-20 micras) para acceder a las células sensoriales 1, 12.
- Utilizar el monitor para determinar si el tejido está sano. El uso de un lente de aumento 4X entre microscopio y la cámara Newvicon NC70 más aumenta la imagen y los proyectos de un área de unos 4.800 m 2 en el monitor. Las células de pelo debe ser alargada, con paquetes de pelo intacto. Cuando se deteriora el tejido, las células ciliadas se hinchan y se vuelven más transparentes y granulada.
- Localizar boutons aferentes en la base de los centros de salud integrados. Boutons son esférica o elipsoidal, de aproximadamente 1 m de diámetro y son de color claro con un aspecto brillante. La mayoría de los boutons se localizan por debajo del nivel del núcleo. Cuando el tejido es boutons insalubres aumentará a aproximadamente 4 veces el tamaño normal y se vuelven transparentes, más que brillante.
- Llenar un electrodo de registro con la solución intracelular, aplique presión positiva y el uso del micromanipulador para maniobrar el electrodo a la preparación.
- Hacer una incisión en la preparación a nivel de la base de IHC con el electrodo. Empujar el electrodo entre la delgada capa de células de apoyo y centros de salud integrados, utilizando una presión positiva para forjar una ruta de acceso a la zona en la base de las centros de salud integrados. Este paso es "clave" para llegar a la bouton aferentes y por no registrar a partir de células de soporte que bien las terminaciones aferentes ensheath.
- Retire con cuidado el electrodo y reemplazarlo con un electrodo de recién llenado.
- El uso de presión positiva para mantener una punta del electrodo limpio y maniobrar el electrodo a través del orificio de acceso a la membrana de la IHC. La presión positiva debe ayudar en el movimiento alrededor de las células de soporte que rodean el centros de salud integrados.
- Mueva el electrodo alrededor de las células de sostén adyacentes hacia el bouton aferentes (como se muestra en la película de acompañamiento. Una alternativa es acercarse a la bouton aferentes al mover unalargo de la membrana IHC hasta que la punta del electrodo toca el bouton). Asegúrese de que la punta del electrodo se encuentra directamente en frente de la bouton aferentes (todavía hay un pequeño espacio entre la Bouton y el electrodo debido a la presión positiva en la pipeta). Boutons ofrecen más resistencia al movimiento de la pipeta de las células de sostén y la membrana de IHC, ya que pueden ser "sentida" por el experimentador.
- Mueva la pipeta hacia arriba y abajo y empuje para asegurarse de que los movimientos de Bouton. Esto indica que la punta de la pipeta y Bouton se encuentran en el mismo plano Z.
- Con el electrodo presionado contra el bouton aferentes, al mismo tiempo de liberación de presión positiva y el efecto de succión para formar un sello GΩ. Formación de un sello GΩ en una bouton aferente es similar a la que en una célula de pelo. La formación de sello puede ser rápido o puede ocurrir lentamente.
- Aplique empujones suaves de succión a la ruptura de la membrana en el electrodo y entrar en la configuración de la celda grabación completa.
- Si la célula es un parche bouton aferentes, pequeños transitorios capacitivos aparecerá en el pulso cuadrado monitoreados durante la formación del sello (ver Figura 1). Hemos estimado la capacidad de la terminación aferente a 0,4 a 1,8 pF (véase 3, 4). Si la célula es un parche IHC, transitorios serán del orden de 3.5 veces mayor en función de la resistencia de acceso.
- Para confirmar que la célula es un bouton aferentes, ejecutar un protocolo con hiperpolarización y despolarización pasos de voltaje. Las relaciones de tensión actual (IVs) de las fibras aferentes y centros de salud integrados (a menudo erróneamente parche cuando se pretende una bouton aferentes) son característicos de los tipos de células individuales y se muestran en la Figura 2.
- Monitorear el potencial de membrana, para una fibra aferente, que normalmente es alrededor de -60 a -65 mV.
- Si el celular no es un bouton aferentes, retire los electrodos y repita los pasos 8 - 13 con un electrodo de recién llenado. Utilizar un nuevo electrodo para cada intento.
- Monitor de resistencia en serie a lo largo de la grabación mediante la aplicación de medidas de tensión para asegurarse de que el sello no está cerrando. Si la resistencia en serie aumenta, puede ser útil para aplicar suaves pulsos de aspiración o para mover el electrodo ligeramente hacia atrás. Resistencias en serie suelen ser alrededor de 30 mW. Al analizar la actividad sináptica, descartamos grabaciones con resistencias en serie más grande que 50 MW.
- Ahora puede registrar la actividad sináptica (ver figura 3). Cualquiera de las fibras aferentes muestra una actividad espontánea, o la célula de pelo debe ser despolarizado para activar la liberación del transmisor. La aplicación de una solución extracelular con una concentración de potasio más altos (por ejemplo, 40 mM) se despolarizan la célula de pelo y, a menudo activar o aumentar la velocidad de liberación del transmisor.
- De registros simultáneos de centros de salud integrados y boutons aferentes 2, el procedimiento debe ser modificado de la siguiente manera: Siga los pasos 1 a 5. Llenar una pipeta de IHC con la solución correspondiente intracelular de Ca 2 + de aislamiento actual y siga como se indica en 6. Salir de la pipeta para la grabación de IHC en "posición de espera" cerca de la IHC para ser grabado desde. Continúe con los pasos 6-14 para el registro de aferentes. Cuando la pipeta aferente es en la configuración de célula entera continuar con la pipeta IHC. Maniobra de la pipeta segundo hacia la pared lateral de la correspondiente IHC, manteniendo siempre una presión positiva. El IHC debe mostrar una hendidura en la pared lateral por medio de la presión y que hay que garantizar que el apoyo a las células se separan de ella. Pasos 12 a 13 se podría aplicar para IHC también. Como se indica en 14, en comparación con la fibra aferente, más los transitorios capacitivos son un sello distintivo de una grabación de IHC, además de la característica relación IV. Una vez que se establezcan registros simultáneos, en algún momento se debe permitir (3 - 5 minutos, dependiendo de la resistencia en serie) para las soluciones intracelulares para lavar en el IHC. Esto se traducirá en mayores corrientes de Ca 2 + debido a un bloqueo cada vez más grande de las conductancias de K +.
- Con el fin de realizar sueltas sello grabaciones extracelular, en el paso 12, en lugar de hacer un sello GΩ, hacer un sello flexible de entre 30 y 50 MW en el bouton aferentes. Esto se puede lograr mediante la aplicación de menos de succión, mientras que la liberación de la presión positiva. Véase la Figura 5 para un ejemplo de un registro extracelular de una rata bouton P21 aferentes.
7. Solución de problemas
- Si las juntas se pueden formar, pero la transición de las células adjunta a la grabación de célula entera no puede ser alcanzado, el diámetro interior de la pipeta puede ser muy estrecha.
- Si los sellos apretados no se puede formar, el diámetro interior de la pipeta puede ser demasiado grande y el bouton conjunto podría ser absorbida en el electrodo.
- Si todos los eventos sinápticos son pequeñas y uniformes, la grabación puede ser extracelular a la aferente. Prueba de reversión de los acontecimientos en los potenciales de membrana positivos; intracelularmente registradaEPSCs revertirá a potenciales positivos.
- Si las resistencias serie son consistentemente altas cuando actualice los terminales aferentes, trate de mover la pipeta hacia atrás antes de tratar de abrirse paso en la configuración de célula entera. Esto ayuda a evitar la obstrucción de la pipeta y el acceso de alta resistencia.
- Posición correcta de la pipeta sin miedo. Es posible mover el electrodo para reducir la resistencia en serie de alta o de obstrucción pipeta sin "perder" el sello de la aferente. Durante el establecimiento de la grabación simultánea, la IHC es por lo general "empujados" hacia el bouton. La posición de la pipeta aferentes se pueden corregir en consecuencia.
8. Resultados representante
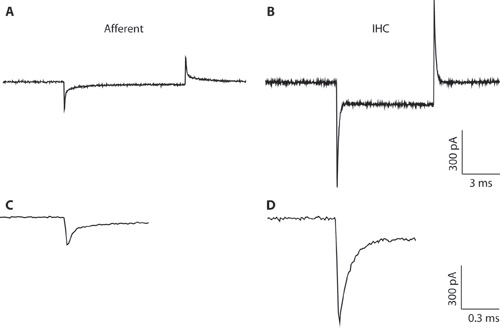
Figura 1. AB. Transitorios típicos grabados de una fibra aferente (A) y de IHC (B) en respuesta a un comando de 10 mV hiperpolarización de tensión de un voltaje de celebración de -94 mV. Debido a que el diámetro pipeta estrecha y acceso de alta resistencia, la grabación de IHC (B) no es óptimo para la grabación de células enteras IHC. La grabación se muestra aquí sólo para ilustrar la diferencia entre los transitorios capacitivos de IHCs y fibras aferentes. Esto puede ayudar a distinguir entre los tipos de células cuando se forma la configuración de célula completa. Plenario de células transitorias capacitivas de centros de salud integrados, son del orden de 5 veces mayor en la amplitud que las de las fibras aferentes. CD. Transitorios de A a B y se muestra en una escala de tiempo expandida. C. La decadencia de la respuesta aferente puede estar en forma con dos exponenciales. La capacidad de la terminación aferentes se estimó a partir del componente rápido.

Figura 2. IV las relaciones de un bouton aferentes (A) y una IHC (B). Las relaciones IV se registran a partir de un potencial de mantenimiento de -84 mV con pasos de voltaje de -124 mV a + 36 mV en incrementos de 10 mV (tensiones nominales). Voltajes se muestran a la derecha de algunas huellas. Estas grabaciones se llevaron a cabo con 5,8 mM KCl extracelular a temperatura ambiente. Escala para ambos: 500 pA, 200 ms.
Una. IV relaciones de una fibra aferente en el día postnatal 19. EPSCs están presentes en la mayoría de los pasos de voltaje; EPSCs inversa positiva a 6 mV. Esta grabación se llevó a cabo en presencia de TTX para bloquear la tensión cerrada corrientes de Na +. Tenga en cuenta la activación de la corriente lentamente hacia el interior a tensiones hiperpolarización (I h). Esta corriente no está presente en centros de salud integrados o células de sostén y proporciona una buena indicación de que la célula es un grabado de fibras aferentes (ver 3). B. IV las relaciones de una IHC P19. Debido a que el diámetro pipeta estrecha y acceso de alta resistencia, la grabación no es óptima para la caracterización de IHC corrientes y las corrientes son más pequeñas de lo esperado. La grabación se muestra aquí sólo para demostrar las relaciones de los centros de salud integrados IV y las fibras aferentes se pueden distinguir claramente, cuando una grabación de fibras aferentes se intenta. Tenga en cuenta la rápida activación de corrientes de K + hacia el exterior a potenciales positivos (flecha), seguido por el retraso rectificador de corrientes de K + 13.

Figura 3. Ejemplar corrientes sinápticas registrada de una fibra aferente en el día postnatal 21 en la presencia de 40 mM de K extracelular para aumentar la tasa de liberación de la TSI. Temperatura ambiente, con TTX aplicar para bloquear la tensión cerrada corrientes de Na +. A. Escala de 200 Pa, 5 ms, tenga en cuenta el tamaño y forma variables de EPSCs. Para una descripción detallada de las características EPSC ver 4. B. Dos EPSCs marcado A (#: multifásica, o: monofásico) que aparece en una escala ampliada: Escala de 100 Pa, 1 ms.

Figura 4. Grabación simultánea de una IHC y ponerse en contacto con bouton aferentes en el órgano de Corti rata extirpados, después del día 10 (ver también 2). Un escalón de tensión despolarizar la IHC provoca la liberación de neurotransmisores y activa EPSCs en el bouton aferentes Superior de seguimiento:. Protocolo de tensión para la despolarización de IHC. Con un potencial: -79 mV, 50 ms paso a -29 mV Trace:. Tipo L de Ca 2 + corrientes registradas de la TSI, suelen mostrar poca inactivación y activar a potenciales negativos traza del fondo:. Corrientes sinápticas en las fibras aferentes en respuesta a la despolarización de IHC. Tenga en cuenta que la depresión sináptica durante una despolarización 50 ms IHC.

Figura 5. Una. Grabación Ejemplar extracelular de un bouton aferentes en el día postnatal 21. Este fue grabado en la sala de temperaturatura, con 5,8 mM de K + extracelular. Esta grabación tiene una típica señal a ruido de una grabación en una preparación de una rata de tres semanas de edad. B. Forma de onda media para los eventos registrados extracelular de un bouton P20 aferentes. Esta es la forma de onda media de 10.272 eventos.

Esquema 1. Cruz vista en sección a través de un cambio de una cóclea de rata que ilustra la relación anatómica entre las células ciliadas internas y externas, los ganglios de la espiral, la membrana estría vascular y tectoria.
Discussion
El paso crítico en este procedimiento es la disección. Si el tejido se estira o se dañó durante la disección, las fibras aferentes no va a sobrevivir. Tejido de las ratas más jóvenes es más elástica y de perdón. Nos encontramos con que los días postnatales 10 a 11 son los más fáciles de diseccionar y experimentos tienen mayores tasas de éxito. Un importante grado de maduración se produce después del nacimiento coclear, con las ratas empiezan a oír de todo el día postnatal 12 14. Por lo tanto, a la edad en que la disección es más fácil, las sinapsis no pueden ser completamente maduros 4.
La disección se describe aquí para las ratas es esencialmente el mismo para los ratones, la principal diferencia es el tamaño más pequeño de la cóclea del ratón. Esta técnica permite que las propiedades de las sinapsis cinta para ser examinado en ratones modificados transgénicamente 15. Otras modificaciones de esta técnica incluyen: la adición de un colorante fluorescente a la solución intracelular a las fibras de la etiqueta 3, las grabaciones se combina con las células ciliadas internas presináptica y postsináptica bouton aferentes, lo que permite la función de transferencia sináptica entre las células antes y después de que se determine 2 y suelta sello de grabaciones extracelular en boutons aferentes para evitar la pérdida de la integridad celular. La configuración de registro extracelular es más fácil de conseguir que toda la configuración de las células y los experimentos son generalmente de mayor duración.
Disclosures
No hay conflictos de interés declarado.
Acknowledgments
Este trabajo fue apoyado por una Fundación de Investigación de la Sordera de Becas de Investigación de EY y NIDCD DC006476 a EG y NIDCD DC005211 el Centro para la audición y el equilibrio, la Universidad Johns Hopkins. Obra de autor Tim Phelps, la Universidad Johns Hopkins.
LG escribió el manuscrito inicial, EY y LG filmó la disección y la grabación. Todos los autores siempre figuras ejemplares y ha contribuido a la redacción del manuscrito.
Materials
| Name | Company | Catalog Number | Comments |
| Air table | TMC | ||
| Gibraltar Stage with xy-table | Burleigh | ||
| Axioscope FS2 upright microscope DIC optics Green filter | Carl Zeiss, Inc. | ||
| Newvicon camera with controller | Dage | ||
| Monitor | Dage | ||
| Multiclamp 700B (or similar) | Molecular Devices | ||
| Digidata 1322A (or similar) | Molecular Devices | ||
| Manipulator MP285 | Sutter Instrument Co. | ||
| 6-channel valve application system for local perfusion (used with hand made perfusion pipettes) | Warner Instruments | ||
| PC with acquisition software (PClamp) | Molecular Devices | ||
| Above is the equipment in our electrophysiological setups used for recording from afferent terminals. | |||
References
- Glowatzki, E., Fuchs, P. A. Transmitter release at the hair cell ribbon synapse. Nat Neurosci. 5 (2), 147-154 (2002).
- Goutman, J. D., Glowatzki, E. Time course and calcium dependence of transmitter release at a single ribbon synapse. Proc Natl Acad Sci U S A. 104 (41), 16341-16346 (2007).
- Yi, E., Roux, I., Glowatzki, E. Dendritic HCN channels shape excitatory postsynaptic potentials at the inner hair cell afferent synapse in the mammalian cochlea. J Neurophysiol. 103 (5), 2532-2543 (2010).
- Grant, L., Yi, E., Glowatzki, E. Two modes of release shape the postsynaptic response at the inner hair cell ribbon synapse. J Neurosci. 30 (12), 4210-4220 (2010).
- LoGiudice, L., Matthews, G. The role of ribbons at sensory synapses. Neuroscientist. 15 (4), 380-391 (2009).
- Singer, J. H. Coordinated multivesicular release at a mammalian ribbon synapse. Nat Neurosci. 7 (8), 826-833 (2004).
- Keen, E. C., Hudspeth, A. J. Transfer characteristics of the hair cell's afferent synapse. Proc Natl Acad Sci U S A. 103 (14), 5537-5542 (2006).
- Li, G. L. The unitary event underlying multiquantal EPSCs at a hair cell's ribbon synapse. J Neurosci. 29 (23), 7558-7568 (2009).
- Singer, J. H., Diamond, J. S. Vesicle depletion and synaptic depression at a mammalian ribbon synapse. J Neurophysiol. 95 (5), 3191-3198 (2006).
- Suryanarayanan, A., Slaughter, M. M. Synaptic transmission mediated by internal calcium stores in rod photoreceptors. J Neurosci. 26 (6), 1759-1766 (2006).
- Neef, A. Probing the mechanism of exocytosis at the hair cell ribbon synapse. J Neurosci. 27 (47), 12933-12944 (2007).
- Tritsch, N. X. The origin of spontaneous activity in the developing auditory system. Nature. 450 (7166), 50-55 (2007).
- Kros, C. J., Ruppersberg, J. P. Expression of a potassium current in inner hair cells during development of hearing in mice. Nature. 394 (6690), 281-284 (1998).
- Muller, M. Developmental changes of frequency representation in the rat cochlea. Hear Res. 56 (1-2), 1-7 (1991).
- Seal, R. P. Sensorineural deafness and seizures in mice lacking vesicular glutamate transporter 3. Neuron. 57 (2), 263-275 (2008).



