Summary
Whole-cell patch-clamp gravações de dendritos do nervo auditivo fibra no interior da fita sinapse das células ciliadas da cóclea de mamíferos.
Abstract
A sinapse aferente entre a célula ciliadas internas (CCI) e da fibra do nervo auditivo fornece um site eletrofisiologicamente acessível para a gravação da atividade pós-sináptica de uma fita única sinapse 1-4. Sinapses fita de células sensoriais liberação de neurotransmissores de forma contínua, cuja taxa é modulada em resposta a mudanças graduais em IHC potencial de membrana 5. Sinapses fita foram mostrados a funcionar pelo lançamento multivesiculares, onde múltiplas vesículas pode ser lançado simultaneamente para evocar correntes excitatórias pós-sináptico (EPSCs), com diferentes amplitudes 1, 4, 6-11. Nem o papel da fita pré-sináptico, nem o mecanismo subjacente liberação multivesiculares está bem compreendida.
O IHC é inervado por fibras do nervo auditivo 10-20, e todos os contatos de fibra da IHC com um único unmyelinated fim para formar uma fita única sinapse. O pequeno tamanho da IHCS aferentes boutons entrar em contato com (aproximadamente 1 m de diâmetro) permite gravações com resolução temporal excepcional para ser feita. Além disso, a técnica pode ser adaptada para gravar a partir de ambas as células pré e pós-sinápticos simultaneamente, permitindo que a função de transferência na sinapse a ser estudada diretamente 2. Este método, portanto, fornece um meio pelo qual os aspectos fundamentais da neurotransmissão pode ser estudada, de liberação multivesiculares para a função de esquiva da fita em células sensoriais.
Protocol
1. Soluções
- Soluções podem ser preparadas com antecedência. Soluções extracelulares podem ser armazenados a 4 ° C por até um mês. Alíquotas de solução interna pode ser mantido congelado (-20 ° C). Garantir que as soluções estão à temperatura ambiente antes de iniciar os experimentos.
- Solução de dissecação e solução de gravação extracelular (mM): 5,8 KCl, NaCl 144; 0,9 MgCl 2, 1,3 CaCl 2; 0,7 NaH 2 PO 4; 5,6 glicose; 10 HEPES; um piruvato Na, pH 7,4 (NaOH), a 300 mOsm. IHC para Ca 2 + isolamento atual a solução extracelular pode ser modificado conforme indicado: 5,8 KCl, NaCl 114; 0,9 MgCl 2, 1,3 CaCl 2; 0,7 NaH 2 PO 4; 5,6 glicose; 10 HEPES; 30 Cl TEA; pH 7,4 (NaOH ); 300 mOsm.
- 1-2 mM tetrodotoxina (TTX) pode ser adicionado à solução extracelular para bloquear canais de sódio voltagem gated e isolar excitatórios pós-sinápticos correntes ou potenciais (EPSCs ou EPSPs).
- Solução de gravação intracelular (mM): 20 KCl; 110 K metanossulfonato; 5 MgCl 2, 0,1 CaCl 2, 5 EGTA, 5 HEPES, 5 Na 2 ATP; 0,3 Na 2 GTP; 5 Na 2 phoshocreatine; pH 7.2 (KOH), 290 mOsm; ou 135 KCl; 3,5 MgCl 2, 0,1 CaCl 2, 5 EGTA, 5 HEPES; 4 Na 2 ATP; 0,2 Na 2 GTP; pH 7.2 (KOH), 290 mOsm. Solução intracelular de IHC Ca 2 + isolamento atual: 135 CsMeSO3; 13 Cl TEA; 3,5 MgCl 2, 2,5 Na 2 ATP; um EGTA; pH 7.2 (CsOH); 290 mOsm. Esta solução iria bloquear uma quantidade significativa das condutâncias + K muito maior, deixando Ca 2 + atual restantes.
2. Suportes para fazer Tissue Dissecada
- Lamínulas modificado usado para manter a preparação no local durante as gravações também podem ser preparadas com antecedência.
- Aplique uma gota de Sylgard (Dow Corning, Midland, MI) em direção à borda de uma lamela de vidro circular (8-12 mm). Coloque a extremidade de espessura de um alfinete de inseto multa (FST, item não 26002-10) na lamela. Segure firmemente o pino do inseto contra o vidro com uma pinça e mantenha perto de uma bobina de aquecimento para definir o Sylgard.
3. Fazendo Eletrodos
- Prepare eletrodos fresca em cada dia experimental e guarde em uma caixa hermética. Fabricar 10-20 eletrodos para cada preparação.
- Selecione eletrodo de vidro, usamos um milímetro de vidro de borosilicato capilares (1B100F-4 do WPI, Sarasota, FL).
- Projetar um programa em um extrator de multi-passo para puxar eletrodos com um diâmetro da ponta de cerca de 2-3 mM (~ 6 mohms em soluções descritas acima). Nós usamos um Sutter P-87 extrator multi-passo horizontal ou um extrator Narishige PC-10 vertical.
- Cuidadosamente revestimento da haste do eletrodo com Sylgard tão perto da ponta possível. Isso diminui a capacitância pipeta e ruído minimiza gravação.
- -Fogo polonês eletrodos utilizando um microforge com um filamento aquecido, como a disponível a partir de WPI. Eletrodos fogo polido deve ter um diâmetro da ponta externa de aproximadamente 1 mícron (10-15 mohms em soluções descritas acima). A espessura da parede da pipeta é cerca de 1 / 3 mm. O diâmetro externo tem sobre o tamanho do bouton aferentes para ser corrigido.
- Em caso de implementação de gravações simultâneas: IHC pipeta deve ser construída da mesma maneira (o mesmo de vidro, puxando mesmo programa), com a distinção que o polimento de incêndio deve deixar um diâmetro maior ponta de ~ 3 mm (6-8 mohms).
4. Configurando o Experimento
- Preencha câmaras conectadas ao sistema de perfusão gravidade alimentados com solução extracelular e soluções de teste que contém drogas ou toxinas de interesse.
- Conjunto de perfusão de modo que o volume do banho é de aproximadamente 2 mL, constantemente perfundir a uma taxa da ordem de 1,5 mL min-1.
- Se diferentes soluções devem ser aplicadas durante o experimento com um sistema de perfusão local, preencher os reservatórios com soluções. Executar soluções através do sistema e garantir que não há bolhas de ar.
5. Dissecção e Preparação da Amostra
- O filme acompanha ilustra a dissecção do órgão de Corti há três semanas ratos velhos (Sprague Dawley, Charles River), que é mais difícil do que a anterior fase pós-natal. Vantagens e desvantagens de gravação de ratos de diferentes idades são analisados na discussão.
- Profundamente anestesiar o rato por inalação de isoflurano. Quando reflexos de retirada estão ausentes e os reflexos da córnea são severamente deprimidos, decapitar. Estes procedimentos foram aprovados pelo Animal Care Johns Hopkins University e do Comitê Use.
- Remover o focinho e pele da cabeça decapitada. Bisect a cabeça e remover o cérebro para expor os ossos temporal.
- Remova ambos os ossos temporais e colocar em pratos limpos dissecar contendo solução extracelular padrão.
- Removerencapsulando o osso do osso temporal, de modo a expor a cóclea. Segure firmemente o osso temporal, na base com um par de fórceps. Identificar as janelas redondas e ovais. Orientar a cóclea para que a janela oval e laterais em espiral da cóclea e rosto para cima remover o excesso de osso ao redor da cóclea.
- Remover o osso da cóclea encapsular para expor o epitélio sensorial, tendo o cuidado de proteger a bobina apical, que será utilizado para o experimento. Use um segundo par de fórceps multa para o chip diretamente fora do osso da cóclea, começando com a área que é mais transparente do que o resto do osso. Aqui, o osso é mais fino e mais fácil de remover. Continue removendo o osso ao redor da bobina apical.
- Use micro-dissecando tesoura para cortar o modíolo abaixo do giro apical. Depois desconecte o giro apical da voltas inferior da cóclea.
- Use micro-tesouras de dissecação, novamente, se necessário, para garantir que o giro apical está completamente cortada. Tome cuidado para proteger a bobina apical, não deve ser puxado ou esticado. Use a pinça fina para persuadir o giro apical do resto da cóclea.
- Remover o resto do osso de ambos os lados da espira apical.
- Remova cuidadosamente a estria vascular, a tira de tecido brilhante situado fora da região das células ciliadas (Esquema 1). Certifique-se para evitar remover as células sensoriais ciliadas, que pode facilmente tornar-se destacado, juntamente com a estria vascular.
- Use uma pinça fina para retirar a membrana tectorial, o brilhante, membrana semi-transparente que fica acima das células sensoriais ciliadas.
- Agora aparar o excesso de tecido e osso e achatar a preparação com a pinça. Isto é necessário, de modo que o tecido pode ser colocado uniformemente sob um alfinete.
- Coloque a preparação sob o pino ligado a uma lamela (preparado anteriormente), tendo o cuidado de posicionar o pino de longe as células ciliadas.
- Use uma pinça para transferir a lamínula para a câmara de gravação. Garantir o tecido da cóclea é completamente coberto com uma gota de solução extracelular, enquanto a transferência da lamela. Pressione a lamínula para baixo com firmeza para o fundo da câmara de vidro para garantir que ele não se move durante a gravação.
- Começar imediatamente a perfusão com solução extracelular, para garantir melhor a sobrevivência da preparação.
6. Gravação
- Localize a preparação através da ocular do microscópio usando o 10x e 40x a água objetivos DIC imersão. Orientar a preparação para que eletrodos de registro pode se aproximar IHCS ortogonalmente à parede lateral do IHC.
- Se a preparação for enrolada sobre, limitando a visibilidade da região basal da IHCS, use um eletrodo de gravação para empurrar a borda externa da preparação para baixo contra a lamela de vidro, tomando cuidado para evitar pressionar o IHCS si.
- * Se estiver usando ratos jovens, nesta fase, a espessa camada de células de suporte acima das células do cabelo pode ser removido com uma pipeta de limpeza (com um diâmetro da ponta de aproximadamente 10-20 mm) para obter acesso às células sensoriais 1, 12.
- Usar o monitor para verificar se o tecido está saudável. Usando uma lente de ampliação de 4X entre microscópio e da câmara Newvicon NC70 ainda amplia a imagem e projetos de uma área de cerca de 4800 M 2 no monitor. Células ciliadas devem ser alongados com feixes de cabelo intacto. Quando o tecido se deteriora, as células ciliadas inchar e se tornar mais transparente e granulada.
- Localize boutons aferentes em torno da base do IHCS. Boutons são esféricos ou elipsoidais, cerca de 1 m de diâmetro e são de cor clara com uma aparência brilhante. A maioria dos boutons estão localizadas abaixo do nível do núcleo. Quando o tecido é boutons insalubres inchar a aproximadamente 4 vezes o tamanho normal e tornam-se transparentes, ao invés de brilhante.
- Preencher um eletrodo de registro com a solução intracelular, aplicar pressão positiva e usar o micromanipulador para manobrar o eletrodo para a preparação.
- Faça uma incisão na preparação ao nível da base de IHC com o eletrodo. Empurre o eletrodo entre a fina camada de células de suporte e os IHCS, com pressão positiva para forjar uma via de acesso para a área na base do IHCS. Este passo é "chave" para alcançar o bouton aferentes e para não gravar a partir de células de suporte que firmemente ensheath as terminações aferentes.
- Remova cuidadosamente o eletrodo e substituir por um eletrodo de recém-preenchido.
- Com pressão positiva para manter uma ponta do eletrodo limpo, manobra do eletrodo através do orifício de acesso para a membrana do IHC. A pressão positiva deve ajudar em mover-se em torno das células de apoio em torno do IHCS.
- Mova o eletrodo em torno adjacentes células de suporte para o bouton aferentes (como mostrado no filme de acompanhamento. Uma abordagem alternativa é a abordagem da bouton aferentes movendo umlongo da membrana IHC até que a ponta do eletrodo toca o bouton). Garantir que a ponta do eletrodo é diretamente na frente do bouton aferentes (ainda há um pequeno intervalo entre a bouton eo eletrodo, devido à pressão positiva sobre a pipeta). Boutons oferecer mais resistência ao movimento da pipeta que as células de apoio e da membrana IHC, pois eles podem ser "sentida" pelo experimentador.
- Mova pipeta cima e para baixo e empurrar para se certificar de que os movimentos bouton. Isto indica que a ponta da pipeta e bouton estão no mesmo Z-plano.
- Com o eletrodo pressionado contra o bouton aferentes, ao mesmo tempo de liberação de pressão positiva e aplicar o vácuo para formar uma vedação GÊ. Formação de uma vedação em um GÊ bouton aferentes é semelhante ao que em uma das células ciliadas. Formação de vedação pode ser rápido ou pode ocorrer lentamente.
- Aplicar suaves surtos de sucção à ruptura da membrana dentro do eletrodo e entrar na configuração de gravação de células inteiras.
- Se a célula é um patch bouton aferentes, pequenos transientes capacitiva aparecerá no pulso quadrado monitorado durante a formação do selo (ver Figura 1). Nós estimamos a capacitância do fim aferentes a ser 0,4-1,8 pF (ver 3, 4). Se a célula é um patch IHC, transientes será da ordem de 3-5 vezes maior, dependendo da resistência de acesso.
- Para confirmar que a célula é um bouton aferentes, executar um protocolo com hiperpolarizante e despolarizante passos de tensão. As relações tensão corrente (IVs) para fibras aferentes e IHCS (muitas vezes erroneamente corrigido quando se aponta para um bouton aferentes) são característicos para os tipos de células individuais e são mostrados na Figura 2.
- Monitorar o potencial de membrana, por uma fibra aferente, é normalmente em torno de -60 a -65 mV.
- Se a célula não é um bouton aferentes, remova eletrodo e repita os passos 8-13 com um eletrodo de recém-preenchido. Use um novo eletrodo para cada tentativa.
- Monitorar a resistência série ao longo da gravação, aplicando medidas de tensão para garantir que o selo não é fechando. Se a resistência série aumenta, ele pode ser útil para aplicar pulsos suave de sucção ou para mover o eletrodo para trás ligeiramente. Resistências série são tipicamente cerca de 30 mohms. Ao analisar a atividade sináptica, descartamos gravações com resistências série com mais de 50 mohms.
- Agora você pode gravar a atividade sináptica (ver Figura 3). Ou a fibra aferente apresenta atividade espontânea, ou a célula de cabelo precisa ser despolarizada para ativar liberação do transmissor. Aplicação de uma solução extracelular com uma concentração mais elevada de potássio (por exemplo 40 mM) vai despolarizar a célula de cabelo e muitas vezes ativar ou aumentar a taxa de liberação do transmissor.
- Para gravações simultâneas de IHCS e boutons aferentes 2, o procedimento deve ser modificado da seguinte forma: Continue com as etapas de 1 a 5. Preencha uma pipeta IHC com a solução correspondente intracelular de Ca 2 + atual isolamento e siga como indicado em 6. Deixe a pipeta para IHC gravação em "posição de espera" perto do IHC a ser gravado a partir. Continue com as etapas 6-14 para a gravação aferentes. Quando a pipeta é aferentes na configuração de células inteiras continuar com a pipeta IHC. Manobra pipeta o segundo em direção à parede lateral do IHC correspondente, sempre mantendo pressão positiva. O IHC deve mostrar um recorte na parede lateral, por meio da pressão e precisa ser assegurado que as células de suporte são separados a partir dele. Passos 12-13 poderia ser aplicada para IHC também. Como indicado em 14, em comparação com a fibra aferente, maior transientes capacitivos são uma marca registrada de uma gravação IHC, além da relação IV característica. Uma vez que gravações simultâneas são estabelecidas, algum tempo deveria ser permitido (3-5 min, dependendo da resistência em série) para soluções intracelular de lavar para a IHC. Isso resultará em maior Ca 2 + correntes devido ao bloqueio crescente de condutâncias + K muito maior.
- A fim de realizar loose-selo gravações extracelular, no passo 12, ao invés de fazer um selo GÊ, fazer um selo solta de cerca de 30-50 mohms para o bouton aferentes. Isto pode ser conseguido através da aplicação de menos de sucção, enquanto liberando a pressão positiva. Ver Figura 5 para um exemplo de uma gravação extracelular de um rato bouton P21 aferentes.
7. Resolução de Problemas
- Se os selos podem ser formados, mas a transição de células-anexado à gravação de toda a célula não pode ser alcançado, o diâmetro interior da pipeta pode ser muito estreito.
- Se selos apertado não pode ser formado, o diâmetro interior da pipeta pode ser muito grande e os bouton inteiro poderia ser sugado para dentro do eletrodo.
- Se todos os eventos sinápticos são pequenos e uniformes, a gravação pode ser extracelular para o aferentes. Teste de reversão de eventos potenciais de membrana positivo; intracelularmente gravadoEPSCs reverterá em potenciais positivos.
- Se as resistências série são consistentemente elevados quando patching terminais aferentes, tente mover a pipeta para trás antes de tentar romper na configuração de células inteiras. Isso ajuda a evitar o entupimento da pipeta e acesso de alta resistência.
- Posição correta da pipeta sem medo. É possível mover o eletrodo para reduzir a resistência série alta ou entupimento pipeta sem "perder" o selo do aferentes. Durante o estabelecimento da gravação simultânea, a IHC é geralmente 'empurrado' para o bouton. A posição da pipeta aferente pode ser corrigido em conformidade.
8. Resultados representante
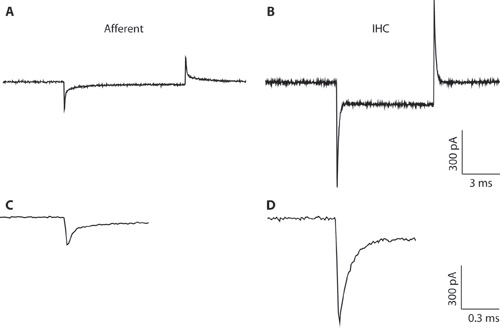
Figura 1. AB. Transientes típico gravado a partir de uma fibra aferente (A) e IHC (B) em resposta a uma mV 10 hiperpolarizantes comando de tensão de uma tensão realização de -94 mV. Devido ao diâmetro da pipeta estreitas e acesso de alta resistência, a gravação IHC (B) é sub-ótima para toda a gravação de células IHC. A gravação é mostrado aqui apenas para ilustrar a diferença entre os transientes capacitiva de IHCS e fibras aferentes. Isso pode ajudar a distinguir entre os tipos de células que formam quando a configuração de célula inteira. De célula inteira transientes capacitiva de IHCS são da ordem de 5 vezes maiores em amplitude do que os de fibras aferentes. CD. Transientes de A & B mostrado em uma escala temporal alargada. C. A decadência da resposta aferente pode ser adaptado com duas exponenciais. A capacitância do fim aferentes foi estimado a partir do componente rápido.

Relações figura 2. IV a partir de um bouton aferentes (A) e um IHC (B). IV relações são gravadas a partir de um potencial de realização de -84 mV com passos de tensão de -124 mV para + 36 mV em incrementos de 10 mV (tensão nominal). Tensões são mostrados à direita de alguns traços. Essas gravações foram realizadas com 5,8 mM KCl extracelular em temperatura ambiente. Escala para ambos: 500 pA, 200 ms.
A. IV relações a partir de uma fibra aferente no dia pós-natal 19. EPSCs estão presentes durante a maior parte dos passos de tensão; EPSCs reverso positivo para 6 mV. Esta gravação foi realizada na presença de TTX para bloquear a tensão gated Na + correntes. Observe o atual lentamente para dentro na ativando tensões hiperpolarizantes (I h). Esta corrente não está presente em IHCS ou células de suporte e fornece uma boa indicação de que a célula é gravado a partir de uma fibra aferente (ver 3). B. IV relações de um IHC P19. Devido ao diâmetro da pipeta estreitas e acesso de alta resistência, a gravação é de qualidade inferior para a caracterização de IHC correntes e as correntes são menores do que o esperado. A gravação é mostrado aqui apenas para demonstrar as relações de IHCS IV e fibras aferentes podem ser claramente distinguidos, quando uma gravação de fibra aferente é tentada. Observe a rápida ativação externa K + correntes em potenciais positivos (seta), seguido por retificadora tardia K + correntes 13.

Figura 3. Exemplar correntes sinápticas gravado a partir de uma fibra aferente no dia 21 pós-natal na presença de 40 mM + K extracelular para aumentar a taxa de liberação do IHC. Temperatura ambiente, com TTX aplicadas para bloquear a tensão gated Na + correntes. A. Escala de 200 pA, 5 ms, observe o tamanho ea forma variáveis do EPSCs. Para uma descrição pormenorizada das características EPSC ver 4. B. Dois EPSCs marcados em A (#: multifásica, o: monofásico) mostrado em escala ampliada: Escala 100 pA, 1 ms.

Figura 4. Gravação simultânea de um IHC e contatando bouton aferentes em um órgão de ratos excisada de Corti, dia pós-natal 10 (ver também 2). Um passo de tensão despolarizantes do IHC provoca liberação do neurotransmissor e ativa EPSCs na bouton aferentes traço superior:. Protocolo de tensão para a despolarização IHC. Segurando potencial: -79 mV, 50 ms passo para -29 mV trace Médio:. L-type Ca 2 + correntes gravado a partir do IHC normalmente apresentam inativação pouco e ativar a potenciais negativos traço inferior:. Correntes Synaptic na fibra aferente em resposta à despolarização IHC. Observe a depressão sináptica durante a 50 despolarização IHC ms.

Figura 5. A. Gravar Exemplar extracelular de um bouton aferentes no dia pós-natal 21. Este foi gravado no quarto temperatura, com 5,8 mM K + extracelular. Esta gravação tem um sinal típico de ruído para uma gravação em uma preparação de um rato de três semanas de idade. B. Forma de onda média para eventos extracelular gravados de um bouton P20 aferentes. Esta é a forma de onda média de 10.272 eventos.

Esquemática 1. Cruz visão seccional através de um turno de uma cóclea de ratos ilustrando a relação anatômica entre as células ciliadas externas e internas, o gânglio espiral, estria vascular e membrana tectorial.
Discussion
O passo crítico neste procedimento é a dissecção. Se o tecido é esticado ou danificados durante a dissecção, fibras aferentes não vai sobreviver. Tecidos de ratos mais jovens é mais elástica e de perdão. Nós encontramos que os dias pós-natal 10-11 são os mais fáceis de dissecar e experimentos têm maiores taxas de sucesso. Um grau significativo de maturação coclear ocorre após o nascimento, com os ratos começam a ouvir de todo dia pós-natal 12 14. Portanto, na idade em que a dissecção é mais fácil, as sinapses podem não ser totalmente maduro 4.
A dissecção descrita aqui para ratos é essencialmente o mesmo para os ratos, a principal diferença é o tamanho menor da cóclea do rato. Esta técnica permite que as propriedades de sinapses fita para ser examinado em camundongos modificados transgenicamente 15. Alterações posteriores a esta técnica são: a adição de um corante fluorescente para a solução intracelular para fibras rótulo 3; gravações emparelhado com o pré-sináptica das células ciliadas internas e bouton aferentes pós-sináptica, permitindo que a função de transferência entre pré e pós-sináptica de células a ser determinado 2 e loose- selo gravações extracelular em boutons aferentes para evitar a perda da integridade celular. A configuração de gravação extracelular é mais fácil de atingir do que toda a configuração de células e experimentos são geralmente mais duradouros.
Disclosures
Não há conflitos de interesse declarados.
Acknowledgments
Este trabalho foi financiado por um Surdez Research Foundation Research Grant para EY e NIDCD DC006476 para EG e por NIDCD DC005211 com o Centro de Audição e Equilíbrio, Johns Hopkins University. Arte copyright Tim Phelps, Johns Hopkins University.
LG escreveu o manuscrito inicial; EY e LG filmado na dissecção e na gravação. Todos os autores forneceram valores exemplar e contribuiu para escrever o manuscrito.
Materials
| Name | Company | Catalog Number | Comments |
| Air table | TMC | ||
| Gibraltar Stage with xy-table | Burleigh | ||
| Axioscope FS2 upright microscope DIC optics Green filter | Carl Zeiss, Inc. | ||
| Newvicon camera with controller | Dage | ||
| Monitor | Dage | ||
| Multiclamp 700B (or similar) | Molecular Devices | ||
| Digidata 1322A (or similar) | Molecular Devices | ||
| Manipulator MP285 | Sutter Instrument Co. | ||
| 6-channel valve application system for local perfusion (used with hand made perfusion pipettes) | Warner Instruments | ||
| PC with acquisition software (PClamp) | Molecular Devices | ||
| Above is the equipment in our electrophysiological setups used for recording from afferent terminals. | |||
References
- Glowatzki, E., Fuchs, P. A. Transmitter release at the hair cell ribbon synapse. Nat Neurosci. 5 (2), 147-154 (2002).
- Goutman, J. D., Glowatzki, E. Time course and calcium dependence of transmitter release at a single ribbon synapse. Proc Natl Acad Sci U S A. 104 (41), 16341-16346 (2007).
- Yi, E., Roux, I., Glowatzki, E. Dendritic HCN channels shape excitatory postsynaptic potentials at the inner hair cell afferent synapse in the mammalian cochlea. J Neurophysiol. 103 (5), 2532-2543 (2010).
- Grant, L., Yi, E., Glowatzki, E. Two modes of release shape the postsynaptic response at the inner hair cell ribbon synapse. J Neurosci. 30 (12), 4210-4220 (2010).
- LoGiudice, L., Matthews, G. The role of ribbons at sensory synapses. Neuroscientist. 15 (4), 380-391 (2009).
- Singer, J. H. Coordinated multivesicular release at a mammalian ribbon synapse. Nat Neurosci. 7 (8), 826-833 (2004).
- Keen, E. C., Hudspeth, A. J. Transfer characteristics of the hair cell's afferent synapse. Proc Natl Acad Sci U S A. 103 (14), 5537-5542 (2006).
- Li, G. L. The unitary event underlying multiquantal EPSCs at a hair cell's ribbon synapse. J Neurosci. 29 (23), 7558-7568 (2009).
- Singer, J. H., Diamond, J. S. Vesicle depletion and synaptic depression at a mammalian ribbon synapse. J Neurophysiol. 95 (5), 3191-3198 (2006).
- Suryanarayanan, A., Slaughter, M. M. Synaptic transmission mediated by internal calcium stores in rod photoreceptors. J Neurosci. 26 (6), 1759-1766 (2006).
- Neef, A. Probing the mechanism of exocytosis at the hair cell ribbon synapse. J Neurosci. 27 (47), 12933-12944 (2007).
- Tritsch, N. X. The origin of spontaneous activity in the developing auditory system. Nature. 450 (7166), 50-55 (2007).
- Kros, C. J., Ruppersberg, J. P. Expression of a potassium current in inner hair cells during development of hearing in mice. Nature. 394 (6690), 281-284 (1998).
- Muller, M. Developmental changes of frequency representation in the rat cochlea. Hear Res. 56 (1-2), 1-7 (1991).
- Seal, R. P. Sensorineural deafness and seizures in mice lacking vesicular glutamate transporter 3. Neuron. 57 (2), 263-275 (2008).



