Summary
Memeli koklea iç saç hücresi şerit sinaps işitsel sinir lifi dendritler Tüm hücre yama klemp kayıtları.
Abstract
Iç saç hücresi (İHK) ve işitsel sinir lifi arasındaki afferent sinaps tek bir şerit sinaps 1-4 postsinaptik aktivite kayıt için elektrofizyolojik erişilebilir bir site sağlar. Şerit duyu hücreleri sinaps sürekli nörotransmitter serbest IHC membran potansiyeli 5 kademeli değişikliklere yanıt olarak modüle oranı. Şerit sinaps genlikleri 1, 4, 6-11 değişen eksitatör postsinaptik akımlar (EPSCs) uyandırmak için aynı anda birden fazla veziküller serbest olabilir multivesicular açıklaması, faaliyet gösterilmiştir . Presinaptik şerit, ne multivesicular serbest altında yatan mekanizma rol şu anda iyi anlaşılır ne.
IHC 10-20 işitsel sinir lifleri, tek bir şerit sinaps oluşturmak için biten bir miyelinsiz tek ve her fiber iletişim IHC tarafından innerve. Afferent BOUTONS iletişime IHCs (çapı yaklaşık 1 mikron) küçük boyutlu, kayıtları yapılacak olağanüstü temporal çözünürlük sağlar. Ayrıca, teknik sinaps transfer fonksiyonu doğrudan 2 incelenecektir sağlayan, hem de pre-ve postsinaptik hücreler aynı anda kayıt için adapte edilebilir . Bu yöntem, bu nedenle multivesicular serbest bırakma, duyu hücreleri şerit zor fonksiyonu, sinir iletiminin temel yönlerini ele olabilir hangi bir araç sağlar.
Protocol
1. Çözümler
- Çözümler önceden hazırlanmış olabilir. Ekstrasellüler çözümleri, bir ay kadar 4 ° C'de saklanabilir. Iç çözüm alikotları (-20 ° C) dondurularak saklanabilir. Çözümleri, deney başlamadan önce oda sıcaklığında olduğundan emin olun.
- Diseksiyon çözüm ve ekstrasellüler kayıt çözeltisi (mM): 5.8 KCl, NaCl 144; 0.9 MgCl 2; 1.3 CaCl 2; 0.7 NaH 2 PO 4, 5.6 glukoz, 10 Hepes; 1 Na piruvat, pH 7.4 (NaOH), 300 mOsm . İHK Ca 2 + mevcut izolasyon ekstraselüler çözüm gösterildiği gibi değiştirilebilir: 5.8 KCl, NaCl 114; 0.9 MgCl 2; 1.3 CaCl 2; 0.7 NaH 2 PO 4, 5.6 glikoz; 10 Hepes; 30 ÇAY Cl; pH 7.4 ( NaOH ); 300 mOsm.
- 1-2 mcM tetrodotoxin (TTX) voltaj kapılı sodyum kanalları, eksitatör postsinaptik akımları veya potansiyelleri (EPSCs veya EPSPS) blok ve izole etmek için ekstrasellüler çözüm eklenebilir.
- Hücre içi kayıt çözümü (mM): 20 KCl; 110 K-methanesulfonate 5 MgCl 2, 0.1 CaCl 2, 5 EGTA; 5 Hepes; 5 Na 2 ATP 0,3 Na 2 GTP; 5 Na 2 phoshocreatine; pH 7,2 (KOH), 290 mOsm; veya 135 KCl, 3.5 MgCl 2; 0,1 CaCl 2; 5 EGTA; 5 Hepes; 4 Na 2 ATP 0,2 Na 2 GTP; pH 7,2 (KOH), 290 mOsm. Hücre içi bir çözüm için İHK Ca 2 + mevcut izolasyon: 135 CsMeSO3; 13 ÇAY Cl 3.5 MgCl 2; 2.5 Na 2 ATP, 1 EGTA; pH 7,2 (CsOH); 290 mOsm. Bu çözüm, çok daha büyük bir K + conductances Ca 2 bırakarak + güncel kalan önemli bir miktar engeller .
2. Dissected Doku Tutucular
- Modifiye lamelleri kayıtları hazırlanması sırasında yerinde tutmak için kullanılır, ayrıca önceden hazırlanmış olabilir.
- Sylgard (Dow Corning, Midland, MI), dairesel bir cam lamel (8-12 mm) kenarına doğru bir damla uygulayın. Lamel ince bir böcek pin (FST, öğe 26.002-10) kalın ucunu yerleştirin. Böcek pin bardak forseps ile sıkıca tutun ve sylgard ayarlamak için ısıtmalı bobin yakın tutun.
3. Elektrotlar yapma
- Deneysel her gün taze elektrotlar ve hava geçirmez bir kutuya saklayın hazırlayın. Her hazırlanması için on ile yirmi elektrotlar üretmektedirler.
- Elektrot cam seçin; 1 mm borosilikat cam kapilerleri (TEFE, Sarasota, FL 1B100F-4).
- Bir ucu çapı yaklaşık 2-3 mikron (M ~ 6 Yukarıda açıklanan çözümler) elektrotlar çekmek için bir çok adım çektirmenin bir program tasarlayın. Biz bir Sutter P-87 multi-step yatay çektirmenin veya Narishige dikey PC-10 çektirmesi kullanın.
- Dikkatle kat olarak Sylgard elektrot şaft ucu mümkün olduğu kadar yakın. Bu pipet kapasitans ve en aza indirir kayıt gürültü azalır.
- Yangın lehçe TEFE o mevcut olarak ısıtılmış bir filament microforge kullanarak elektrotlar. Yangın cilalı elektrotlar, bir dış ucu çapı yaklaşık 1 mikron (yukarıda açıklanan çözümler M 10-15) olmalıdır. Pipet duvar kalınlığı yaklaşık 1 / 3 mm. Dış çapı yamalı afferent bouton boyutu hakkında sahiptir.
- Eşzamanlı kayıtlar uygulanması halinde: IHC pipet yangın parlatma ~ 3 mikron (6 - 8 M) daha büyük bir ucu çapı terk etmesi gerektiğini ayrım ile, aynı şekilde (aynı cam, aynı çekme programı) inşa edilmelidir.
4. Deney Kurma
- Ekstraselüler çözüm ve ilaç ya da ilgi toksinler içeren test çözümleri ile yerçekimi beslenen perfüzyon sistemine bağlı odaları doldurun.
- O banyo hacmi yaklaşık 2 ml böylece perfüzyon ayarlayın, sürekli sipariş üzerine 1.5 mL dk-1 hızında serpmek.
- Farklı çözümler yerel bir perfüzyon sistemi ile deney sırasında uygulanacak ise, çözüm rezervuarlarının doldurun. Sistem üzerinden çözümler çalıştırın ve hiç hava kabarcığı olmadığından emin olmak.
5. Diseksiyon ve Numune Hazırlama
- İlişikteki film, üç hafta önceki doğum sonrası aşamalarında daha zor yaşlı sıçanlar (Sprague Dawley, Charles Nehri), Corti organı diseksiyonu göstermektedir. Tartışmaya farklı yaşlarda sıçanlardan alınan kayıt avantajları ve dezavantajları gözden geçirildi.
- Derinden izofluran inhalasyonu ile sıçan uyuşturan. Çekilme refleksleri ve kornea refleksleri ciddi Depresyonda olduğunuz zaman, başını kesmek. Bu prosedürler, Johns Hopkins Üniversitesi Hayvan Bakım ve Kullanım Kurulu tarafından onaylanmıştır.
- Dekapite baş burnu ve cilt çıkarın. Baş Çentikli ve beynin temporal kemikleri açığa çıkarmak.
- Temporal kemik ve yerde her iki standart ekstrasellüler çözüm içeren temiz diseksiyon yemekler çıkarın.
- Kaldırmakkoklea maruz şekilde kemik temporal kemik encapsulating. Temporal kemik üssünde bir çift forseps ile güvenli bir şekilde tutun. Yuvarlak ve oval pencere tanımlayın. Oval pencere ve koklea yüz yukarı spirallenen tarafında ve koklea çevresinde aşırı kemik kaldırmak böylece koklea yolunuzu.
- Apikal bobin, deney için kullanılan korumak için özen koklea duyu epitel maruz encapsulating kemik çıkarın. Kemik geri kalanından daha şeffaf alan ile başlayan, doğrudan koklea kapalı kemik parçasından ince forseps ikinci bir çifti kullanın. Burada kemik ince ve kaldırmak kolay. Apikal bobin etrafında kemik kaldırmaya devam edin.
- Apikal dönüş altında modiolus kesti mikro diseksiyon makas kullanın. Sonra kokleanın düşük döner apikal dönüş bağlantısını kesin.
- Apikal da tamamen kesilmiş olduğundan emin olmak için, gerekirse, yine mikro diseksiyon makas kullanın. Apikal bobin korumak için dikkat edin; çekti ya da gergin olmamalıdır. Koklea geri kalanından apikal dönüş koaksiyel ince pens kullanın.
- Apikal dönüş her iki tarafın kemik kalan çıkarın.
- Stria vascularis doku, saç hücresi bölgedeki (Şematik 1) dışında yer alan parlak bir şerit dikkatlice çıkarın. Kolayca stria vascularis ile birlikte müstakil hale gelebilir duyusal saç hücreleri, kaldırma önlemek için emin olun.
- Ince forseps örtü membran, duyusal saç hücreleri üzerinde oturur, parlak, yarı saydam bir zar ayırmak için kullanın.
- Şimdi aşırı doku ve kemik düzeltme ve forseps ile hazırlık düzleştirmek. Bu doku, bir iğne altında eşit yerleştirilir, böylece gerekli.
- Pin altında lamel (önceden hazırlanmış) bağlı bakımı, saç hücreleri uzak pin konumuna hazırlık yerleştirin.
- Forseps kayıt odasına lamel aktarmak için kullanın. Koklear doku tamamen lamel transfer ederken ekstrasellüler çözüm bir damla ile kaplı olduğundan emin olun. Kayıt sırasında hareket etmez emin odasının cam alt lamel üzerine sıkıca bastırın.
- Hemen hazırlanması daha iyi bir yaşam sağlamak için, ekstrasellüler solüsyonu ile perfüzyon başlar.
6. Kayıt
- 10x ve 40x suya daldırma DIC hedefleri kullanarak mikroskop göz mercekleri ile hazırlık bulun. Kayıt elektrotları IHC lateral duvara dikey olarak IHCs yaklaşım böylece hazırlık yolunuzu.
- Hazırlık IHCs bazal bölgedeki görünürlüğü sınırlayan kıvrılmışsa, IHCs kendileri basarak özen, cam lamel karşı hazırlık dış kenarı aşağı itmek için bir kayıt elektrodu kullanmak.
- * Bu aşamada, genç sıçan kullanarak, saç hücreleri üzerinde hücre destekleyen kalın bir tabaka duyu hücreleri 1, 12 erişmek için bir temizlik pipet (~ 10-20 mm bir ucu çapı) ile temizlenebilir olabilir .
- Dokusunun sağlıklı olup olmadığını değerlendirmek için monitörün kullanın. Mikroskop ve NC70 Newvicon kamera arasında bir 4X büyütme lens ile görüntü ve projeler mikron 2 monitör 4800 hakkında bir alanı daha da büyütür . Saç hücreleri sağlam saç demetleri ile uzun olmalıdır. Doku bozulduğunda, saç hücrelerinin şişmesine ve daha şeffaf ve grenli.
- IHCs tabanı etrafında afferent BOUTONS Localize. BOUTONS, yaklaşık 1 mikron çapında yuvarlak veya elips ve renkli parlak bir görünüm ışık vardır. BOUTONS çoğunluğu çekirdeğin seviyesinin altında lokalizedir. Doku sağlıksız BOUTONS oldukça parlak değil, normal boyutunun yaklaşık 4 kez şişer ve şeffaf olmak.
- Hücre içi bir çözüm ile kayıt elektrodu doldurun, pozitif basınç uygulayın ve mikromanipülatör hazırlanması manevra elektrot kullanmak.
- Elektrot ile İHK tabanı düzeyinde hazırlanması bir kesi olun. IHCs baz alan bir erişim yolu sahte pozitif basınç kullanarak, hücreler ve IHCs destekleyen ince bir tabaka arasındaki elektrot itin. Bu adım, afferent bouton ulaşan ve afferent sonlar sıkıca ensheath hücreleri destekleyici kayıt için değil "anahtar".
- Elektrot dikkatlice çıkarın ve taze dolu bir elektrot ile değiştirin.
- İHK membran temiz bir erişim delikten elektrot ucu, manevra elektrot korumak için pozitif basınç kullanma. Pozitif basınç IHCs saran destekleyici hücrelerin etrafındaki hareketli yardımcı olmalıdır.
- Eşlik eden filmde gösterildiği gibi afferent bouton (doğru bitişik destekleyici hücrelerin etrafındaki elektrot taşıyın. Alternatif bir yaklaşım, hareket eden bir afferent bouton yaklaşımuzun IHC membran elektrot ucu kadar) bouton dokunur. Elektrot ucu (hala bouton ve pipet pozitif basınç nedeniyle elektrot arasında küçük bir boşluk var) afferent bouton önünde olduğundan emin olun. BOUTONS pipet hareketine destek hücreleri ve İHK membran daha fazla direnç sunar; deneyci tarafından "hissedilir" olabilir.
- Pipet ve aşağı yukarı hareket ettirin ve emin olun ki bouton hamle itin. Bu pipet ve bouton aynı Z-düzleminde olduğunu gösterir.
- Afferent bouton karşı bastırdı elektrot ile aynı anda bırakın ve pozitif basınç emme GΩ bir mühür formu için geçerli. Afferent bouton bir GΩ mühür oluşumu bir saç hücresi üzerine benzer. Seal oluşumu hızlı ya da yavaş yavaş ortaya çıkabilir.
- Membran rüptürü emme elektrot içinde nazik patlamaları uygulayın ve tüm hücre kayıt yapılandırma girmek.
- Yamalı bir afferent bouton hücre ise, küçük kapasitif transientler (bkz. Şekil 1), sızdırmazlık oluşumu sırasında izlenen test kare dalga görünecektir. 1.8 pF (3, 4) - Biz, 0.4 olarak afferent biten kapasitans tahmin etmektedir . Yamalı hücre IHC ise, geçici sipariş üzerine erişim direnç bağlı olarak 3-5 kat daha büyük olacaktır.
- Hücrenin bir afferent bouton olduğunu onaylamak için, gerilim adımları hiperpolarizan ve depolarizan ile bir protokol çalıştırın. Afferent lifleri ve IHCs (afferent bouton için amaçlayan çoğu zaman yanlışlıkla yamalı) için geçerli gerilim ilişkileri (IVs) bireysel hücre türleri için karakteristik ve Şekil 2'de gösterilmiştir.
- Membran potansiyeli Monitör; bir afferent lif, -60 ile -65 mV civarında normalde.
- Taze dolu bir elektrot ile 13 - hücre afferent bouton değilse, elektrot ve adımları tekrarlayın 8 kaldırmak. Her girişimi için yeni bir elektrot kullanın.
- Monitör seri direnç mühür kadar kapanış olmadığı sağlamak için gerilim adımları uygulayarak kayıt boyunca. Seri direnç artarsa, emme hafif darbeler uygulamak ya da geriye doğru hafifçe elektrot hareket etmek yararlı olabilir. Serisi dirençleri M tipik olarak 30 civarında. Sinaptik aktivite analiz ederken, biz daha büyük M 50 serisi dirençler ile kayıtlar atın.
- Artık (bkz. Şekil 3), sinaptik aktivite kaydedebilirsiniz. Ya afferent lif spontan aktivite gösterir, ya da saç hücresi verici sürümü etkinleştirmek için depolarize olması gerekir. Yüksek potasyum konsantrasyonu (örneğin 40 mM) ile ekstrasellüler bir çözümü uygulayarak saç hücre depolarize ve verici sürümü oranı genellikle etkinleştirmek veya artırmak.
- IHCs ve afferent BOUTONS 2 eş zamanlı kayıtları için, prosedür şu şekilde değiştirilmelidir: 1 - 5 için adımlar ile devam edin . Karşılık gelen hücre içi Ca 2 çözüm + mevcut izolasyon IHC pipet doldurun ve 6 da gösterildiği gibi uygulayın. Kaydedilmelidir IHC yakın "bekleme pozisyonu" IHC kayıt için pipet bırakın. 14 afferent kayıt için adım 6 ile devam edin. Afferent pipet tüm hücre yapılandırması olduğunda IHC pipet ile devam ediyor. Ilgili IHC lateral duvara doğru manevra ikinci pipet, her zaman pozitif basınç sağlamak. İHK, basınç yoluyla lateral duvara bir girinti ve destekleyici hücrelerin ayrılmış olduğunu sağlanmalıdır. Adımlar 12 - 13 sıra IHC için uygulanabilir. Afferent lif göre, 14 belirtilen, büyük kapasitif transientler karakteristik IV ilişkiye ek olarak, bir IHC kayıt bir işaretidir. İHK yıkamak için hücre içi çözümler için bir kez eş zamanlı kayıtları, bir süre (5 dk, 3) seri direnç bağlı olarak izin verilmelidir kurulur. Bu büyük Ca 2 +, çok büyük bir K + conductances artan blok nedeniyle akımlar neden olacaktır.
- GΩ mühür yerine gerçekleştirmek için adım 12, ekstraselüler kayıtları gevşek mühür, afferent bouton üzerine M 30 ila 50 gevşek bir mühür. Bu pozitif basınç serbest iken daha az emme uygulayarak elde edilebilir. P21 sıçan afferent bouton ekstraselüler kayıt bir örnek için Şekil 5'e bakınız.
7. Sorun Giderme
- Mühürler oluşmuş olabilir, ancak tüm hücre hücre bağlı kayıt geçişi elde edilemez, pipet iç çapı çok dar olabilir.
- Sızdırmaz oluşan mümkün değilse, pipet iç çapı çok büyük olabilir ve tüm bouton elektrot içine kadar emdi olabilir.
- Sinaptik tüm olaylar, küçük ve düzgün ise, kayıt afferent ekstrasellüler olabilir. Testi pozitif membran potansiyelleri olayların iptali için intraselüler kaydedildiEPSCs olumlu potansiyelleri tersine dönecektir.
- Eğer seri dirençler sürekli yüksek yama afferent terminallerde, tüm hücre yapılandırması içine kırmaya çalışmadan önce geriye pipet hareket çalıştığınızda. Bu pipet tıkanma ve yüksek erişim direnci önlemeye yardımcı olur.
- Korkusuzca pipet pozisyonu düzeltilmelidir. Afferent mühür "kaybetme" olmadan, yüksek direnci veya pipet tıkanma azaltmak için elektrot taşımak mümkündür. İHK, eş zamanlı kayıt kuruluşu sırasında, genellikle bouton doğru itti '. Afferent pipet konumu buna göre düzeltilir.
8. Temsilcisi Sonuçlar
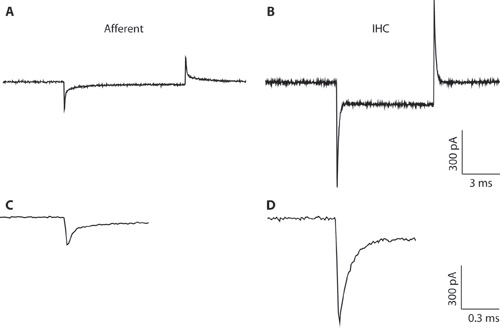
Şekil 1. AB. Tipik transientler bir 10 mV -94 mV bir holding gerilim gerilim komut hiperpolarizan yanıt afferent lif (A) ve İHK (B) kaydetti. , Dar pipet çaplı ve yüksek erişim direnci, İHK kayıt nedeniyle tüm hücre IHC kayıt için suboptimal (B). Kayıt sadece IHCs ve afferent lifleri kapasitif transientler arasındaki farkı göstermek için burada gösterilir. Bu tam hücreli yapılandırma oluşturan hücre tipleri ayırt etmek için yardımcı olabilir. IHCs tam hücreli kapasitif transientler afferent liflerin daha genlik 5 kat daha büyük sipariş üzerine CD. A & B Geçici genişletilmiş bir zaman çizelgesi üzerinde gösterilir. C. afferent yanıt çürüme iki üstel uygun olabilir. Afferent bitiş kapasitans hızlı bileşeni tahmin edilmiştir.

Şekil 2 IV afferent bouton (A) ve (B) bir IHC ilişkiler. IV ilişkiler bir holding potansiyeli -84 mV ile -124 mV 10 mV aralıklarla (nominal gerilimleri) + 36 mV gerilim adımları kayıt altına alınır. Gerilimleri bazı izleri sağ gösterilmiştir. Bu kayıtlar, 5.8 mM ekstrasellüler KCl ile oda sıcaklığında yapılmıştır. Her ikisi için de Ölçek: 500 pA, 200 ms.
19 postnatal günde bir afferent lif IV ilişkiler. EPSCs gerilim adımları çoğunluğu sırasında; EPSCs 6 mV pozitif ters. Bu kayıt, voltaj kapılı Na + akımları engellemek için TTX huzurunda gerçekleştirildi . Hiperpolarizan gerilimleri (I h) yavaş aktive içe akım unutmayın. Bu akım IHCs veya destekleyici hücrelerin mevcut değildir ve kaydedilen hücre afferent lif (3) B iyi bir gösterge sağlar. P19 IHC IV ilişkiler. Dar pipet çapı ve yüksek erişim direnci nedeniyle, kayıt IHC akımlar ve akımlar beklenenden daha küçük karakterize için suboptimal. Kayıt sadece bir afferent lif kayıt çalışıldığında açıkça ayırt edilebilecek IHCs ve afferent lifleri IV ilişkileri göstermek için burada gösterilir. Not gecikmiş düzeltici K + akımları 13 olumlu potansiyeller (ok) hızlı aktive dışa K + akımları.

Şekil 3 IHC serbest bırakma oranını artırmak için 40 mM ekstrasellüler K + varlığında doğum sonrası 21. günde bir afferent lif kaydedilen timsalimiz sinaptik akımlar. TTX oda sıcaklığı, voltaj kapılı Na + akımları engellemek için uygulanan bir. Ölçek 200 pA, 5 ms, EPSCs değişken boyutu ve şekli dikkat edin. EPSC özellikleri ayrıntılı bir açıklama için: 4 B. A (: multifazik, o: # monofazik) işaretli iki EPSCs genişletilmiş bir ölçekte gösterilir: Ölçek 100 pA, 1 ms.

Şekil 4 Eşzamanlı bir IHC Corti, doğum sonrası 10. günde (2) eksize sıçan organ afferent bouton başvurarak kayıt ve İHK depolarizan gerilim adım nörotransmitter salınımı kışkırtır ve afferent bouton EPSCs aktive Üst izleme: IHC depolarizasyon için gerilim protokol. Holding potansiyeli -79 mV, 50 ms adım -29 mV Orta iz: L-tipi Ca 2 + IHC kaydedilen akımları genellikle küçük inaktivasyon göstermek ve negatif potansiyeller etkinleştirmek Alt iz: yanıt olarak afferent lif Synaptic akımları İHK depolarizasyon. 50 ms IHC depolarizasyon sırasında sinaptik depresyon unutmayın.

Şekil 5. A doğum sonrası 21. günde bir afferent bouton timsalimiz ekstraselüler bir kayıt. Bu oda sıcaklığında kaydedildi5.8 mM ekstrasellüler K + ile Ture. Bu kayıt, üç haftalık sıçan bir hazırlık içinde kayıt için gürültü oranı tipik bir sinyal B . P20 afferent bouton kaydedilen ekstraselüler olaylar için ortalama dalga şekli. 10272 olaylardan ortalama dalga.

Şematik 1, iç ve dış saç hücreleri, spiral ganglionlar, stria vascularis ve örtü zarı arasındaki anatomik ilişkiyi gösteren bir sıçan koklea bir dönüş yoluyla Cross kesit .
Discussion
Bu yordamın kritik adım diseksiyonu. Doku diseksiyonu sırasında uzatılmış veya bozuksa, afferent liflerin hayatta olmaz. Genç sıçanların Doku daha esnek ve bağışlayıcı. Biz doğum sonrası 10 ila 11 gün incelemek için kolay ve deneyler daha yüksek başarı oranlarına sahip olduğunu bulabilirsiniz. Önemli bir derecede koklear olgunlaşma 12 14 postnatal günde dört bir yanından gelen duymak başlayan sıçanlarda, postnatal dönemde oluşur. Bu nedenle, yaş diseksiyonu kolay olduğu, sinaps 4 tam olgun olmayabilir.
Sıçanlar için burada açıklanan diseksiyonu aslında fare, fare koklea daha küçük boyutta olan temel fark için aynıdır. Bu teknik transgenically değiştirilmiş fareler 15 incelenmek üzere şerit sinapsların özellikleri sağlar. Bu tekniğin daha fazla değişiklikler şunlardır: floresan boya etiket lifleri 3 hücre içi bir çözüm ekleyerek; presinaptik iç saç hücresi ve postsinaptik afferent bouton ile eşleştirilmiş kayıtları, pre ve post sinaptik hücreleri arasındaki transfer fonksiyonu 2 belirlenecek sağlayan ve gevşek afferent BOUTONS ekstrasellüler kayıtları hücresel bütünlük kaybını önlemek için mühür. Ekstraselüler kayıt yapılandırma ulaşmak için bütün hücre yapılandırması daha kolaydır ve deneyler genellikle daha uzun ömürlü.
Disclosures
Çıkar çatışması ilan etti.
Acknowledgments
Bu çalışma EY Sağırlık Araştırma Vakfı Araştırma Fonu tarafından desteklenen ve NIDCD DC005211 İşitme ve Denge Merkezi, Johns Hopkins Üniversitesi EG ve DC006476 NIDCD oldu. Artwork telif hakkı Tim Phelps, Johns Hopkins Üniversitesi.
LG, ilk el yazması yazdı, EY ve LG diseksiyonu ve kayıt çekildi. Tüm yazarlar timsalimiz rakamlar ve yazının yazma katkıda bulunmuştur.
Materials
| Name | Company | Catalog Number | Comments |
| Air table | TMC | ||
| Gibraltar Stage with xy-table | Burleigh | ||
| Axioscope FS2 upright microscope DIC optics Green filter | Carl Zeiss, Inc. | ||
| Newvicon camera with controller | Dage | ||
| Monitor | Dage | ||
| Multiclamp 700B (or similar) | Molecular Devices | ||
| Digidata 1322A (or similar) | Molecular Devices | ||
| Manipulator MP285 | Sutter Instrument Co. | ||
| 6-channel valve application system for local perfusion (used with hand made perfusion pipettes) | Warner Instruments | ||
| PC with acquisition software (PClamp) | Molecular Devices | ||
| Above is the equipment in our electrophysiological setups used for recording from afferent terminals. | |||
References
- Glowatzki, E., Fuchs, P. A. Transmitter release at the hair cell ribbon synapse. Nat Neurosci. 5 (2), 147-154 (2002).
- Goutman, J. D., Glowatzki, E. Time course and calcium dependence of transmitter release at a single ribbon synapse. Proc Natl Acad Sci U S A. 104 (41), 16341-16346 (2007).
- Yi, E., Roux, I., Glowatzki, E. Dendritic HCN channels shape excitatory postsynaptic potentials at the inner hair cell afferent synapse in the mammalian cochlea. J Neurophysiol. 103 (5), 2532-2543 (2010).
- Grant, L., Yi, E., Glowatzki, E. Two modes of release shape the postsynaptic response at the inner hair cell ribbon synapse. J Neurosci. 30 (12), 4210-4220 (2010).
- LoGiudice, L., Matthews, G. The role of ribbons at sensory synapses. Neuroscientist. 15 (4), 380-391 (2009).
- Singer, J. H. Coordinated multivesicular release at a mammalian ribbon synapse. Nat Neurosci. 7 (8), 826-833 (2004).
- Keen, E. C., Hudspeth, A. J. Transfer characteristics of the hair cell's afferent synapse. Proc Natl Acad Sci U S A. 103 (14), 5537-5542 (2006).
- Li, G. L. The unitary event underlying multiquantal EPSCs at a hair cell's ribbon synapse. J Neurosci. 29 (23), 7558-7568 (2009).
- Singer, J. H., Diamond, J. S. Vesicle depletion and synaptic depression at a mammalian ribbon synapse. J Neurophysiol. 95 (5), 3191-3198 (2006).
- Suryanarayanan, A., Slaughter, M. M. Synaptic transmission mediated by internal calcium stores in rod photoreceptors. J Neurosci. 26 (6), 1759-1766 (2006).
- Neef, A. Probing the mechanism of exocytosis at the hair cell ribbon synapse. J Neurosci. 27 (47), 12933-12944 (2007).
- Tritsch, N. X. The origin of spontaneous activity in the developing auditory system. Nature. 450 (7166), 50-55 (2007).
- Kros, C. J., Ruppersberg, J. P. Expression of a potassium current in inner hair cells during development of hearing in mice. Nature. 394 (6690), 281-284 (1998).
- Muller, M. Developmental changes of frequency representation in the rat cochlea. Hear Res. 56 (1-2), 1-7 (1991).
- Seal, R. P. Sensorineural deafness and seizures in mice lacking vesicular glutamate transporter 3. Neuron. 57 (2), 263-275 (2008).



