Summary
Whole-cell patch-clamp opnamen van auditieve zenuw vezel dendrieten in de binnenste haarcel lint synaps in het zoogdier slakkenhuis.
Abstract
De afferente synaps tussen de binnenste haarcel (IHC) en de gehoorzenuw vezel biedt een elektrofysiologische toegankelijke site voor het opnemen van de postsynaptische activiteit van een enkele band synaps 1-4. Lint synapsen van sensorische cellen vrijkomen neurotransmitter continu, waarvan het tarief wordt gemoduleerd in reactie op gegradeerde veranderingen in IHC membraanpotentiaal 5. Lint synapsen is aangetoond dat ze werken door multivesiculaire release, waar meerdere blaasjes tegelijkertijd kunnen worden vrijgegeven aan prikkelende postsynaptische stromingen (EPSCs) van verschillende amplitudes 1, 4, 6-11 oproepen. Noch de rol van de presynaptische lint, noch het mechanisme achter multivesiculaire release is op dit moment goed begrepen.
De IHC wordt geïnnerveerd met 10-20 gehoorzenuw vezels, en elke vezel contact op met de IHC met een niet-gemyeliniseerde enkele einde aan een lint synaps te vormen. De geringe omvang van de afferente boutons contact op te nemen iHCS (ongeveer 1 micrometer in diameter) maakt opnamen met een uitzonderlijke temporele resolutie worden gemaakt. Bovendien kan de techniek worden aangepast aan gelijktijdig opnemen van zowel de pre-en postsynaptische cellen, waardoor de transfer functie op de synaps om direct twee bestudeerd worden. Deze methode geeft daarom een middel waarmee de fundamentele aspecten van neurotransmissie kan worden bestudeerd, van multivesiculaire vrij te geven aan de ongrijpbare functie van het lint in zintuigcellen.
Protocol
1. Oplossingen
- Oplossingen kunnen worden bereid op voorhand. Extracellulaire oplossingen kunnen worden opgeslagen bij 4 ° C gedurende maximaal een maand. Hoeveelheden van interne oplossing kan worden bewaard bevroren (-20 ° C). Zorg ervoor dat oplossingen op kamertemperatuur zijn alvorens experimenten.
- Ontleden oplossing en extracellulaire oplossing (mm): 5,8 KCl, 144 NaCl, 0,9 MgCl 2, 1,3 CaCl 2; 0,7 NaH 2 PO 4, 5,6 glucose, 10 HEPES, 1 Na pyruvaat, pH 7,4 (NaOH), 300 mOsm. Voor IHC Ca 2 + huidige isolatie van de extracellulaire oplossing kan worden aangepast zoals aangegeven: 5,8 KCl, 114 NaCl, 0,9 MgCl 2, 1,3 CaCl 2; 0,7 NaH 2 PO 4, 5,6 glucose, 10 HEPES, 30 TEA Cl, pH 7,4 (NaOH ); 300 mOsm.
- 1-2 uM tetrodotoxine (TTX) kan worden toegevoegd aan de extracellulaire oplossing voor spanningsgevoelige natriumkanalen blokkeren en te isoleren excitatoire postsynaptische stromingen of potentials (EPSCs of EPSPS).
- Intracellulaire opname-oplossing (mm): 20 KCl, 110 K-methaansulfonaat, 5 MgCl 2, 0,1 CaCl 2, 5 EGTA, 5 HEPES; 5 Na twee ATP; 0.3 Na twee GTP, 5 Na twee phoshocreatine, pH 7,2 (KOH), 290 mOsm, of 135 KCl, 3,5 MgCl 2, 0,1 CaCl 2, 5 EGTA, 5 HEPES; 4 Na twee ATP; 0.2 Na twee GTP, pH 7,2 (KOH), 290 mOsm. Intracellulaire oplossing voor IHC Ca 2 + huidige isolatie: 135 CsMeSO3; 13 TEA Cl; 3,5 MgCl 2, 2,5 Na 2 ATP; een EGTA, pH 7,2 (CsOH), 290 mOsm. Deze oplossing zou blokkeren een aanzienlijke hoeveelheid van de veel grotere K + conductances, waardoor Ca 2 + huidige overgebleven.
2. Houders voor het maken van doorsneden Tissue
- Aangepast dekglaasjes worden gebruikt voor het opmaken van zijn plaats te houden tijdens de opnames kunnen ook worden voorbereid op voorhand.
- Breng een druppel Sylgard (Dow Corning, Midland, MI) naar de rand van een ronde glazen dekglaasje (8-12 mm). Plaats het dikke einde van een fijne insect pin (FST, art.nr. 26002-10) op het dekglaasje. Stevig vasthouden het insect pen tegen het glas met een tang en dicht bij een verwarmd spoel naar de Sylgard in te stellen.
3. Het maken van elektroden
- Bereid elektroden verse op elke experimentele dag en op te slaan in een luchtdichte doos. Fabriceren tien tot twintig elektroden voor elk preparaat.
- Selecteer elektrode glas, we gebruiken een mm borosilicaatglas haarvaatjes (1B100F-4 van WPI, Sarasota, FL).
- Ontwerp een programma op een multi-step puller om elektroden trekken met een tip diameter van ongeveer 2-3 um (~ 6 MΩ in oplossingen hierboven beschreven). We maken gebruik van een Sutter P-87 multi-step horizontale trekker of een Narishige verticale PC-10 trekker.
- Voorzichtig vacht de schacht van de elektrode met Sylgard zo dicht mogelijk bij de punt mogelijk te maken. Dit vermindert pipet capaciteit en minimaliseert het opnemen van geluid.
- Fire-polish elektroden met behulp van een microforge met een gloeidraad, zoals die beschikbaar zijn vanaf WPI. Brand gepolijste elektroden moeten een buitendiameter tip diameter van ongeveer 1 micrometer (10-15 MΩ in oplossingen hierboven beschreven). De dikte van de pipet muur is ongeveer 1 / 3 micrometer. De buitendiameter heeft ongeveer de grootte van de afferente Bouton te worden gepatcht.
- In het geval van de uitvoering van simultane opnames: IHC pipet moet worden gebouwd op dezelfde manier (zelfde glas, zelfde trekken programma), met het onderscheid dat vuur polijsten moet een grotere tip diameter van ~ 3 micrometer (6 - 8 MΩ) te verlaten.
4. Het experiment opzetten
- Vul de kamers verbonden met de zwaartekracht gevoed perfusie-systeem met extracellulaire oplossing en testen van oplossingen die drugs of giftige stoffen van belang.
- Stel perfusie zodat bad volume is ongeveer 2 ml, voortdurend perfuseren met een snelheid in de orde van 1,5 ml min-1.
- Als er verschillende oplossingen worden toegepast tijdens het experiment met een lokale perfusie-systeem, vul reservoirs met oplossingen. Ren oplossingen door middel van het systeem en ervoor te zorgen dat er geen luchtbellen.
5. Dissection en Monstervoorbereiding
- De bijhorende film illustreert de dissectie van het orgaan van Corti voor drie weken oude ratten (Sprague Dawley, Charles River), dat is moeilijker dan die van eerdere postnatale stadia. Voor-en nadelen van het opnemen van ratten van verschillende leeftijden worden besproken in de discussie.
- Diep verdoven van de rat door isofluraan inademing. Wanneer de uitslag reflexen afwezig zijn en het hoornvlies reflexen zijn zwaar depressief, onthoofden. Deze procedures zijn goedgekeurd door de Johns Hopkins University Dierverzorging en gebruik Comite.
- Verwijder de snuit en de huid van het onthoofde hoofd. Halveren van de kop en verwijder de hersenen om de tijdelijke botten bloot te leggen.
- Verwijder beide tijdelijke botten en in een schone ontleden van gerechten met standaard extracellulaire oplossing.
- Verwijderenhet bot het inkapselen van de temporale bot om zo het slakkenhuis bloot te leggen. Stevig de temporale bot aan de basis met een pincet. Identificeer de ronde en ovale ramen. Oriënteren het slakkenhuis, zodat het ovale venster en de stijgende kant van het slakkenhuis gezicht naar boven en overtollige bot te verwijderen rond het slakkenhuis.
- Verwijder het bot inkapseling van het slakkenhuis naar de sensorische epitheel bloot te leggen, en zorg ervoor dat de apicale spoel, die zal worden gebruikt voor het experiment te beschermen. Gebruik een tweede paar fijne tang tot op het bot direct chip uit het slakkenhuis, te beginnen met het gebied dat is transparanter dan de rest van het bot. Hier is de bot is dunner en makkelijker te verwijderen. Ga door het verwijderen van de bot van rond de apicale spoel.
- Gebruik micro-ontleden schaar te snijden door de modiolus onder de apicale beurt. Koppel vervolgens de apicale keren van de onderste bochten van het slakkenhuis.
- Gebruik opnieuw micro-ontleden schaar, indien nodig, om ervoor te zorgen dat de apicale beurt volledig is verbroken. Zorg ervoor dat de apicale spoel te beschermen, het mag niet worden getrokken of uitgerekt. Gebruik de fijne tang om de apicale draaien van de rest van het slakkenhuis coax.
- Verwijder de rest van het bot aan beide zijden van de apicale beurt.
- Verwijder voorzichtig de stria vascularis, de glanzende strook van weefsel buiten het haarcel regio (Schema 1). Zorg ervoor om te voorkomen dat het verwijderen van de haarcellen, die gemakkelijk kan worden losgemaakt, samen met de stria vascularis.
- Gebruik fijn pincet om de tectorial membraan, de glanzende, semi-transparante membraan dat zit boven de sensorische haarcellen los te maken.
- Trim nu overtollig weefsel en bot en plat de voorbereiding met de tang. Dit is noodzakelijk, zodat het weefsel kan gelijkmatig worden geplaatst onder een pin.
- Plaats de voorbereiding onder de pin verbonden aan een dekglaasje (eerder bereide), zorg ervoor dat de pin positie uit de buurt van de haarcellen.
- Een tang om het dekglaasje over te dragen aan de opname kamer. Zorg ervoor dat de cochleaire weefsel is volledig bedekt met een daling van extracellulaire oplossing, terwijl de overdracht van de dekglaasje aan. Druk op het dekglaasje stevig op de glazen bodem van de kamer te zorgen dat het niet beweegt tijdens de opname.
- Onmiddellijk beginnen perfusie met extracellulaire oplossing, tot een betere overleving van de voorbereidingstijd te garanderen.
6. Opname
- Zoek de voorbereiding door de microscoop oculairs met de 10x en 40x het water onderdompeling DIC doelstellingen. Oriënteren de voorbereiding, zodat de opname elektroden kan orthogonaal aanpak iHCS aan de laterale wand van de IHC.
- Indien het preparaat wordt gekruld over, het beperken van de zichtbaarheid van de basale regio iHCS, gebruik dan een registratie-elektrode naar de buitenste rand van de voorbereiding duw tegen het glas dekglaasje, zorg om te voorkomen dat het indrukken van de iHCS zelf.
- * Bij gebruik van jonge ratten, in dit stadium van de dikke laag van ondersteunende cellen boven de haarcellen kunnen worden verwijderd met een reiniging pipet (met een tip diameter van ~ 10 tot 20 micrometer) om de toegang tot de sensorische cellen 1, 12 te krijgen.
- Gebruik de monitor om te beoordelen of het weefsel gezond is. Met behulp van een 4x vergroting lens tussen microscoop en de NC70 Newvicon camera verder vergroot het beeld en de projecten die een oppervlakte van ongeveer 4800 um 2 op de monitor. Haarcellen moet worden verlengd met intacte haar bundels. Wanneer het weefsel verslechtert, haarcellen zwellen en transparanter worden en korrelig.
- Lokaliseren afferente boutons rond de basis van de iHCS. Boutons zijn sferisch of ellipsvormig, ongeveer 1 micrometer in diameter en zijn licht van kleur met een glanzend uiterlijk. De meerderheid van de boutons zijn gelokaliseerd onder het niveau van de kern. Wanneer het weefsel is ongezond boutons zwellen tot ongeveer 4 keer de normale grootte en transparant worden, in plaats van glanzend.
- Vul een registratie-elektrode met intracellulaire oplossing, toe te passen positieve druk en gebruik de micromanipulator te manoeuvreren de elektrode aan de voorbereiding.
- Maak een incisie in de voorbereiding op het niveau van de IHC basis met de elektrode. Duw de elektrode tussen de dunne laag van ondersteunende cellen en de iHCS, met behulp van de positieve druk om een toegangsweg naar het gebied aan de voet van de iHCS smeden. Deze stap is "sleutel" voor het bereiken van de afferente Bouton en voor het niet opnemen van het ondersteunen van cellen die stevig ensheath de afferente eindes.
- Verwijder voorzichtig de elektrode en het te vervangen door een vers gevulde elektrode.
- Het gebruik van positieve druk een schone elektrode tip, manoeuvreren de elektrode via de toegang gat naar het membraan van de IHC te behouden. De positieve druk moet helpen bij het bewegen de ondersteunende cellen rond de iHCS.
- Verplaats de elektrode rond aangrenzende cellen te ondersteunen richting de afferente Bouton (zoals aangegeven in de bijbehorende film. Een alternatieve benadering is om de afferente Bouton aanpak door het verplaatsen van eenlang de IHC membraan tot aan het uiteinde van de elektrode raakt het Bouton). Zorg ervoor dat de punt van de elektrode direct in de voorkant van de afferente Bouton (er is nog een kleine ruimte tussen de Bouton en de elektrode ten gevolge van de positieve druk op de pipet). Boutons bieden meer weerstand tegen beweging van de pipet dan de ondersteunende cellen en de IHC membraan, ze kunnen "voelen" door de experimentator.
- Bewegen pipet op en neer en druk om ervoor te zorgen dat de Bouton beweegt. Dit geeft aan dat de pipetpunt en Bouton in hetzelfde Z-plane.
- Met de elektrode gedrukt tegen de afferente Bouton, tegelijk los positieve druk en afzuigen op een GΩ afdichting te vormen. Vorming van een GΩ zegel op een afferente Bouton is gelijk aan die op een haar cel. Seal formatie kan snel of traag optreden.
- Zachtjes uitbarstingen van zuigkracht te verbreken het membraan binnen de elektrode en geef de hele cel opname configuratie.
- Als gepatchte de cel is een afferente Bouton, zullen kleine capacitieve transiënten verschijnen op de test plein hartslag gecontroleerd tijdens seal formatie (zie figuur 1). We hebben schatting gemaakt van de capaciteit van de afferente einde te zijn 0,4 tot 1,8 pF (zie 3, 4). Als gepatchte de cel is een IHC, zal transiënten in de orde van 3-5 keer groter is afhankelijk van de toegang tot weerstand.
- Om te bevestigen dat de cel is een afferente Bouton, voert een protocol met hyperpolarizing en depolariserende spanning stappen. De huidige spanning relaties (IVS) voor afferente vezels en iHCS (vaak ten onrechte opgelapt bij het streven naar een afferente bouton) zijn kenmerkend voor de individuele celtypes en zijn weergegeven in figuur 2.
- Toezicht op de membraanpotentiaal, want een afferente vezel, is het normaal rond -60 tot -65 mV.
- Als de cel niet een afferente Bouton, verwijder elektrode en herhaal stap 8 - 13 met een vers gevulde elektrode. Gebruik een nieuwe elektrode voor elke poging.
- Monitor serie weerstand gedurende de opname door het aanbrengen van spanning om ervoor te zorgen dat de zeehond niet dichtslibt. Als serie weerstand toeneemt, kan het nuttig zijn om zachte pulsen van de zuigkracht toe te passen of de elektrode bewegen iets naar achteren. Serie weerstanden zijn meestal rond de 30 MΩ. Bij het analyseren van synaptische activiteit, we verwijderen opnamen met serie weerstand groter dan 50 MΩ.
- U kunt nu opnemen synaptische activiteit (zie figuur 3). Ofwel de afferente vezel vertoont spontane activiteit, of het haar cel moet worden gedepolariseerd aan de zender los te activeren. Het toepassen van een extracellulaire oplossing met een hogere kalium concentratie (bv. 40 mm) zal depolariseren het haar cel en vaak te activeren of verhoging van de snelheid van de zender vrij te geven.
- Voor de gelijktijdige opnames van iHCS en afferente boutons 2, moet de procedure worden aangepast op de volgende manier: Ga door de stappen 1 tot 5. Vul een IHC pipet met de bijbehorende oplossing voor intracellulaire Ca 2 + huidige isolatie en volgen zoals beschreven onder 6. Laat de pipet voor IHC-opname in de "wacht positie" dicht bij de IHC op te nemen uit. Ga verder met stappen 6 - 14 voor afferente opname. Wanneer de afferente pipet is in whole cell configuratie te gaan met de IHC pipet. Manoeuvre de tweede pipet de richting van de laterale wand van de overeenkomstige IHC, altijd onderhouden van positieve druk. De IHC moet blijken een inkeping aan de laterale wand door middel van de druk en moet worden gezorgd dat de ondersteunende cellen zijn gescheiden. Stappen 12 tot 13 kan worden toegepast voor IHC ook. Zoals aangegeven in 14, ten opzichte van de afferente vezels, grotere capacitieve overgangen zijn een kenmerk van een IHC-opname, in aanvulling op de karakteristieke IV relatie. Zodra gelijktijdige opnames worden vastgesteld, enige tijd zou moeten worden toegestaan (3 - 5 minuten, afhankelijk van de serieweerstand) voor intracellulaire oplossingen te wassen in de IHC. Dit zal resulteren in grotere Ca 2 + stromen door de toenemende blok van veel grotere K + conductances.
- Met het oog op uitvoeren van losse zegel extracellulaire opnames, bij stap 12, in plaats van een GΩ afdichting, er op een losse zegel van ongeveer 30 tot 50 MΩ op de afferente Bouton. Dit kan worden bereikt door het toepassen van minder zuigkracht terwijl het loslaten van de positieve druk. Zie figuur 5 voor een voorbeeld van een extracellulaire opname van een P21 rat afferente Bouton.
7. Trouble Shooting
- Wanneer de verzegeling kan worden gevormd, maar de overgang van cel-aan hele cel opname kan niet worden bereikt, mag de inwendige diameter van de pipet wordt te smal.
- Als afdichtingen niet kan worden gevormd, mag de inwendige diameter pipet te groot zijn en het hele Bouton zou kunnen worden opgezogen in de elektrode.
- Als alle synaptische evenementen zijn klein en uniform, kan de opname worden extracellulaire aan de afferente. Test voor omkering van de gebeurtenissen in positieve membraanpotentialen; intracellulair opgenomenEPSCs zal worden afgewikkeld op de positieve mogelijkheden.
- Als serie weerstanden zijn consistent hoog bij het patchen van afferente terminals, probeer dan het verplaatsen van de pipet terug voordat u door te breken in de hele cel configuratie. Dit helpt om te voorkomen dat pipet verstopping en een hoge toegang tot weerstand.
- De juiste positie van de pipet onbevreesd. Het is mogelijk om de elektrode te verplaatsen naar een hoge serie weerstand of een pipet verstopt raken te verminderen zonder "verliezen" van de zegel op de afferente. Tijdens de gelijktijdige opname vestiging, is de IHC meestal 'geduwd' naar de Bouton. De afferente pipet positie kan dienovereenkomstig worden gecorrigeerd.
8. Representatieve resultaten
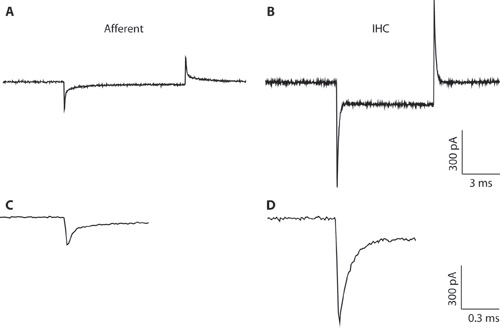
Figuur 1. AB. Typische transiënten opgenomen van een afferente vezels (A) en IHC (B) in antwoord op een 10 mV hyperpolarizing spanning opdracht van een bedrijf spanning van -94 mV. Als gevolg van de smalle pipet diameter en een hoge weerstand tegen toegang, het IHC-opname (B) is niet optimaal voor de gehele cel IHC opname. De opname is hier te zien alleen het verschil tussen de capacitieve transiënten van iHCS en afferente vezels illustreren. Dit kan helpen om onderscheid te maken tussen de celtypen bij de vorming van het whole-cell configuratie. Whole-cell capacitieve transiënten van iHCS zijn in de orde van 5 keer groter in amplitude dan die van afferente vezels. CD. Transiënten van A & B die op een tijdschaal uitgebreid. C. Het verval van de afferente reactie kan geschikt zijn twee exponenten. De capaciteit van de afferente einde was geschat op basis van de snelle component.

Figuur 2. IV relaties uit een afferente Bouton (A) en een IHC (B). IV relaties worden opgenomen van een bedrijf potentieel van -84 mV met spanning stappen van -124 mV tot + 36 mV in stappen van 10 mV (nominale spanning). Voltages worden getoond aan de rechterkant van een aantal sporen. Deze opnames werden uitgevoerd met 5,8 mM KCl extracellulaire bij kamertemperatuur. Schaal voor beide: 500 pA, 200 ms.
Een. IV relaties uit een afferente vezel op postnatale dagen 19. EPSCs aanwezig zijn gedurende het grootste deel van de spanning stappen; EPSCs omgekeerde positief tot +6 mV. Deze opname werd uitgevoerd in de aanwezigheid van TTX om spanningsgevoelige Na +-stromen te blokkeren. Let op de langzaam naar binnen te activeren stroom bij hyperpolarizing spanningen (I h). Deze stroom is niet aanwezig in iHCS of de ondersteuning van cellen en geeft een goede indicatie dat de cel opgenomen vanaf is een afferente vezel (zie 3). B. IV relaties uit een P19 IHC. Als gevolg van de smalle pipet diameter en een hoge toegang tot weerstand, de opname is niet optimaal voor de karakterisering van IHC stromingen en de stromingen zijn kleiner dan verwacht. De opname is hier te zien alleen voor de IV relaties van iHCS en afferente vezels aan te tonen is duidelijk te onderscheiden, wanneer een afferente vezels de opname wordt geprobeerd. Let op de snelle activering van uiterlijke K + stromen op de positieve mogelijkheden (pijl), gevolgd door vertraagde gelijkrichter K + stromen 13.

Figuur 3. Exemplar synaptische stromen opgenomen met een afferente vezel op postnatale dag 21 in de aanwezigheid van 40 mM extracellulaire K + om de snelheid van afgifte verhogen van het IHC. Kamertemperatuur, met TTX toegepast op de spanningsgevoelige Na +-stromen te blokkeren. A. Schaal van 200 Pa, 5 ms, let op de variabele grootte en vorm van EPSCs. Voor een gedetailleerde beschrijving van EPSC kenmerken zie 4. B. Twee EPSCs gemarkeerd in A (#: multifasische, o: monofasisch) weergegeven op een uitgebreide schaal: Schaal 100 pA, 1 ms.

Figuur 4. Gelijktijdig opnemen van een IHC-en contact op te nemen afferente Bouton in een gezuiverde rat orgaan van Corti, postnatale dag 10 (zie ook 2). Een spanning stap depolariseren de IHC veroorzaakt afgifte van neurotransmitter en activeert EPSCs in de afferente Bouton Boven-trace:. Spanning protocol voor IHC depolarisatie. Holding mogelijkheden: -79 mV, 50 ms stap naar -29 mV Midden-trace:. L-type Ca 2 + stromen opgenomen van de IHC meestal vertonen weinig inactivatie en te activeren bij negatieve potentialen bodemtrace:. Synaptic stromingen in de afferente vezels in reactie aan IHC depolarisatie. Let op de synaptische depressie tijdens een 50 ms IHC depolarisatie.

Figuur 5. Een. Exemplar extracellulaire opname van een afferente bouton op postnatale dagen 21. Deze werd opgenomen bij kamertemperatuurtuur, met 5,8 mM extracellulair K +. Deze opname heeft een typisch signaal-ruisverhouding voor een opname in een preparaat van een drie weken oude ratten. B. Gemiddelde golfvorm voor extracellulaire gebeurtenissen opgenomen van een P20 afferente Bouton. Dit is de gemiddelde golfvorm van 10.272 gebeurtenissen.

Schema 1. Dwarsdoorsnede zien door een draai van een rat cochlea ter illustratie van de anatomische relatie tussen de binnenste en buitenste haarcellen, de spiraal ganglia, stria vascularis en tectorial membraan.
Discussion
De kritische stap in deze procedure is de dissectie. Als het weefsel wordt uitgerekt of beschadigd tijdens de dissectie zal afferente vezels niet overleven. Weefsel van jongere ratten is meer elastisch en vergevingsgezind. We vinden dat postnatale dagen 10 tot 11 zijn het gemakkelijkst te ontleden en experimenten hebben hogere slagingspercentages. Een aanzienlijke mate van cochleaire rijping optreedt na de geboorte, met ratten beginnen te horen uit de hele postnatale dag 12 14. Daarom is op de leeftijd waar de dissectie is het makkelijkst, kan synapsen niet volledig rijp 4.
De dissectie hier beschreven voor ratten is in wezen hetzelfde voor muizen, het belangrijkste verschil is de kleinere omvang van de muis slakkenhuis. Deze techniek maakt het mogelijk de eigenschappen van lint synapsen worden onderzocht in transgenically gemodificeerde muizen 15. Verdere wijzigingen in deze techniek zijn onder andere: het toevoegen van een fluorescente kleurstof om de intracellulaire oplossing voor het label vezels 3; gekoppeld opnamen met de presynaptische binnenste haarcel en postsynaptische afferente Bouton, waardoor de transfer functie tussen pre-en post synaptische cellen te bepalen 2 en los- afdichting extracellulaire opnames bij afferente boutons om het verlies van cellulaire integriteit te voorkomen. De extracellulaire configuratie is makkelijker te bereiken dan de whole-cell configuratie en experimenten zijn over het algemeen een langere levensduur.
Disclosures
Geen belangenconflicten verklaard.
Acknowledgments
Dit werk werd ondersteund door een Doofheid Research Foundation Research Grant aan EY en NIDCD, toont DC006476 en EG door NIDCD, toont DC005211 aan het Centrum voor gehoor en evenwicht, Johns Hopkins University. Artwork copyright Tim Phelps, Johns Hopkins University.
LG schreef de eerste manuscript, EY en LG filmde de dissectie en de opname. Alle auteurs die exemplar cijfers en heeft bijgedragen aan het schrijven van het manuscript.
Materials
| Name | Company | Catalog Number | Comments |
| Air table | TMC | ||
| Gibraltar Stage with xy-table | Burleigh | ||
| Axioscope FS2 upright microscope DIC optics Green filter | Carl Zeiss, Inc. | ||
| Newvicon camera with controller | Dage | ||
| Monitor | Dage | ||
| Multiclamp 700B (or similar) | Molecular Devices | ||
| Digidata 1322A (or similar) | Molecular Devices | ||
| Manipulator MP285 | Sutter Instrument Co. | ||
| 6-channel valve application system for local perfusion (used with hand made perfusion pipettes) | Warner Instruments | ||
| PC with acquisition software (PClamp) | Molecular Devices | ||
| Above is the equipment in our electrophysiological setups used for recording from afferent terminals. | |||
References
- Glowatzki, E., Fuchs, P. A. Transmitter release at the hair cell ribbon synapse. Nat Neurosci. 5 (2), 147-154 (2002).
- Goutman, J. D., Glowatzki, E. Time course and calcium dependence of transmitter release at a single ribbon synapse. Proc Natl Acad Sci U S A. 104 (41), 16341-16346 (2007).
- Yi, E., Roux, I., Glowatzki, E. Dendritic HCN channels shape excitatory postsynaptic potentials at the inner hair cell afferent synapse in the mammalian cochlea. J Neurophysiol. 103 (5), 2532-2543 (2010).
- Grant, L., Yi, E., Glowatzki, E. Two modes of release shape the postsynaptic response at the inner hair cell ribbon synapse. J Neurosci. 30 (12), 4210-4220 (2010).
- LoGiudice, L., Matthews, G. The role of ribbons at sensory synapses. Neuroscientist. 15 (4), 380-391 (2009).
- Singer, J. H. Coordinated multivesicular release at a mammalian ribbon synapse. Nat Neurosci. 7 (8), 826-833 (2004).
- Keen, E. C., Hudspeth, A. J. Transfer characteristics of the hair cell's afferent synapse. Proc Natl Acad Sci U S A. 103 (14), 5537-5542 (2006).
- Li, G. L. The unitary event underlying multiquantal EPSCs at a hair cell's ribbon synapse. J Neurosci. 29 (23), 7558-7568 (2009).
- Singer, J. H., Diamond, J. S. Vesicle depletion and synaptic depression at a mammalian ribbon synapse. J Neurophysiol. 95 (5), 3191-3198 (2006).
- Suryanarayanan, A., Slaughter, M. M. Synaptic transmission mediated by internal calcium stores in rod photoreceptors. J Neurosci. 26 (6), 1759-1766 (2006).
- Neef, A. Probing the mechanism of exocytosis at the hair cell ribbon synapse. J Neurosci. 27 (47), 12933-12944 (2007).
- Tritsch, N. X. The origin of spontaneous activity in the developing auditory system. Nature. 450 (7166), 50-55 (2007).
- Kros, C. J., Ruppersberg, J. P. Expression of a potassium current in inner hair cells during development of hearing in mice. Nature. 394 (6690), 281-284 (1998).
- Muller, M. Developmental changes of frequency representation in the rat cochlea. Hear Res. 56 (1-2), 1-7 (1991).
- Seal, R. P. Sensorineural deafness and seizures in mice lacking vesicular glutamate transporter 3. Neuron. 57 (2), 263-275 (2008).



