Summary
Whole-cell patch-clamp registrazioni da dendriti delle fibre nervose uditivo interno alla sinapsi nastro capelli cellule nella coclea di mammifero.
Abstract
Le sinapsi afferenti tra la cellula ciliate interne (IHC) e la fibra di nervo uditivo fornisce un sito accessibile elettrofisiologico per la registrazione l'attività postsinaptica di un singolo nastro sinapsi 1-4. Sinapsi nastro di cellule sensoriali rilascio dei neurotrasmettitori in continuo, il cui tasso è modulata in risposta ai cambiamenti classificati in IHC potenziale di membrana 5. Sinapsi nastro hanno dimostrato di operare con un comunicato multivescicolari, dove vescicole multiple può essere rilasciato contemporaneamente per evocare le correnti post-sinaptiche eccitatorie (EPSCs) di varia ampiezza 1, 4, 6-11. Né il ruolo del nastro presinaptico, né il meccanismo sottostante rilascio multivescicolari è attualmente ben compreso.
L'IHC è innervato da fibre del nervo uditivo 10-20, e tutti i contatti in fibra di IHC con un singolo amieliniche fine di formare una singola sinapsi nastro. Le piccole dimensioni del iHCS afferenti boutons contatto (circa 1 micron di diametro) permette le registrazioni con eccezionale risoluzione temporale da fare. Inoltre, la tecnica può essere adattata a registrare da entrambe le cellule pre-e post-sinaptici contemporaneamente, consentendo la funzione di trasferimento alla sinapsi da studiare direttamente 2. Questo metodo fornisce quindi un mezzo attraverso il quale gli aspetti fondamentali della neurotrasmissione può essere studiata, dalla versione multivescicolari alla funzione elusiva del nastro in cellule sensoriali.
Protocol
1. Soluzioni
- Le soluzioni possono essere preparati in anticipo. Le soluzioni extracellulare può essere conservato a 4 ° C per un massimo di un mese. Aliquote di soluzione interna possono essere conservati congelati (-20 ° C). Garantire che le soluzioni siano a temperatura ambiente prima di iniziare gli esperimenti.
- Soluzione di dissezione e soluzione di registrazione extracellulare (mm): 5,8 KCl, NaCl 144; 0,9 MgCl 2, 1.3 CaCl 2; 0,7 NaH 2 PO 4; 5,6 glucosio, 10 HEPES, 1 piruvato Na, pH 7.4 (NaOH), 300 mOsm. Per IHC Ca 2 + isolamento attuale la soluzione extracellulare può essere modificato come indicato: 5.8 KCl, NaCl 114; 0,9 MgCl 2, 1.3 CaCl 2; 0,7 NaH 2 PO 4; 5,6 glucosio, 10 HEPES, 30 Cl TEA, pH 7.4 (NaOH ); 300 mOsm.
- 1-2 mM tetrodotossina (TTX) può essere aggiunto alla soluzione extracellulare per bloccare i canali del sodio voltaggio e isolare le correnti post-sinaptiche eccitatorie o potenziali (EPSCs o EPSPS).
- Registrazione soluzione intracellulare (mm): 20 KCl; 110 K-metanosolfonato, 5 MgCl 2; 0,1 CaCl 2, 5 EGTA, 5 HEPES, 5 Na 2 ATP; 0,3 Na 2 GTP, 5 Na 2 phoshocreatine; pH 7,2 (KOH), 290 mOsm; o 135 KCl, 3,5 MgCl 2; 0,1 CaCl 2, 5 EGTA, 5 HEPES, 4 Na 2 ATP; 0,2 Na 2 GTP; pH 7,2 (KOH), 290 mOsm. Soluzione intracellulare di Ca 2 + IHC attuale isolamento: 135 CsMeSO3, 13 Cl TEA; 3,5 MgCl 2; 2,5 Na 2 ATP, 1 EGTA, pH 7,2 (CsOH); 290 mOsm. Questa soluzione avrebbe bloccato una quantità significativa di conduttanze K + molto più grande, lasciando Ca 2 + corrente residua.
2. Fare titolari di tessuto Dissected
- Coprioggetto modificato utilizzato per tenere la preparazione al suo posto durante le registrazioni possono anche essere preparati in anticipo.
- Applicare una goccia di Sylgard (Dow Corning, Midland, MI), verso il bordo di un coprioggetto di vetro circolare (8-12 mm). Posizionare l'estremità di spessore di uno spillo insetti fine (FST, senza voce 26002-10) sul vetrino. Tenere il perno di insetti strettamente contro il vetro con una pinza e tenere vicino ad una bobina riscaldata per impostare il sylgard.
3. Fare Elettrodi
- Preparare elettrodi fresca ogni giorno sperimentale e conservare in una scatola ermetica. Fabbricare 10-20 elettrodi per ogni preparazione.
- Seleziona elettrodo di vetro; usiamo 1 millimetro vetro borosilicato capillari (1B100F-4 da WPI, Sarasota, FL).
- Progettare un programma su un multi-step estrattore per tirare elettrodi con un diametro punta di circa 2-3 micron (~ 6 MΩ nelle soluzioni sopra descritte). Usiamo un Sutter P-87 multi-step estrattore orizzontale o verticale Narishige PC-10 estrattore.
- Con attenzione rivestire il gambo della elettrodo con Sylgard il più vicino alla punta più possibile. Questo riduce capacità pipetta e il rumore riduce al minimo la registrazione.
- Fire-lucidare elettrodi usando un microforge con un filamento riscaldato come quella disponibile da WPI. Elettrodi fuoco lucido dovrebbe avere un diametro esterno punta di circa 1 micron (10-15 MΩ nelle soluzioni sopra descritte). Lo spessore del muro pipetta è circa 1 / 3 micron. Il diametro esterno ha circa le dimensioni della bouton afferenti di patch.
- In caso di attuazione registrazioni simultanee: IHC pipetta dovrebbe essere costruito nello stesso modo (lo stesso vetro, tirando stesso programma), con la distinzione che la lucidatura fuoco dovrebbe lasciare una punta di diametro maggiore di ~ 3 micron (6 - 8 MΩ).
4. Di iniziare l'esperimento
- Riempire le camere collegate alla gravità sistema alimentato perfusione con soluzione extracellulare e soluzioni di test contenenti farmaci o tossine di interesse.
- Impostare perfusione in modo che il volume del bagno è di circa 2 ml, costantemente profumato ad un ritmo dell'ordine di 1,5 ml min-1.
- Se sono diverse soluzioni da applicare durante l'esperimento con un sistema di perfusione locale, riempire i serbatoi con le soluzioni. Eseguire le soluzioni attraverso il sistema e assicurarsi che non vi siano bolle d'aria.
5. Dissezione e preparazione dei campioni
- Il film mostra che accompagna la dissezione dell'organo del Corti per tre settimane ratti (Sprague Dawley, Charles River), che è più difficile di quella delle precedenti fasi di post-natale. Vantaggi e svantaggi di registrazione da ratti di diversa età sono rivisti nella discussione.
- Profondamente anestetizzare il ratto per inalazione isoflurano. Quando ritiro riflessi sono assenti e riflessi corneali sono gravemente depressi, decapitare. Queste procedure sono state approvate dalla cura degli animali Johns Hopkins University e Comitato Usa.
- Rimuovere il muso e la pelle dalla testa decapitata. Dividono in due la testa e togliere il cervello per esporre le ossa temporali.
- Rimuovere entrambe le ossa temporali e mettere in pulito piatti dissezione contenente soluzione standard extracellulare.
- Rimuoverel'osso di incapsulare l'osso temporale in modo da esporre la coclea. Tenere l'osso temporale in modo sicuro alla base con un paio di pinze. Identificare le finestre tonde e ovali. Orientare la coclea in modo che la finestra ovale e la parte a spirale verso l'alto del volto della coclea e togliere l'osso in eccesso intorno alla coclea.
- Togliere l'osso incapsulare la coclea per esporre l'epitelio sensoriale, avendo cura di proteggere la bobina apicale, che saranno utilizzati per l'esperimento. Usare un secondo paio di pinze multa al chip l'osso direttamente dalla coclea, a cominciare dalla zona che è più trasparente rispetto al resto dell'osso. Qui l'osso è più sottile e più facile da rimuovere. Continuare a rimuovere l'osso provenienti da tutto il coil apicale.
- Usa micro-dissezione forbici per tagliare il modiolus sotto la volta apicale. Quindi scollegare il turno apicale dalla giri inferiore della coclea.
- Usa micro-dissezione forbici nuovo, se necessario, per assicurare che il turno apicale è completamente reciso. Fare attenzione a proteggere la bobina apicale, non deve essere tirata o allungato. Utilizzare le pinze multa di convincere il turno apicale dal resto della coclea.
- Rimuovere il resto delle ossa da entrambi i lati del turno apicale.
- Rimuovere con attenzione il vascularis stria, la striscia di tessuto lucido situata al di fuori della regione delle cellule dei capelli (Schema 1). Assicurati di evitare di rimuovere le cellule ciliate sensoriali, che possono facilmente staccarsi insieme al vascularis stria.
- Utilizzare una pinza sottile per staccare la membrana tettoria, la lucida, semi-trasparente membrana che siede sopra le cellule ciliate sensoriali.
- Ora tagliare il tessuto in eccesso e ossa e appiattire la preparazione con le pinze. Ciò è necessario, in modo che il tessuto può essere posizionato in modo uniforme sotto uno spillo.
- Posizionare la preparazione sotto la pin collegato a un coprioggetto (preparato in precedenza), avendo cura di posizionare il perno lontano dalle cellule dei capelli.
- Usare pinze per trasferire il coprioggetto alla camera di registrazione. Garantire il tessuto cocleare è completamente coperto con una goccia di soluzione extracellulare, mentre il trasferimento del coprioggetto. Premere il coprioggetto con decisione sul fondo di vetro della camera per assicurarsi che non si muova durante la registrazione.
- Iniziare immediatamente a perfusione con soluzione extracellulare, per garantire una migliore sopravvivenza del preparato.
6. Registrazione
- Individuare la preparazione attraverso gli oculari utilizzando il microscopio 10x e 40x gli obiettivi DIC immersione in acqua. Indirizzare la preparazione in modo che gli elettrodi di registrazione possono avvicinarsi iHCS ortogonalmente alla parete laterale della IHC.
- Se la preparazione è arrotolata sul, limitando la visibilità della regione basale di iHCS, utilizzare un elettrodo di registrazione per spingere il bordo esterno della preparazione giù contro il coprioggetto di vetro, avendo cura di evitare di premere i iHCS stessi.
- * Se si utilizza giovani ratti, in questa fase lo spesso strato di cellule di sostegno sopra le cellule dei capelli può essere rimosso con una pipetta di pulizia (con un diametro di punta di circa 10-20 micron) per accedere alle cellule sensoriali 1, 12.
- Utilizzare il monitor per valutare se il tessuto è sano. Utilizzando una lente di ingrandimento 4X tra microscopio e la fotocamera NC70 Newvicon ingrandisce ulteriormente l'immagine ed i progetti su una superficie di circa 4800 micron 2 sul monitor. Cellule ciliate dovrebbe essere allungata con fasci di capelli intatti. Quando il tessuto si deteriora, le cellule dei capelli si gonfiano e diventano più trasparenti e granulosa.
- Localizzare boutons afferenti intorno alla base del iHCS. Boutons sono sferici o ellissoidali, circa 1 micron di diametro e di colore chiaro con un aspetto brillante. La maggior parte dei boutons sono localizzati al di sotto del livello del nucleo. Quando il tessuto è sano boutons gonfiano a circa 4 volte le dimensioni normali e diventano trasparenti, piuttosto che lucido.
- Riempire un elettrodo di registrazione con soluzione intracellulare, applicare una pressione positiva e utilizzare il micromanipolatore di manovrare l'elettrodo alla preparazione.
- Fare un'incisione per la preparazione al livello della base IHC con l'elettrodo. Spingere l'elettrodo tra il sottile strato di cellule di sostegno e la iHCS, utilizzando una pressione positiva di forgiare una via d'accesso alla zona alla base del iHCS. Questo passo è "chiave" per raggiungere il bouton afferenti e per non supportare la registrazione da cellule che strettamente ensheath le terminazioni afferenti.
- Rimuovere con cautela l'elettrodo e sostituirlo con un elettrodo appena riempito.
- Utilizzando una pressione positiva per mantenere una punta pulita elettrodo, manovra l'elettrodo attraverso il foro di accesso alla membrana del IHC. La pressione positiva dovrebbe aiutare a muoversi intorno alle cellule di sostegno che circonda la iHCS.
- Spostare l'elettrodo intorno adiacente cellule di supporto verso il bouton afferenti (come mostrato nel film di accompagnamento. Un approccio alternativo è quello di avvicinarsi al bouton afferenti spostando unlungo la membrana IHC fino alla punta dell'elettrodo tocca il bouton). Assicurarsi che la punta dell'elettrodo è direttamente di fronte al bouton afferenti (c'è ancora un piccolo spazio tra le bouton e l'elettrodo a causa della pressione positiva sulla pipetta). Boutons offrono più resistenza al movimento della pipetta rispetto alle cellule di supporto e la membrana IHC, possono essere "sentito" dallo sperimentatore.
- Spostare pipetta su e giù e spingere per fare in modo che le mosse bouton. Ciò indica che la punta della pipetta e Bouton sono nella stessa Z-aereo.
- Con l'elettrodo premuto contro la bouton afferenti, allo stesso tempo di rilascio a pressione positiva e applicare il vuoto per formare un sigillo GΩ. Formazione di un sigillo GΩ su un bouton afferente è simile a quella su una cella capelli. Formazione tenuta può essere rapida o può avvenire lentamente.
- Applicare scoppia delicata di aspirazione di rottura della membrana all'interno dell'elettrodo ed inserire l'intera configurazione di registrazione delle cellule.
- Se la cella è un patch bouton afferenti, piccoli transienti capacitivi apparirà sul polso piazza prova rilevata nel corso di formazione di tenuta (vedi Figura 1). Abbiamo valutato la capacità del finale afferenti da 0,4-1,8 pF (vedi 3, 4). Se la cella è un patch IHC, transitori saranno dell'ordine di 3-5 volte maggiore a seconda resistenza di accesso.
- Per confermare che la cellula è un bouton afferente, eseguire un protocollo con iperpolarizzante e depolarizzante fasi di tensione. I rapporti di tensione di corrente (IV) per le fibre afferenti ed iHCS (spesso erroneamente patch quando si punta per un bouton afferenti) sono caratteristici per i tipi di cellule individuali e sono mostrati in figura 2.
- Monitorare il potenziale di membrana, per una fibra afferente, che normalmente è di circa -60 a -65 mV.
- Se la cella non è un bouton afferente, rimuovere elettrodo e ripetere i passaggi 8-13 con un elettrodo appena riempito. Utilizzare un nuovo elettrodo per ogni tentativo.
- Controllo della resistenza serie per tutta la registrazione mediante l'applicazione di misure di tensione per garantire che la tenuta non è chiusura. Se aumenta la resistenza in serie, può essere utile applicare impulsi delicata di aspirazione o per spostare l'elettrodo leggermente all'indietro. Resistenze della serie sono in genere circa 30 MW. Quando si analizza l'attività sinaptica, abbiamo scartare le registrazioni con resistenze serie di dimensioni superiori a 50 MW.
- È ora possibile registrare l'attività sinaptica (vedi figura 3). In entrambi i casi le fibre afferenti mostra un'attività spontanea, o la cellula capelli hanno bisogno di essere depolarizzata per attivare rilascio del trasmettitore. L'applicazione di una soluzione extracellulare con una maggiore concentrazione di potassio (per esempio 40 mm) si depolarizza la cellula capelli e spesso attivare o aumentare la velocità di rilascio del trasmettitore.
- Per le registrazioni simultanee di iHCS e boutons afferenti 2, la procedura dovrebbe essere modificato nel modo seguente: Procedere con i passaggi da 1 a 5. Riempire una pipetta IHC con la soluzione corrispondente intracellulare di Ca 2 + attuale isolamento e seguire, come indicato al punto 6. Lascia la pipetta per la registrazione IHC in "posizione di attesa" vicina al IHC da registrare da. Continuare con i passaggi da 6 - 14 per la registrazione afferenti. Quando la pipetta afferente è in configurazione a cellule intere continuare con la pipetta IHC. Manovra la pipetta secondo verso la parete laterale del corrispondente IHC, mantenendo sempre una pressione positiva. L'IHC dovrebbe mostrare una rientranza sulla parete laterale per mezzo della pressione e deve essere garantito che le cellule di supporto sono separati da esso. Passi 12-13 potrebbe essere applicato per IHC pure. Come indicato in 14, rispetto alle fibre afferenti, grandi transienti capacitivi sono un segno distintivo di una registrazione IHC, oltre alla relazione caratteristica IV. Una volta che le registrazioni simultanee sono stabiliti, qualche tempo dovrebbe essere consentito (3 - 5 minuti, a seconda della resistenza serie) per le soluzioni intracellulari di lavare in IHC. Questo si tradurrà in una maggiore Ca 2 + a causa delle correnti di bloccare l'aumento di conduttanze K molto più grande +.
- Al fine di eseguire loose-sigillo registrazioni extracellulari, al punto 12, piuttosto che fare un sigillo GΩ, fare un sigillo perdere di 30 a 50 MΩ sul bouton afferenti. Ciò può essere ottenuto mediante l'applicazione di meno di aspirazione, mentre rilasciando la pressione positiva. Vedere la Figura 5 per un esempio di una registrazione extracellulare da un bouton P21 ratto afferenti.
7. Risoluzione dei problemi
- Se le guarnizioni possono essere formati, ma la transizione da cellula collegata alla registrazione cellula intera non può essere raggiunto, il diametro interno della pipetta può essere troppo stretto.
- Se tenute strette non può essere formato, il diametro interno della pipetta può essere troppo grande e il bouton intero potrebbe essere risucchiato l'elettrodo.
- Se tutti gli eventi sinaptici sono piccole e uniformi, la registrazione può essere extracellulare al afferenti. Prova per l'inversione di eventi a potenziali di membrana positivo; intracellulare registratiEPSCs si riverseranno a potenzialità positive.
- Se resistenze serie sono costantemente elevata quando patching terminali afferenti, provare a spostare indietro la pipetta prima di tentare di sfondare nella configurazione di cellula intera. Questo aiuta a prevenire l'intasamento della pipetta e accesso ad alta resistenza.
- Corretta posizione della pipetta senza paura. E 'possibile spostare l'elettrodo per ridurre la resistenza serie o intasamento pipetta senza "perdere" il sigillo sulla afferenti. Durante la registrazione simultanea stabilimento, la IHC generalmente 'spinto' verso il bouton. La posizione pipetta afferente può essere corretto di conseguenza.
8. Rappresentante Risultati
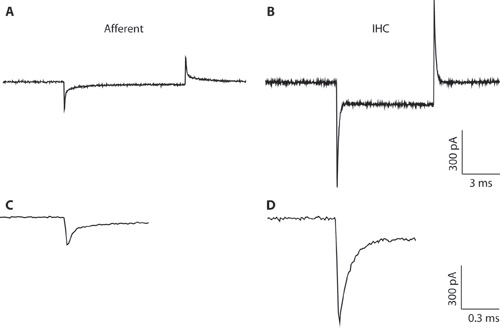
Figura 1. AB. Transitori tipici registrate da una fibra afferente (A) e IHC (B) in risposta ad un 10 mV iperpolarizzante comando tensione da una tensione di detenzione di -94 mV. A causa del diametro pipetta strette e accesso ad alta resistenza, la registrazione IHC (B) è ottimale per la registrazione a cellula intera IHC. La registrazione viene qui solo per illustrare la differenza tra i transitori capacitivo di iHCS e fibre afferenti. Questo può aiutare a distinguere tra i tipi di cellule che formano quando la cellula intera configurazione. Transitori capacitivo a cellula intera da iHCS sono dell'ordine di 5 volte più grande in ampiezza rispetto a quelli da fibre afferenti. CD. Transitori da A & B mostrato un esteso lasso di tempo. C. Il decadimento della risposta afferente può essere in forma con due esponenziali. La capacità del finale afferenti è stata stimata dal componente veloce.

Figura 2. Relazioni IV da un bouton afferenti (A) e un IHC (B). Relazioni IV vengono registrati da un potenziale detenzione di -84 mV con gradini di tensione da -124 mV a + 36 mV con incrementi di 10 mV (tensione nominale). Tensioni sono indicate a destra di alcune tracce. Queste registrazioni sono state effettuate con 5.8 mM KCl extracellulare a temperatura ambiente. Scala per entrambi: 500 pA, 200 ms.
A. Relazioni IV da una fibra afferente al giorno dopo la nascita 19. EPSCs sono presenti durante la maggior parte delle fasi di tensione; EPSCs inversione positiva a +6 mV. Questa registrazione è stata effettuata in presenza di TTX per bloccare tensione gated Na + correnti. Nota la corrente lentamente attivando verso l'interno a tensioni iperpolarizzante (I h). Questa corrente non è presente in iHCS o cellule di supporto e fornisce una buona indicazione che la cellula è registrato da una fibra afferente (vedi 3). B. Relazioni IV da un IHC P19. A causa del diametro pipetta strette e accesso ad alta resistenza, la registrazione non è ottimale per la caratterizzazione IHC correnti e le correnti sono più piccole di quanto previsto. La registrazione viene qui solo per dimostrare i rapporti IV iHCS e fibre afferenti possono essere chiaramente distinti, quando una registrazione fibra afferente è tentato. Si noti la rapida attivazione di K + verso l'esterno le correnti a potenziale positivo (freccia), seguito da K + a rettificazione ritardata correnti 13.

Figura 3. Exemplar correnti sinaptiche registrati da una fibra afferente al giorno postnatale 21 in presenza di 40 mM K extracellulare per aumentare il tasso di cessione dalla IHC. Temperatura ambiente, con TTX applicata al blocco di tensione gated Na + correnti. A. Scala di 200 Pa, 5 ms, si noti la forma e dimensioni variabili di EPSCs. Per una descrizione dettagliata delle caratteristiche EPSC vedere 4. B. Due EPSCs segnato in A (#: multifasico, o: monofase) mostrato su scala estesa: Scala 100 pA, 1 ms.

Figura 4. Registrazione simultanea di un IHC e contattare bouton afferenti in un organo asportato ratto di Corti, il giorno dopo la nascita 10 (vedere anche 2). Un passo di tensione depolarizzanti l'IHC provoca rilascio di neurotrasmettitore e attiva EPSCs nel bouton afferenti Superiore traccia:. Protocollo di tensione per depolarizzazione IHC. Tenendo potenziale: -79 mV, 50 ms passo a -29 mV traccia Oriente:. Tipo L Ca 2 + correnti registrato dal IHC mostrano tipicamente inattivazione poco e attivare a potenziali negativi traccia basso:. Synaptic correnti in fibra afferente in risposta alla depolarizzazione IHC. Si noti la depressione sinaptica nel corso di una depolarizzazione 50 ms IHC.

Figura 5. A. Exemplar registrazione extracellulare da un bouton afferente al giorno dopo la nascita 21. Questo è stato registrato a temperaturatura, con 5.8 mM K + extracellulare. Questa registrazione è un tipico segnale di rumore per una registrazione in un preparato da un topo tre settimane fa. B. Forma d'onda media per gli eventi extracellulari registrato da un bouton P20 afferenti. Questa è la forma d'onda media di 10272 eventi.

Schematico 1. Vista in sezione trasversale attraverso un giro di una coclea di ratto che illustrano la relazione anatomica tra le cellule ciliate interne ed esterne, i gangli della spirale, la membrana stria vascularis e tettoria.
Discussion
Il passo cruciale in questa procedura è la dissezione. Se il tessuto è allungato o danneggiati durante la dissezione, fibre afferenti non sopravviverà. Tessuti più giovani ratti è più elastica e perdonare. Troviamo che giorno dopo la nascita 10 a 11 sono più facili da analizzare e gli esperimenti hanno percentuali di successo superiori. Un significativo grado di maturazione cocleare si verifica dopo la nascita, con i ratti iniziano a sentire da circa 12 14 giorni dopo la nascita. Pertanto, l'età in cui la dissezione è più facile, sinapsi potrebbero non essere completamente maturo 4.
La dissezione qui descritto per i ratti è essenzialmente lo stesso per i topi, la differenza principale è la dimensione più piccola della coclea mouse. Questa tecnica permette di proprietà delle sinapsi nastro da esaminare in topi modificati transgenically 15. Ulteriori modifiche a questa tecnica sono: l'aggiunta di un colorante fluorescente alla soluzione intracellulare alle fibre etichetta 3; registrazioni in coppia con la cellula presinaptica ciliate interne e post-sinaptici afferenti Bouton, che consente la funzione di trasferimento tra le cellule pre e post sinaptica da determinare 2 e loose- sigillo registrazioni extracellulari a boutons afferenti per evitare la perdita di integrità cellulare. La configurazione di registrazione extracellulare è più facile da raggiungere rispetto alla cellula intera configurazione e gli esperimenti sono in genere più durevole.
Disclosures
Nessun conflitto di interessi dichiarati.
Acknowledgments
Questo lavoro è stato supportato da una ricerca sordità Research Foundation Grant a EY e dell'NIDCD DC006476 di EG e dell'NIDCD DC005211 al Centro per l'udito e l'equilibrio, Johns Hopkins University. Opere d'arte d'autore Tim Phelps, Johns Hopkins University.
LG ha scritto il manoscritto iniziale; EY e LG girato la dissezione e la registrazione. Tutti gli autori hanno fornito dati esemplare e ha contribuito alla stesura del manoscritto.
Materials
| Name | Company | Catalog Number | Comments |
| Air table | TMC | ||
| Gibraltar Stage with xy-table | Burleigh | ||
| Axioscope FS2 upright microscope DIC optics Green filter | Carl Zeiss, Inc. | ||
| Newvicon camera with controller | Dage | ||
| Monitor | Dage | ||
| Multiclamp 700B (or similar) | Molecular Devices | ||
| Digidata 1322A (or similar) | Molecular Devices | ||
| Manipulator MP285 | Sutter Instrument Co. | ||
| 6-channel valve application system for local perfusion (used with hand made perfusion pipettes) | Warner Instruments | ||
| PC with acquisition software (PClamp) | Molecular Devices | ||
| Above is the equipment in our electrophysiological setups used for recording from afferent terminals. | |||
References
- Glowatzki, E., Fuchs, P. A. Transmitter release at the hair cell ribbon synapse. Nat Neurosci. 5 (2), 147-154 (2002).
- Goutman, J. D., Glowatzki, E. Time course and calcium dependence of transmitter release at a single ribbon synapse. Proc Natl Acad Sci U S A. 104 (41), 16341-16346 (2007).
- Yi, E., Roux, I., Glowatzki, E. Dendritic HCN channels shape excitatory postsynaptic potentials at the inner hair cell afferent synapse in the mammalian cochlea. J Neurophysiol. 103 (5), 2532-2543 (2010).
- Grant, L., Yi, E., Glowatzki, E. Two modes of release shape the postsynaptic response at the inner hair cell ribbon synapse. J Neurosci. 30 (12), 4210-4220 (2010).
- LoGiudice, L., Matthews, G. The role of ribbons at sensory synapses. Neuroscientist. 15 (4), 380-391 (2009).
- Singer, J. H. Coordinated multivesicular release at a mammalian ribbon synapse. Nat Neurosci. 7 (8), 826-833 (2004).
- Keen, E. C., Hudspeth, A. J. Transfer characteristics of the hair cell's afferent synapse. Proc Natl Acad Sci U S A. 103 (14), 5537-5542 (2006).
- Li, G. L. The unitary event underlying multiquantal EPSCs at a hair cell's ribbon synapse. J Neurosci. 29 (23), 7558-7568 (2009).
- Singer, J. H., Diamond, J. S. Vesicle depletion and synaptic depression at a mammalian ribbon synapse. J Neurophysiol. 95 (5), 3191-3198 (2006).
- Suryanarayanan, A., Slaughter, M. M. Synaptic transmission mediated by internal calcium stores in rod photoreceptors. J Neurosci. 26 (6), 1759-1766 (2006).
- Neef, A. Probing the mechanism of exocytosis at the hair cell ribbon synapse. J Neurosci. 27 (47), 12933-12944 (2007).
- Tritsch, N. X. The origin of spontaneous activity in the developing auditory system. Nature. 450 (7166), 50-55 (2007).
- Kros, C. J., Ruppersberg, J. P. Expression of a potassium current in inner hair cells during development of hearing in mice. Nature. 394 (6690), 281-284 (1998).
- Muller, M. Developmental changes of frequency representation in the rat cochlea. Hear Res. 56 (1-2), 1-7 (1991).
- Seal, R. P. Sensorineural deafness and seizures in mice lacking vesicular glutamate transporter 3. Neuron. 57 (2), 263-275 (2008).



