Summary
Xenopus embryonnaire ectoderme est devenu un modèle attractif pour les études de la polarité cellulaire. Un essai est décrit, dans lequel la distribution subcellulaire des protéines fluorescentes dans les cellules est évaluée ectoderme. Ce protocole aidera aborder les questions relatives au contrôle spatial de la signalisation.
Abstract
Polarité cellulaire est une propriété fondamentale des cellules eucaryotes qui est dynamiquement régulée par des facteurs intrinsèques et extrinsèques au cours développement embryonnaire 1, 2. Une des voies de signalisation impliquées dans cette régulation est la voie Wnt, qui est utilisé à plusieurs reprises durant l'embryogenèse et critique pour la maladie de l'homme 3, 4, 5. De multiples composants moléculaires de cette voie de signalisation coordonnée réguler de manière spatialement limité, mais les mécanismes sous-jacents ne sont pas pleinement compris. Xenopus cellules embryonnaires épithéliales est un excellent système pour étudier la localisation subcellulaire des protéines de signalisation différents. Protéines de fusion fluorescentes sont exprimés dans les embryons de Xenopus par microinjection d'ARN, des explants ectodermiques sont préparés et la localisation des protéines est évaluée par épifluorescence. Dans ce protocole expérimental, nous décrivons comment la localisation subcellulaire des Diversin, une protéine cytoplasmique qui a été impliquée dans la signalisation et la détermination de la polarité cellulaire 6, 7 est visualisée dans les cellules ectodermiques Xénope pour étudier la transduction du signal Wnt 8. Coexpression d'un ligand Wnt ou d'un récepteur Frizzled modifie la répartition des Diversin fusionné avec la protéine fluorescente rouge, DP, et il recrute à la membrane cellulaire de façon polarisée 8, 9. Ce protocole ex vivo devrait être un complément utile aux études in vitro des cellules mammaliennes cultivées, dans laquelle le contrôle spatial de la signalisation est différente de celle du tissu intact et est beaucoup plus difficile à analyser.
Protocol
1. Fécondation in vitro de Xenopus Oeufs
- Obtenir œufs de grenouilles femelles qui ont été injectés avec la gonadotrophine chorionique humaine (400 unités / grenouille) 12 heures avant l'expérience.
- Placez les oeufs dans une petite quantité (0,5-1 ml) de solution à 1 x Marc Ringer modifiée (ROR) 10 à les œufs et les féconder in vitro avec un petit morceau de testicule disséqués. Après 2-3 minutes, ajouter 0,1 x ROR pour couvrir toute la surface des œufs. En 20 minutes, l'oeuf gelée de poil est enlevé par la cystéine 3% - HCL (ajusté à pH 8 avec de l'hydroxyde de sodium). Les œufs sont lavés avec 0,1 x ROR à trois reprises et laissé dans un incubateur à froid (13 ° C) pour les injections.
- Les oeufs fécondés sont autorisés à se développer pour stades 2-4 cellules. Pour les injections, les embryons sont transférés dans la solution contenant 3% de Ficoll, 0,5 x ROR.
2. Microinjection d'ARN
- ARN sont synthétisés à partir de matrices d'ADN linéarisé en utilisant mMessage mMachine kit (Ambion) et dilué avec de l'eau exempte de RNase à la concentration des stocks de 0,1-1 pg / pl. Les doses optimales de l'ARN pour les injections sont déterminées dans des expériences pilotes. ARN pour Diversin-DP, le marqueur membranaire GFP-CAAX et Frizzled 8 sont utilisées à 0,1-1 ng par injection.
- Les aiguilles ne sont préparés avec un extracteur d'aiguilles à partir d'un capillaire et puis avec un moulin à aiguille. Avant l'injection, chaque aiguille est calibré avec de l'eau pour éjecter 10 nl d'injection de liquide par.
- Pour les injections, les embryons sont placés sur un plat en plastique dans une gouttelette grand Ficoll 3%, 0,5 x ROR. Un microlitre de solution d'ARN est aspiré dans une aiguille d'injection avec Narishige microinjecteur. 10 nl d'ARN est injecté dans des animaux de 8 blastomères d'embryons de cellules 2-3 fois. Les embryons injectés sont transférés dans un puits de la plaque de 12 puits.
3. Préparation des explants ectodermiques
- Lorsque les embryons injectés rejoindre début stade gastrula, ils sont transférés dans 0,6 x ROR solution dans un plat de 3 cm recouvert de plastique avec 1% d'agarose. Membrane vitelline est enlevée manuellement avec une paire de pinces. Explants ectodermiques sont excisés du embryons en utilisant une aiguille de tungstène et une hairloop.
- Explants ectodermiques sont transférés dans un flacon en verre et fixé au formol à 3,7% en tampon phosphate salin (PBS) pendant 30 minutes. Explants fixes sont lavées avec du PBS à trois reprises (10 minutes chacun). DAPI est inclus dans le troisième lavage à tacher les noyaux.
- Les explants sont montés sur une lame de verre. Deux bandes de scotch sont attachés à la diapositive et les explants sont placés entre les deux bandes. Depuis la surface extérieure des explants est pigmentée, le côté intérieur de la explants doivent faire face à l'objectif du microscope. Ajouter deux à trois gouttes de 20 pl de la solution de montage (70% de glycérol dans du PBS, dont 25 mg / ml DABCO, anti-décoloration réactif) 11. Mettre une lamelle sur le dessus.
4. Imagerie des explants Sous un microscope à fluorescence
- Les échantillons sont considérés sous microscope à fluorescence Zeiss Axioplan avec des filtres appropriés.
- Les images sont prises avec l'attachement Apotome de visualiser un plan spécifique de plusieurs explants indépendants.
5. Cryosectioning
Cryosectioning est une autre façon de visualiser la distribution des protéines fluorescentes dans la cellule et plus applicable pour immunocoloration. Au stade 10, les embryons sont fixes pendant 1-2 heures avec fixateur de Dent (20% de DMSO, 80% de méthanol), lavées avec du PBS, et intégrés dans une solution de sucrose 15% des poissons gelatin/15 11%. Les embryons sont congelés rapidement embarqué sur la glace sèche et cryocoupes sont générés sur Leica cryostat. Sections de la Croix comprendrait cellules ectodermiques qui héritent des ARN injectés et leurs produits protéiques traduites. Les sections de conserver la fluorescence et peuvent être immunocolorés avec des anticorps spécifiques et étiquetés avec des anticorps secondaires conjugués avec la fluorescence. Les noyaux sont colorés au DAPI. Les milieux de montage sont les mêmes que décrit ci-dessus. L'imagerie peut être réalisée comme décrit ci-dessus.
6. Les résultats représentatifs:
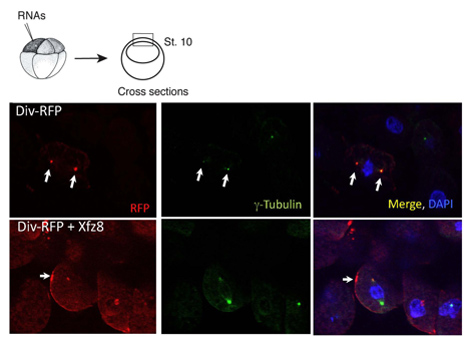
Figure 1. Récepteurs Frizzled recrues Diversin à la membrane cellulaire. Ectoderme cellules exprimant 8 Frizzled (Xfz8) et Div-DP ARN révèle Div-DP à la membrane cellulaire, au lieu du centrosome (tel que révélé par g-tubuline de co-marquage). Le schéma de l'expérience est au sommet, une coupe transversale typique est montré.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Nous avons utilisé le protocole ci-dessus pour caractériser la localisation subcellulaire des Diversin. Dans des explants pôle animal, Diversin-DP a été détecté à côté du noyau et colocalisés avec g-tubuline, un marqueur centrosomale, dans cryocoupes (figure 1). Une fois la localisation subcellulaire d'une protéine est identifiée, les constructions de suppression peuvent être générés pour établir quels domaines protéiques sont nécessaires et suffisants pour la localisation subcellulaire. En utilisant cette approche, les domaines de la localisation de centrosomale Diversin ont été cartographiés à l'Orient et dans les domaines carboxy-terminale de la protéine, les deux contenant le motif coiled-coil 8.
Le même protocole peut être utilisé dans les études, dans laquelle la localisation des protéines est altérée en réponse à la signalisation. Nous avons constaté que Wnt protéines sécrétées agir pour relocaliser Div-DP à des structures ponctuées adjacente à la membrane cellulaire, tandis que FZ8 recrues Div-DP aux correctifs membrane cellulaire (figure 1). Nous avons également découvert que le domaine carboxy-terminal n'est pas essentielle pour la membrane de recrutement en soi, mais nécessaire pour le recrutement de membrane polarisée.
En résumé, le protocole ci-dessus expérimentale aidera dans diverses études d'interactions protéine-protéine et la localisation de protéines pour les différents compartiments cellulaires après stimulation des cellules avec des facteurs de croissance spécifiques ou des protéines de signalisation.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Aucun conflit d'intérêt déclaré.
Acknowledgments
La recherche dans le laboratoire Sokol est parrainé par le Institues national de la santé.
References
- Gurdon, J. B. Embryonic induction --- molecular aspects. Development. 99, 285-306 (1987).
- Principles of Developmental Genetics. Moody, S. A. , Academic Press. (2007).
- Clevers, H. Wnt/beta-catenin signaling in development and disease. Cell. 127, 469-480 (2006).
- Klaus, A., Birchmeier, W. Wnt signalling and its impact on development and cancer. Nat Rev Cancer. 8, 387-398 (2008).
- Gordon, M. D., Nusse, R. Wnt signaling: multiple pathways, multiple receptors, and multiple transcription factors. J Biol Chem. 281, 22429-22433 (2006).
- Schwarz-Romond, T., Asbrand, C., Bakkers, J., Kuhl, M., Schaeffer, H. J., Huelsken, J., Behrens, J., Hammerschmidt, M., Birchmeier, W. The ankyrin repeat protein Diversin recruits Casein kinase Iepsilon to the beta-catenin degradation complex and acts in both canonical Wnt and Wnt/JNK signaling. Genes Dev. 16, 2073-2084 (2002).
- Moeller, H., Jenny, A., Schaeffer, H. J., Schwarz-Romond, T., Mlodzik, M., Hammerschmidt, M., Birchmeier, W. Diversin regulates heart formation and gastrulation movements in development. Proc Natl Acad Sci U S A. 103, 15900-15905 (2006).
- Itoh, K., Jenny, A., Mlodzik, M., Sokol, S. Y. Centrosomal localization of Diversin and its relevance to Wnt signaling. J. Cell Sci. 122, 3791-3798 (2009).
- Itoh, K., Jacob, J., Sokol, Y. S. A role for Xenopus Frizzled 8 in dorsal development. Mech Dev. 74, 145-157 (1998).
- Newport, J., Kirschner, M. A major developmental transition in early Xenopus embryos: I. characterization and timing of cellular changes at the midblastula stage. Cell. 30, 675-686 (1982).
- Itoh, K., Brott, B. K., Bae, G. U., Ratcliffe, M. J., Sokol, S. Y. Nuclear localization is required for Dishevelled function in Wnt/beta-catenin signaling. J Biol. 4, 3-3 (2005).



