Summary
Xenopus embryonalen Ektoderm hat sich ein attraktives Modell für Studien der Zellpolarität. Ein Assay ist beschrieben, in denen subzellulären Verteilung von fluoreszierenden Proteinen in Ectodermzellen beurteilt wird. Dieses Protokoll wird dazu beitragen, Fragen im Zusammenhang mit räumlichen Steuerung der Signalisierung.
Abstract
Zellpolarität ist eine fundamentale Eigenschaft von eukaryotischen Zellen, die dynamisch von beiden innerer und äußerer Faktoren ist während der embryonalen Entwicklung 1, 2 geregelt. Einer der Signalwege in dieser Regelung beteiligt ist, des Wnt-Signalwegs, der oft verwendet wird während der Embryogenese und entscheidend für die menschliche Krankheit 3, 4, 5. Mehrere molekularen Komponenten dieses Signalwegs koordinativ regulieren Signalisierung in einem räumlich eingeschränkten Weise, aber die zugrunde liegenden Mechanismen sind noch nicht vollständig verstanden. Xenopus embryonalen Epithelzellen ist ein ausgezeichnetes System zur subzellulären Lokalisation verschiedener Signalproteine zu studieren. Fluorescent Fusionsproteine in Xenopus Embryonen, die durch RNA Mikroinjektion ausgedrückt sind, ektodermalen Explantate vorbereitet und Proteinlokalisierung wird durch Epifluoreszenz ausgewertet. In diesem experimentellen Protokoll beschreiben wir, wie subzelluläre Lokalisierung von Diversin, eine zytoplasmatische Protein, das in Signal-und Zellpolarität Bestimmung 6, 7 eine Rolle spielt visualisiert in Xenopus ektodermalen Zellen Wnt Signaltransduktion 8-Studie ist. Coexpression eines Wnt-Liganden oder ein Frizzled-Rezeptor verändert die Verteilung von Diversin mit rot fluoreszierendes Protein, RFP fusioniert und Rekruten an die Zellmembran in einer polarisierten Mode 8, 9. Diese ex vivo-Protokoll soll eine sinnvolle Ergänzung zur in vitro-Studien von kultivierten Säugetierzellen, in denen räumliche Steuerung der Signalisierung unterscheidet sich von dem intakten Gewebe und ist sehr viel schwieriger zu analysieren.
Protocol
1. In-Vitro-Fertilisation von Xenopus Eier
- Erhalten Eier von weiblichen Frösche, die mit humanem Chorion-Gonadotropin (400 Einheiten / Frosch) 12 Stunden vor dem Experiment wurden injiziert.
- Die Eier in eine kleine Menge (0.5-1 ml) von 1 geändert Ringer x Marc-Lösung (MMR) 10, um die Eier und befruchtet sie in vitro mit einem kleinen Stück seziert Hoden. Nach 2-3 min, fügen Sie 0,1 x MMR auf die gesamte Oberfläche der Eier zu decken. HCL (eingestellt auf pH 8 mit Natronlauge) - In 20 Minuten wird Eis Gallerthülle um 3% Cystein entfernt. Die Eier werden mit 0,1 x MMR dreimal gewaschen und nach links in eine kalte Inkubator (13 ° C) für Injektionszwecke.
- Befruchteten Eier dürfen auf 2-4 Zell-Stadium zu entwickeln. Für Injektionen, werden die Embryonen in die Lösung mit 3% Ficoll, 0,5 x MMR überführt.
2. RNA Mikroinjektion
- RNAs sind von linearisierten DNA-Vorlagen verwenden mMessage mMachine Kit (Ambion) synthetisiert und verdünnt mit RNase-freiem Wasser an der Börse Konzentration von 0,1-1 ug / ul. Optimale Dosen von RNAs für Injektionen werden in Pilotversuchen ermittelt. RNAs für Diversin-RFP, die Membran-Marker GFP-CAAX und Frizzled 8 sind bei 0,1-1 ng pro Injektion verwendet.
- Injektionsnadeln sind mit einer Nadel Abzieher aus einer Kapillare und dann mit einer Nadel Schleifer vorbereitet. Vor der Injektion ist jede Nadel mit Wasser kalibriert, um 10 nl Flüssigkeit pro Injektion auszuwerfen.
- Für Injektionen, werden Embryonen auf einer Plastikschale in einen großen Tropfen von 3% Ficoll, 0,5 x MMR platziert. Ein Mikroliter der RNA-Lösung wird in einer Injektionsnadel mit Narishige Mikroinjektor gesaugt. 10 nl von RNA in tierischen Blastomeren von 8 Embryonen 2-3 mal gespritzt. Die injizierten Embryonen werden in einen Brunnen der 12-Well-Platte übertragen.
3. Vorbereitung ektodermale Explantate
- Wenn der injizierten Embryonen frühen Gastrula-Stadium erreichen, werden sie in 0,6 x MMR-Lösung in einem 3 cm Plastikschale mit 1% Agarose beschichtet übertragen. Dotterhaut wird manuell mit einer Pinzette entfernt werden. Ektodermale Explantate aus den Embryonen mit einem Tungsten Nadel und ein hairloop herausgeschnitten.
- Ektodermale Explantate werden in einen Glaskolben überführt und fixiert mit 3,7% Formaldehyd in Phosphat-gepufferter Kochsalzlösung (PBS) für 30 Minuten. Feste Explantate werden dreimal mit PBS (10 Minuten) gewaschen. DAPI wird in den dritten zu waschen, um Kerne Fleck enthalten.
- Explantate werden auf einen Objektträger aus Glas montiert. Zwei Streifen Tesafilm an die Folie angebracht und die Explantate werden zwischen den beiden Streifen platziert. Seit der äußeren Oberfläche der Explantate ist pigmentiert, sollte die Innenseite der Explantate Gesicht des Mikroskop-Objektivs. Fügen Sie 2-3 20 pl Tropfen der Montage-Lösung (70% Glycerin in PBS mit 25 mg / ml DABCO, Anti-Fading-Reagenz) 11. Legen Sie ein Deckglas auf.
4. Imaging von Explantaten unter einem Fluoreszenzmikroskop
- Die Proben werden unter Zeiss Axioplan Fluoreszenzmikroskop mit geeigneten Filtern angesehen.
- Die Bilder werden mit dem ApoTome Bindung an ein bestimmtes Flugzeug von mehreren unabhängigen Explantaten visualisieren genommen.
5. Kryoschneiden
Kryoschneiden ist eine alternative Möglichkeit, um die Verteilung von fluoreszierenden Proteinen in der Zelle und eher für Immunfärbung zu visualisieren. Auf Stufe 10 sind Embryonen, die für 1-2 Stunden mit Dents Fixativ (20% DMSO, 80% Methanol) fixiert, mit PBS gewaschen und eingebettet in 15% Fisch gelatin/15% Saccharose-Lösung 11. Die eingebetteten Embryonen sind schnell auf Trockeneis eingefroren und Gefrierschnitten auf Leica Kryostat generiert. Querschnitte würde ektodermalen Zellen, injiziert RNAs und deren translatierte Protein-Produkte übernehmen. Die Abschnitte behalten Fluoreszenz und können mit spezifischen Antikörpern immunhistochemisch und dann beschriftet mit Sekundärantikörper konjugiert mit Fluoreszenz. Zellkerne sind mit DAPI gefärbt. Die Montage Medien sind die gleichen wie oben beschrieben. Imaging kann wie oben beschrieben durchgeführt werden.
6. Repräsentative Ergebnisse:
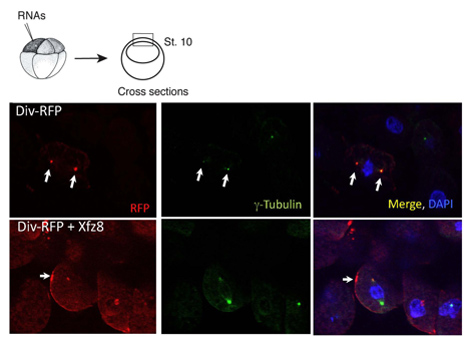
Abbildung 1. Frizzled-Rezeptor rekrutiert Diversin an der Zellmembran. Ektoderm-Zellen, die Frizzled 8 (Xfz8) und Div-RFP RNAs zeigen Div-RFP an der Zellmembran, anstelle der Zentrosom (wie von g-Tubulin-Co-Färbung zeigte). Das Schema des Experiments ist an der Spitze, ein typischer Querschnitt dargestellt.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Wir haben die oben genannten Protokoll verwendet, um die subzelluläre Lokalisierung von Diversin charakterisieren. In animalen Pol Explantate wurde Diversin-RFP neben dem Zellkern und erkannt Kolokalisation mit g-Tubulin, ein zentrosomale Marker, in Gefrierschnitten (Abbildung 1). Sobald die subzelluläre Lokalisierung eines Proteins identifiziert ist, kann das Löschen Konstrukte erzeugt werden, um festzustellen, welche Proteindomänen notwendig und ausreichend für die subzelluläre Lokalisation sind. Mit diesem Ansatz haben die zentrosomale Lokalisierung Domänen von Diversin in der Mitte wurde kartiert und in der carboxyterminalen Domänen des Proteins, die beide mit den Coiled-Coil-Motiv 8.
Dasselbe Protokoll kann in Studien eingesetzt werden, in denen Proteinlokalisierung in Reaktion auf Signal verändert wird. Wir fanden, dass Wnt sezernierten Proteinen zu Div-RFP kann punktförmige Strukturen neben der Zellmembran zu verlagern handeln, während Fz8 Rekruten Div-RFP Zellmembran Patches (Abbildung 1). Wir weiter festgestellt, dass die Carboxy-terminale Domäne ist nicht für Membran-Rekrutierung per se wichtig, sondern notwendig für polarisierte Membran Rekrutierung.
Zusammenfassend werden die oben genannten experimentellen Protokoll in verschiedenen Studien von Protein-Protein-Wechselwirkungen und Protein-Lokalisierung zu verschiedenen zellulären Kompartimenten nach Stimulation der Zellen mit spezifischen Wachstumsfaktoren oder Signalproteine zu helfen.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Keine Interessenskonflikte erklärt.
Acknowledgments
Forschung in der Sokol-Labor wird von der National Institues of Health gefördert.
References
- Gurdon, J. B. Embryonic induction --- molecular aspects. Development. 99, 285-306 (1987).
- Principles of Developmental Genetics. Moody, S. A. , Academic Press. (2007).
- Clevers, H. Wnt/beta-catenin signaling in development and disease. Cell. 127, 469-480 (2006).
- Klaus, A., Birchmeier, W. Wnt signalling and its impact on development and cancer. Nat Rev Cancer. 8, 387-398 (2008).
- Gordon, M. D., Nusse, R. Wnt signaling: multiple pathways, multiple receptors, and multiple transcription factors. J Biol Chem. 281, 22429-22433 (2006).
- Schwarz-Romond, T., Asbrand, C., Bakkers, J., Kuhl, M., Schaeffer, H. J., Huelsken, J., Behrens, J., Hammerschmidt, M., Birchmeier, W. The ankyrin repeat protein Diversin recruits Casein kinase Iepsilon to the beta-catenin degradation complex and acts in both canonical Wnt and Wnt/JNK signaling. Genes Dev. 16, 2073-2084 (2002).
- Moeller, H., Jenny, A., Schaeffer, H. J., Schwarz-Romond, T., Mlodzik, M., Hammerschmidt, M., Birchmeier, W. Diversin regulates heart formation and gastrulation movements in development. Proc Natl Acad Sci U S A. 103, 15900-15905 (2006).
- Itoh, K., Jenny, A., Mlodzik, M., Sokol, S. Y. Centrosomal localization of Diversin and its relevance to Wnt signaling. J. Cell Sci. 122, 3791-3798 (2009).
- Itoh, K., Jacob, J., Sokol, Y. S. A role for Xenopus Frizzled 8 in dorsal development. Mech Dev. 74, 145-157 (1998).
- Newport, J., Kirschner, M. A major developmental transition in early Xenopus embryos: I. characterization and timing of cellular changes at the midblastula stage. Cell. 30, 675-686 (1982).
- Itoh, K., Brott, B. K., Bae, G. U., Ratcliffe, M. J., Sokol, S. Y. Nuclear localization is required for Dishevelled function in Wnt/beta-catenin signaling. J Biol. 4, 3-3 (2005).



