Summary
आदेश में glioma के उपचार के लिए उपन्यास चिकित्सकीय मानदंड का मूल्यांकन करने के लिए, शारीरिक प्रासंगिक मॉडल आवश्यक हैं. हम intracranial xenograft मॉडल है कि अधिक तेजी से और stereotactic दृष्टिकोण से सुरक्षित है की स्थापना के लिए एक implantable गाइड पेंच प्रक्रिया का उपयोग.
Abstract
immunosuppressed चूहों के मस्तिष्क में मानव ट्यूमर कोशिकाओं की कलम बांधने का काम (glioma) glioblastoma और medulloblastoma सहित मस्तिष्क के कैंसर के अध्ययन के लिए एक स्थापित तरीका है. व्यापक रूप से इस्तेमाल किया stereotactic दृष्टिकोण केवल एक समय में एक ही पशु के इंजेक्शन के लिए अनुमति देता है, श्रम गहन और अति विशिष्ट उपकरणों की आवश्यकता है. गाइड पेंच विधि, शुरू में लाल एट अल, 1 द्वारा विकसित बोझिल stereotactic प्रक्रियाओं को समाप्त करने के लिए विकसित किया गया था. अब हम एक संशोधित गाइड पेंच दृष्टिकोण है कि तेजी से और असाधारण रूप से सुरक्षित है वर्णन है, जो दोनों के महत्वपूर्ण नैतिक विचार कर रहे हैं. विशेष रूप से, हमारे प्रक्रिया अब एक जलसेक पंप है कि 10 के लिए एक साथ ट्यूमर कोशिकाओं के इंजेक्शन के साथ किया जा जानवरों करने के लिए अनुमति देता है शामिल हैं.
एक पूरी तरह से मानव एंटीबॉडी HGF / स्कैटर कारक वर्तमान में नैदानिक मूल्यांकन 2-5 के दौर से गुजर के लिए निर्देशित, इस प्रक्रिया की उपयोगिता का प्रदर्शन करने के लिए, हम चूहों में intracranial xenografts है, जो तब AMG102 साथ इलाज किया गया के रूप में मानव U87MG glioma कोशिकाओं की स्थापना की. AMG102 के प्रणालीगत इंजेक्शन काफी intracranial U87MG xenografts के साथ सभी चूहों के अस्तित्व लंबे समय तक और पूरा इलाज की एक संख्या में हुई.
यह अध्ययन यह दर्शाता है कि गाइड पेंच विधि intracranial xenografts की स्थापना के लिए एक सस्ती, अत्यधिक प्रतिलिपि प्रस्तुत करने योग्य दृष्टिकोण है. इसके अलावा, यह मस्तिष्क के कैंसर के उपचार के लिए उपन्यास चिकित्सात्मक रणनीतियों के मान्य के लिए एक प्रासंगिक शारीरिक मॉडल उपलब्ध कराता है.
Protocol
1. सेल लाइनों
- U87MG glioma कोशिकाओं DMEM-F12 के साथ बड़े टिशू कल्चर बोतल 5% भ्रूण गोजातीय सीरम (FBS) के साथ पूरक में सुसंस्कृत हैं.
- कक्ष बोतल को गर्म फास्फेट के साथ दो बार धोने से काटा कर रहे हैं खारा (पीबीएस) buffered और उन्हें 37 में incubating ° सी 0.25% trypsin और 0.05% EDTA युक्त पीबीएस के 10 मिलीलीटर के साथ 5 मिनट के लिए. एक बार कोशिकाओं को उठा लिया, वे एक 50 मिलीलीटर संस्कृति मीडिया और centrifuged (4 मिनट के लिए 300 एक्स छ) के 10 मिलीग्राम से युक्त ट्यूब में रखा जाता है.
- धोने के बाद, कोशिकाओं को 10 के एक एकाग्रता में resuspended हैं x 10 संस्कृति मीडिया, जो 50,000 कोशिकाओं / 5 μl का एक टीका के लिए अनुमति दी में 6 मिलीग्राम / है.
- कक्ष intracranial इंजेक्शन जब तक बर्फ पर रखा जाता है.
2. गाइड intracranial पेंच पेंच
यह प्रक्रिया कई दिनों किया जा सकता है कोशिकाओं के इंजेक्शन से पहले. यहाँ वर्णित सभी प्रक्रियाओं सख्त बाँझ शर्तों के तहत बाहर किया गया है.
- चूहे (BALB / ग परमाणु / परमाणु महिला, 5-6 सप्ताह, लगभग 18G) पहचान के प्रयोजनों के लिए गिने जा रहे हैं, वजन और ketamine (100 मिलीग्राम / किग्रा) और xylazine (5 मिलीग्राम की एक मिश्रण का एक intraperitoneal इंजेक्शन (आईपी) के साथ anesthetised / किग्रा).
- त्वचा के नीचे एक आयोडीन समाधान के साथ साफ हो जाता है और एक छोटा सा चीरा (2-3 मिमी) midline और interaural लाइन के लिए पूर्वकाल की दाईं ओर के साथ किया जाता है. इस खोपड़ी के राज्याभिषेक और बाण के समान sutures को उजागर करता है. शीर्षस्थान इन दो sutures के जंक्शन पर तैनात है.
- गाइड पेंच प्रविष्टि बिंदु तो एक 2.5 मिमी पार्श्व और 1 मिमी शीर्षस्थान के लिए पूर्वकाल बिंदु पर चिह्नित किया है. इस बिंदु सीधे पूंछवाला एक नाभिक के ऊपर स्थित है .
- एक 1 x 1 मिमी गहरे छेद एक बाँझ dura के लिए खोपड़ी के माध्यम से मोड़ ड्रिल आयोजित हाथ के साथ drilled है.
- एक निष्फल गाइड पेंच है कि dura में खोपड़ी की सतह के नीचे 1.6 मिमी का विस्तार होगा तो एक स्क्रू ड्राइवर के साथ छेद में bolted जब तक खोपड़ी (चित्रा 1 ए) के साथ फ्लश.
- एक बाँझ ख़ंजर या पेंच डमी तो गाइड पेंच के मध्य छेद में रखा गया है खोलने (चित्रा 1 बी) बंद करने के लिए.
- घाव Vetbond ऊतक (cyanoacrylate n-butyl) चिपकने वाला और चूहों के साथ बंद कर दिया है reversine के एक intraperitoneal इंजेक्शन (छोटे जानवर) (0.1 मिलीग्राम / किग्रा) और analgesia के लिए carprofen (5 mg/kg/100 μl) दिया जाता है. चूहे तो एक वार्मिंग (36 डिग्री सेल्सियस) चटाई जो 20 मिनट के लिए ले जा सकते हैं पर ठीक करने के लिए अनुमति दी जाती है. चूहे अक्सर निगरानी कर रहे हैं और इस वसूली समय के दौरान मनाया हैं जब तक वे पूरी तरह से होश में हैं.
3. Intracranial सेलुलर engraftment
- एक बाँझ cuffed हैमिल्टन सिरिंज सुई सुई के केवल 2 मिमी की अनुमति पुस्तिका पेंच आउटलेट (चित्रा 1 बी) के नीचे विस्तार टिप करने के लिए एक छोटे से प्लास्टिक की अंगूठी को लागू करने के द्वारा तैयार की है. अंतिम टीका बिंदु इसलिए खोपड़ी की सतह के नीचे 3.5 मिमी है.
- गाइड पेंच सर्जरी के बाद चार दिनों, चूहों फिर रहे हैं anesthetized इसके बाद के संस्करण के रूप में (2.1) और एक छोटा सा चीरा गाइड पेंच पर बनाया है ख़ंजर हटायें.
- cuffed हैमिल्टन सिरिंज तो अच्छी तरह से मिश्रित एहतियात लेने के लिए नहीं बना सकते हैं या किसी भी हवाई बुलबुले आकर्षित कोशिकाओं के 5 μl के साथ भरा है.
- सिरिंज छिड़काव पंप करने के लिए सुरक्षित है और सुई गाइड पेंच (चित्रा 1C) में डाला जाता है. कोशिकाओं तो प्रति घंटे 30 μl की दर पर संचार कर रहे हैं.
- स्वचालित तंत्र (चित्रा 1D) हमें एक निरंतर प्रवाह की दर पर एक समय में 10 पशुओं को इंजेक्षन करने के लिए अनुमति दी. कक्ष cuffed हैमिलटन सिरिंज का उपयोग करके भी मैन्युअल कर सकते हैं इंजेक्शन जा या वैकल्पिक रूप से सिरिंज एक 200 μl विंदुक टिप है कि 3 मिमी द्वारा छंटनी 2 मिमी से सुई टिप गाइड पेंच से परे का विस्तार करने की अनुमति के द्वारा cuffed हो सकता है. इंजेक्शन तो एक निरंतर स्थिर गति में प्रदर्शन किया जाना चाहिए.
- जब जलसेक पूरा हो गया है, सिरिंज ध्यान से और हटाया ख़ंजर गाइड पेंच में जगह है. घाव सरेस से जोड़ा हुआ है बंद कर दिया और चूहों से पहले (2.7) के रूप में वसूली दवाएं दी जाती है और एक वार्मिंग चटाई पर ठीक करने की अनुमति दी.
4. चिकित्सीय चुनौती
- U87MG सेल टीका के बाद चार दिन, चूहों तौला और बेतरतीब ढंग से नियंत्रण और उपचार समूहों में विभाजित कर रहे हैं.
- नियंत्रण समूह एक अंतर peritoneal पीबीएस (100 μl) (आईपी) के इंजेक्शन दिया जाता है, जबकि इलाज समूह AMG102 (पीबीएस के 100 μl में 100 μg) के एक आईपी इंजेक्शन दिया जाता है.
- इंजेक्शन हर दूसरे दिन 14 दिनों के लिए दोहराया रहे हैं, 6 इंजेक्शन (चित्रा 2) के एक कुल.
- अंतिम इंजेक्शन के बाद, चूहों दैनिक में निगरानी कर रहे हैं और हर दूसरे दिन तौला.
- जब चूहों महत्वपूर्ण न्यूरोलॉजिकल dysfunctions (संतुलन अशांति, पक्षाघात), निर्जलीकरण, या 10% से अधिक वजन घटाने या मरणासन्न प्रदर्शित करने के लिए शुरू किया, वे humanely euthanised थे. ये मानवीय अंत बिंदु दिनों तो Kaplan-Meier अस्तित्व वक्र पर दर्ज किए गए.
5. चिकित्सकीय दक्षता का मूल्यांकन
6. प्रतिनिधि परिणाम:
नियंत्रण जानवरों के लिए कक्षों की प्रारंभिक टीका के बाद स्नायविक अशांति और वजन घटाने के 23 दिन के लक्षण दिखाने शुरू कर दिया. AMG102 इलाज समूह में 35 दिनों के लिए यह काफी देरी हुई. दरअसल 35 दिन, 77% (n = 7 / 9) नियंत्रण समूह के euthanized किया गया था. अस्तित्व कापलान Meier वक्र AMG102 उपचार (चित्रा 3) के जवाब में स्पष्ट रूप से अस्तित्व में उल्लेखनीय वृद्धि दर्शाता है. 70 दिन तक, नियंत्रण चूहों के 88% (n = 8 9 /) 37% की तुलना में euthanized किया गया था AMG102 इलाज समूह (n = 3 / 8). दिमाग के histological विश्लेषण की पुष्टि की है कि नियंत्रण समूह में सभी 9 पशुओं विकसित ट्यूमर 8 AMG102 इलाज चूहों (चित्रा 4) के केवल 3 की तुलना में.
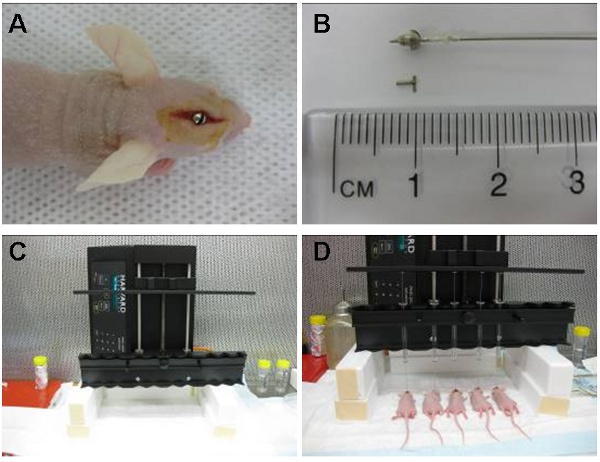
चित्रा 1: छवि (ए) intracranial गाइड पूंछवाला नाभिक सीधे ऊपर स्थित क्षेत्र में तैनात पेंच से पता चलता है. cuffed हैमिलटन सिरिंज (पूर्व लोड कोशिकाओं के साथ) तो गाइड पेंच के अंदर रखा है इतना है कि सुई के 2 मिमी गाइड परे फैली हुई है और कोशिकाओं पूंछवाला नाभिक के अंदर 3.5 मिमी अंतःक्षिप्त रहे हैं. सिरिंज और बाद में हटा दिया जाता है एक ख़ंजर (बी) के द्वारा प्रतिस्थापित. स्वत: जलसेक डिवाइस (सी) एक समय में 10 पशुओं को इंजेक्षन कर सकते हैं. यहाँ दिखाया गया पाँच एक साथ इंजेक्शन (डी).

चित्रा 2: अध्ययन प्रोटोकॉल के योजनाबद्ध. कक्ष 0 दिन 4 दिन पर इलाज शुरू करने के साथ अंतःक्षिप्त थे. नियंत्रण जानवरों पीबीएस (100 μl) आईपी का एक इंजेक्शन प्राप्त किया जबकि इलाज समूह AMG102 आईपी (100 μg/100 μl) का एक इंजेक्शन प्राप्त है. ये इंजेक्शन हर दूसरे दिन 10 दिनों के लिए दिए गए थे. 6 इंजेक्शन के कुल दिए गए. पशु तो तंत्रिका विज्ञान और शारीरिक गड़बड़ी के संकेत के लिए 70 दिनों के लिए निगरानी की गई.

चित्रा 3: Kaplan-Meier अस्तित्व नियंत्रण और AMG102 इलाज चूहों की तुलना वक्र . महत्वपूर्ण उत्तरजीविता AMG102 (पी = .005) के साथ इलाज के बाद प्राप्त हुई थी .

चित्रा 4: राज्याभिषेक मस्तिष्क नियंत्रण पशुओं में ट्यूमर के विकास (ए) और AMG102 इलाज पशुओं में कोई मस्तिष्क ट्यूमर के विकास (बी) का प्रदर्शन वर्गों के Microphotographs . स्केल पट्टी 1 मिमी है.
Discussion
intracranial गाइड पेंच विधि यहाँ प्रस्तुत intracranial xenografts के तेजी से और प्रतिलिपि प्रस्तुत करने योग्य स्थापना के लिए सक्षम बनाता है और एक प्रशिक्षित पशु तकनीशियन के हाथों में, इस प्रक्रिया को बहुत आसानी से एक stereotactic डिवाइस के लिए जरूरत के बिना किया जाता है. हमारी विधि एक गाइड पेंच के प्रयोग को जोड़ती है, के लिए सही vivo ट्यूमर के विकास के लिए सबसे उपयुक्त मस्तिष्क के क्षेत्र, और एक स्वचालित जलसेक पंप है कि 10 पशुओं के लिए एक साथ एक समय में की टीका के लिए अनुमति देता है का पता लगाने. गाइड पेंच वृद्धि प्रक्रिया प्रदर्शन करने के लिए कम से कम 5 मिनट लगते हैं. 30 μl / घंटे में कक्षों की स्वचालित जलसेक एक 5 μl मात्रा के लिए सिर्फ 10 मिनट लगते हैं. यह एक निरंतर दर पर सटीक dosing सुनिश्चित करता है और अतिरिक्त कपाल बढ़ intracranial दबाव के कारण क्षेत्र में सेल के निष्कासन के जोखिम को कम कर देता है. हम भी 10 μl संस्करणों के साथ इस कार्यविधि का प्रदर्शन और किसी भी अतिरिक्त कपाल ट्यूमर सेलुलर भाटा के कारण विकास मनाया नहीं. स्वचालित जलसेक पंप के रूप में भी कई जानवरों के साथ inoculated हम एक stereotactic प्रक्रिया है जो प्रति घंटे लगभग 15 पशुओं के लिए सीमित है की तुलना में प्रति घंटे 60 पशुओं को इंजेक्षन कर सकते हैं अनुमति देता है.
इस प्रक्रिया में सबसे महत्वपूर्ण कदम गाइड पेंच में खोपड़ी का स्थान है, के रूप में अपनी स्थिति के ट्यूमर के थोक के अंतिम स्थान निर्धारित करता है. यदि पुस्तिका पेंच भी केंद्रीय है, कोशिकाओं अगर पुस्तिका आगे तक रखा गया है जबकि दो मस्तिष्क गोलार्द्धों के बीच एक क्षेत्र में अंतःक्षिप्त किया जाएगा, कोशिकाओं को मस्तिष्क में बिल्कुल नहीं इंजेक्शन जाएगा. इसलिए यह आवश्यक है गाइड के पार्श्व 2.5 मिमी और 1 मिमी 1 शीर्षस्थान के लिए पूर्वकाल का पता लगाने में यथासंभव सही हो. इस अध्ययन में हम एक इस्पात गाइड पेंच का इस्तेमाल किया, हालांकि प्लास्टिक गाइड शिकंजा भी उन अध्ययनों कि जैसे एमआरआई या पीईटी 6 मस्तिष्क इमेजिंग की आवश्यकता के लिए उपलब्ध हैं. यहां तक कि अगर स्वचालित जलसेक पंप कुछ समूहों के लिए लागत अधिक बैठती है, कोशिकाओं को अभी भी मैन्युअल रूप से अधिक stereotactic दृष्टिकोण से जल्दी इंजेक्शन जा सकता है. कुल मिलाकर, इस तेजी से, सटीक और प्रतिलिपि प्रस्तुत करने योग्य विधि glioma medulloblastoma, और मस्तिष्क स्टेम ट्यूमर 7 का अध्ययन करने के लिए इस्तेमाल किया जा सकता है. इस प्रक्रिया अप्रत्याशित संवेदनाहारी प्रतिक्रियाओं (<1%) के कारण होने वाली मौतों के साथ हमारे दो प्रयोगशालाओं के बीच 500 से अधिक चूहों के पर प्रदर्शन किया गया है. चूहों कि गाइड पेंच के साथ bolted रहे थे और बाद में संचार के साथ कोशिकाओं को मरने या नहीं पीड़ित था प्रक्रिया का एक परिणाम के के रूप में किसी भी न्यूरोलॉजिकल जटिलताओं. पशु पिछले 100 दिनों किसी भी जटिलताओं के बिना बच गया है. हालांकि हम SCID की तरह बालों के साथ एक गंजा माउस, माउस इम्युनो - समझौता का उपयोग करना बस के रूप में उपयुक्त प्रदान की खोपड़ी बाल सर्जरी से पहले हटा दिया गया था साइट को साफ रखने और गाइड पेंच के साथ हस्तक्षेप बालों को रोकने होगा.
वहाँ कई उपन्यास चिकित्सा वर्तमान में 8-10 glioma के उपचार के लिए विकसित किया जा रहा हैं. हाल ही में हम पता चला है कि चमड़े के नीचे U87MG glioma xenografts से हिचकते 3 AMG102 के साथ इलाज किया जा सकता है, एक humanized प्रतिरक्षी वर्तमान में 5 glioma में नैदानिक मूल्यांकन के दौर से गुजर HGF करने के लिए निर्देशित. हम प्रयोग किया जाता विधि यहाँ का वर्णन करने के लिए नग्न चूहों के दिमाग में intracranial U87MG ट्यूमर स्थापित. हमारे अध्ययन से स्पष्ट रूप से विधि की उपयोगिता को दर्शाता है और यह दर्शाता है कि AMG102 काफी orthotopic U87MG xenografts के विकास को रोकता है. हम इस मॉडल का उपयोग निर्धारित करने के लिए क्या अन्य चिकित्सा AMG102 साथ संयोजन में उपयोग किया जा सकता है ट्यूमर के विकास की अधिक प्रभावी अवरोध प्राप्त करने के लिए जारी रहेगा.
Disclosures
यह काम Amgen इंक से एक अनुसंधान अनुदान द्वारा समर्थित किया गया था
Acknowledgments
लेखकों के लिए इस मॉडल को विकसित करने में सहायता के लिए Verlene हेनरी और लिंडसे होम्स का शुक्रिया अदा करना होगा. इस काम आंशिक रूप से जेम्स एस McDonnell फाउंडेशन (220020173 #) द्वारा वित्त पोषित किया गया था.
Materials
| Name | Company | Catalog Number | Comments |
| DMEM/F12 | Invitrogen | 12634010 | |
| FCS | Bovogen | SFBS | |
| Trypsin | Invitrogen | 15050065 | |
| EDTA | Sigma-Aldrich | E6758 | |
| Balb/c nu/nu mice | ARC Perth | ||
| Screw Holder | Plastics One | SD-1 | |
| Drill Holder | Plastics One | DH-1 | |
| Drill Bit | Plastics One | D#60 | |
| Screw guide (metal) | Plastics One | C212SG | |
| Screw Dummy (stylus) | Plastics One | C212SD | |
| Hamilton Syringe (10 μl 26g cemented needle) | Grace Division Discovery Science | 80075 | |
| PHD 22/2000 infusion pump | Harvard Apparatus | 70-2003 | Optional |
| Vetbond | 3M | 1469SB | |
| Thermo pad | Harvard Apparatus | 340390 |
References
- Lal, S. An implantable guide-screw system for brain tumor studies in small animals. J Neurosurg. 92, 326-333 (2000).
- Jun, H. T. AMG 102, a fully human anti-hepatocyte growth factor/scatter factor neutralizing antibody, enhances the efficacy of temozolomide or docetaxel in U-87 MG cells and xenografts. Clin Cancer Res. 13, 6735-6742 (2007).
- Pillay, V. The plasticity of oncogene addiction: implications for targeted therapies directed to receptor tyrosine kinases. Neoplasia. 11, 448-458 (2009).
- Buchanan, I. M. Radiosensitization of glioma cells by modulation of Met signaling with the hepatocyte growth factor neutralizing antibody. AMG102. J Cell Mol Med. 15, 1999-2006 (2011).
- Wen, P. Y. A phase II study evaluating the efficacy and safety of AMG 102 (rilotumumab) in patients with recurrent glioblastoma. Neuro Oncol. 13, 437-446 (2011).
- Caretti, V. Monitoring of Tumor Growth and Post-Irradiation Recurrence in a Diffuse Intrinsic Pontine Glioma Mouse Model. Brain Pathol. 4, 441-451 (2011).
- Jallo, G. I., Volkov, A., Wong, C., Carson, B. S., Penno, M. B. A novel brainstem tumor model: functional and histopathological characterization. Childs Nerv. Syst. 22, 1519-1525 (2006).
- Johns, T. G. The efficacy of epidermal growth factor receptor-specific antibodies against gliomaxenografts is influenced by receptor levels, activation status, and heterodimerization. Clin Cancer Res. 13, 1911-1925 (2007).
- Scott, A. M. A phase I clinical trial with monoclonal antibody ch806 targeting transitional state and mutant epidermal growth factor receptors. Proc. Natl. Acad. Sci. U. S. A. 104, 4071-4076 (2007).
- Niyazi, M. Therapeutic options for recurrent malignant glioma. Radiother. Oncol. 98, 1-14 (2011).



