Summary
glioma의 치료에 새로운 치료 패러다임을 평가하기 위해, 생리 관련 모델은 필수적입니다. 우리는 stereotactic 접근 방식보다 더 빠르고 안전 intracranial 이종 이식 모델의 설립을위한 implantable 가이드 스크류 절차를 사용합니다.
Abstract
immunosuppressed 마우스의 두뇌로 인간의 종양 세포의 이식하는 것은 glioblastoma (glioma)과 medulloblastoma 포함한 뇌 암 연구를 위해 설립 방법입니다. 널리 사용되는 stereotactic 접근 방식은 한 번에 하나의 동물의 주입을 허용, 노동 집중하고 고도의 전문 장비를 필요로합니다. 처음 Lal 외. 1가 개발한 가이드 스크류 방식은 성가신 stereotactic 절차를 제거하기 위해 개발되었습니다. 우리는 지금 매우 신속하고 안전 변경 안내 스크류 방식을 설명하는, 중요한 윤리적 고려 둘 중. 특히, 우리의 절차는 지금 동시에 종양 세포로 주입해야하는 10 동물있게 주입 펌프를 포함합니다.
HGF / 현재 임상 평가 2-5 겪고 산란 계수로 이동 완전 인간 항체,이 절차의 유틸리티를 입증하기 위해, 우리는 다음 AMG102 취급했다 생쥐에 intracranial xenografts, 인간 U87MG glioma 세포를 설립하였습니다. AMG102의 체계적 주입 크게 intracranial U87MG의 xenografts 모든 생쥐의 생존을 연장하고 완전한 치료의 여러 결과.
이 연구는 가이드 나사 방법은 intracranial xenografts 수립을위한 저렴한 높은 재현성 방법입니다 보여줍니다. 또한, 그것은 뇌 암의 치료를위한 새로운 치료 전략을 검증을 위해 관련 생리적 모델을 제공합니다.
Protocol
1. 셀 라인
- U87MG glioma 세포 5 % 태아 소 혈청 (FBS)와 보충 DMEM - F12 대형 조직 문화 flasks에서 양식입니다.
- 세포 따뜻한 인산과 함께 두 번 flasks 닦고하여 수확 아르 식염수 (PBS)는 버퍼와 37에서 그들을 잠복기 ° 0.25 %의 트립신과 0.05 % EDTA (에틸렌 다이아 민 테트라 초산)를 포함하는 PBS의 10 ML 5 분 C. 일단 세포들은 문화 미디어와 centrifuged (4 분 300 X G) 10 ML을 포함한 50 ML 튜브에 배치되며, 해제됩니다.
- 세척 후, 세포 10의 농도에 resuspended 아르 X 10 μl 50,000 세포 / 5의 접종에 대한 허용 문화 매체에 6 / ML.
- 전지는 intracranial 사출까지 얼음에 보관됩니다.
2. 탈당 intracranial 가이드 나사
이 절차는 세포의 주입하기 전에 몇 일 진행하실 수 있습니다. 여기에서 설명한 모든 절차가 엄격한 무균 조건 하에서 실시되었습니다.
- 생쥐 (BALB / C 뉴 / 뉴 여성, 5-6주, 약 18g), 식별을 위해 번호를 무게와 케타민 (100 MG / kg)와 xylazine (5 MG의 혼합물의 intraperitoneal (IP) 주입과 anesthetised 아르 / kg).
- 피부는 요오드 솔루션 닦여 있으며 작은 절개 (2~3mm)은 중간선과 interaural 라인 앞쪽에의 오른쪽을 따라 이루어집니다. 이것은 두개골의 코로나와 화살 봉합를 제공합니다. bregma는이 두 봉합의 교차점에 위치합니다.
- 안내 나사 진입 점은 다음 2.5 mm 수평 및 bregma에 앞쪽에 1mm 지점에서 표시됩니다. 이 시점은 바로 꼬리가있는 핵 위 1에 위치하고 있습니다.
- 1 X 1mm 깊은 구멍은 경질에 두개골을 통해 트위스트 드릴을 개최 살균 손을 뚫고있다.
- 경질로 두개골 표면 아래 1.6 mm를 연장합니다 소독 안내 나사는 다음 스크류 드라이버 구멍으로 나올 수있는 두개골 (그림 1A)와 플러시까지.
- 무균 탐침 또는 스크류 더미는 다음 오프닝 (그림 1B)를 닫습 가이드 나사의 중앙 구멍에 배치됩니다.
- 상처가 Vetbond 조직 접착제 (N - 부틸 cyanoacrylate)와 생쥐와 함께 닫혀있다는 intraperitoneal reversine의 주입 (작은 동물) (0.1 ML / kg)과 진통제에 대한 carprofen을 (5 mg/kg/100 μl) 제공됩니다. 마우스 그런 다음 20 분 소요될 수 온난 매트 (36 ° C)에서 복구하는 허용됩니다. 그들이 완전히 의식 때까지 마우스가 자주 모니터링하고 복구 시간 동안 관찰됩니다.
3. Intracranial 세포 engraftment
- 무균 수갑에 채워진 해밀턴 주사기는 가이드 나사 콘센트 (그림 1B) 아래 연장하기 위해 바늘의 단지 2mm을 허용 바늘 끝에 작은 플라스틱 반지를 적용하여 준비가되어 있습니다. 최종 접종 지점 따라서 두개골 표면 아래 3.5 mm입니다.
- 가이드 나사 수술 다음과 같은 4 일, 마우스는 위에서 다시 anesthetized 아르 (2.1)와 작은 절개는 탐침을 제거하는 가이드 나사를 통해 이루어집니다.
- 수갑에 채워진 해밀턴 주사기 그러면 어떤 공기 방울을 만들거나 세우하지주의를 복용 잘 혼합 세포의 5 μl로 가득 차 있습니다.
- 주사기는 재관류 펌프로 확보하고 바늘은 가이드 나사 (그림 1C)에 삽입됩니다. 세포는 다음 시간 30 μl의 속도로 주입됩니다.
- 자동 장치 (그림 1D)는 우리가 일정한 유량 한 번에 10 동물까지 주입 수있었습니다. 세포도 수갑에 채워진 해밀턴 주사기를 사용하여 수동으로 분사가 될 수도 있고 아니면 다른 방법으로 주사기는 바늘 끝이 2mm로 안내 나사 넘어 확장할 수 있도록 3mm로 손질되어 200 μl 피펫 팁에 의해 수갑에 채워진 수 있습니다. 주입은 다음 일정한 속도로 지속적으로 수행되어야합니다.
- 주입이 완료되면, 주사기는 신중하게 제거되고 탐침은 가이드 스크류로 대체됩니다. 상처가 닫히고 접착되고 생쥐 (2.7) 이전과 복구 약품을 제공하고 온난 매트에 복구하는 허용됩니다.
4. 치료에 도전
- U87MG 세포 접종 후 4 일, 마우스는 무게와 무작위로 제어 및 치료 그룹으로 나누어집니다.
- 치료 그룹이 AMG102 (PBS 100 μl 100 μg)의 IP 주사를 부여하는 동안 컨트롤 그룹은, PBS (100 μl)의 내부 - 복막 (IP) 주사를 주어집니다.
- 주사는 14 일 동안 매초마다 6 일 주사 (그림 2)의 총 반복하고 있습니다.
- 마지막 주사 후, 생쥐는 매일 모니터링 모든 둘째날 무게입니다.
- 쥐가 중요한 신경 장애 (균형 장애, 마비), 탈수, 또는 이상이 10 % 체중 감소 또는 죽어가는을 표시하기 시작하면, 그들은 편안하게 euthanised되었습니다. 이러한 인도적인 엔드 포인트 일은 다음 카플란 - 마이어 생존 곡선에 기록되었다.
5. 치료 효율 평가
6. 대표 결과 :
제어 동물 세포의 초기 접종 후 신경학적인 장애와 체중 감소 23일의 흔적을 보여주하기 시작했다. 이것은 크게 35일에 AMG102 대우 그룹에서 지연되었습니다. 실제로 35 일, 77 %는 (N은 = 7 / 9) 제어 그룹의이 euthanized했다. 카플란 - 마이어 생존 곡선은 명확하게 AMG102 치료 (그림 3)에 대한 응답으로 생존에 상당한 증가를 보여줍니다. 일 70에 의해, 컨트롤 마우스의 88 % (N = 8 / 9) 37 %와 비교 euthanized했다 AMG102 취급 그룹 (N = 8분의 3). 두뇌의 Histological 분석 컨트롤 그룹에있는 모든 구 동물 개발 종양은 3 8 AMG102 취급 생쥐 (그림 4)에 비해 것으로 확인되었습니다.
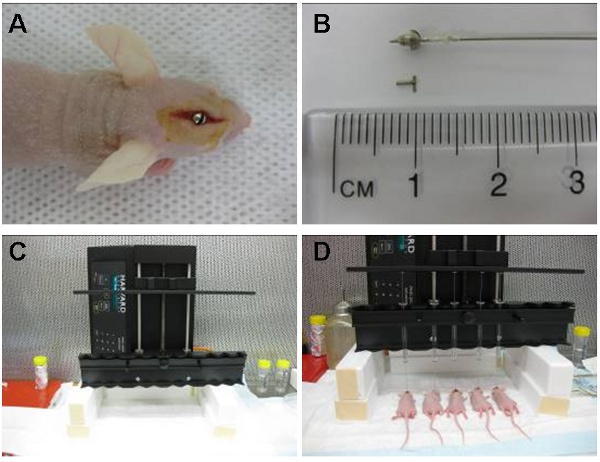
그림 1 : 이미지 (A)는 직접 꼬리가있는 핵 위에있는 지역에 위치 intracranial 가이드 나사를 보여줍니다. 바늘의 2mm는 가이드 초과하고 세포가 꼬리가있는 핵 내부에 3.5 mm를 주입되도록 수갑에 채워진 해밀턴 주사기 (세포와 함께 미리로드)은 다음 가이드 나사 내부에 배치됩니다. 주사기는 나중에 탐침 (B)에 의해 제거 및 교체됩니다. 자동 주입 장치 (C)는 한 번에 10 동물까지 주입 수 있습니다. 오 동시 주사 (D)는 아르 여기 표시됩니다.

그림 2 : 연구 프로토콜의 도식. 세포 치료 일 4 일 시작과 0에 주입했다. 치료 그룹 AMG102 (100 μg/100 μl) IP의 주사를받은 반면 제어 동물은 PBS (100 μl) IP의 주사를 받았습니다. 이 주사는 10 일 동안 매초마다 주어진 일되었습니다. 6 주사의 총 주어진되었습니다. 동물은 다음 신경 및 신체 장애의 흔적을 70 일 동안 감시했다.

그림 3 : 제어 및 AMG102 취급 생쥐를 비교 카플란 - 마이어 생존 곡선. 중요한 생존은 AMG102 (P = 0.005가)와 다음과 같은 치료를 얻은 것입니다.

그림 4 : 제어 동물에서 종양 개발 (A)와 AMG102 치료 동물 튼실한 종양 개발 (B)를 보여주는 코로나 뇌 섹션 Microphotographs. 스케일 바 1mm입니다.
Discussion
여기에 제시 intracranial 안내 나사 방법은 intracranial xenografts의 신속하고 재현성 확립을 가능하게하고 훈련 동물 기술자의 손에,이 절차는 매우 쉽게 stereotactic 장치의 필요없이 수행됩니다. 우리의 방법은 정확하게 생체내 종양 개발에 가장 적합한 두뇌의 지역, 그리고 한 번에 최대 10 동물의 동시 접종을 허용 자동 주입 펌프를 찾으려면 가이드 나사의 사용을 결합한 제품입니다. 안내 나사 확대 절차 수행하는 5 분 미만 소요됩니다. 30 μl / 시간에 세포의 자동 주입은 5 μl 볼륨에 단 10 분 정도 걸립니다. 이것은 일정한 속도로 정확하게 먹이지을 보장하고 증가 intracranial 압력으로 인한 엑스트라 두개골 영역에 셀 퇴학의 위험을 줄일 수 있습니다. 우리는 또한 10 μl 볼륨이 절차를 수행하고 셀룰러 환류으로 인한 엑스트라 두개골 종양의 성장을 관찰하지 않았습니다. 자동 주입 펌프는 여러 동물 우리는 시간당 약 15 동물로 제한됩니다 stereotactic 절차에 비해 시간 60 동물까지 주사할 수있는 동시에 주사 수 있습니다으로서.
위치는 종양이 대량의 최종 위치를 결정하는대로이 절차에서 가장 중요한 단계는 두개골의 가이드 나사의 위치입니다. 가이드 나사가 너무 중앙에있다면, 세포는 가이드가 멀리 전달 배치하는 경우 반면 두 개의 두뇌 반구 사이의 영역으로 주입되며, 세포는 전혀 두뇌에 주입되지 않습니다. 이것은 가이드 측면 2.5 mm와 bregma 1 앞쪽에 1mm를 찾는데 가능한 한 정확하게 그러므로 필수적이다. 플라스틱 가이드 나사는 또한 MRI 나 PET와 같은 뇌 6 이미징을 필요로 그 연구에 사용할 수 있지만 본 연구에서는 우리는 철강 가이드 나사를 사용합니다. 자동 주입 펌프는 일부 그룹에 대한 금지 비용입니다하더라도, 세포는 여전히 수동으로 더 빨리 stereotactic 접근보다 주입 수 있습니다. 전체적으로이 신속, 정확하고 재현성 방법 glioma, medulloblastoma 및 뇌간의 종양 7 공부하는 데 사용할 수 있습니다. 이 절차는 예상치 못한 마취 반응 (<1 %)로 인해 사망과 우리 두 실험실 사이에 500 생쥐 이상에서 수행되었습니다. 가이드 나사와 함께 뛰쳐과 세포가 프로 시저의 결과로 모든 신경 합병증을 죽게하거나 고통 않았와 이후에 주입했다 쥐. 동물은 어떤 합병증이없이 백일 지난 살아있다. 우리가 SCID 같은 머리 hairless 마우스, 단백질 손상된 마우스를 사용하여 원하는 있지만 적절한는 두개골 머리가 사이트를 지키기 위해 싸운다 및 가이드 스크류 간섭 머리카락을 방지하기 위해 수술을하기 전에 제거를 제공 그대로 것입니다.
현재 glioma 80-10의 치료를 위해 개발되고있는 몇 가지 소설 치료제가 있습니다. 최근 우리는 피하 U87MG glioma의 xenografts가 AMG102 3 처리에 의해 저해 수 보여준, 인간화 항체는 현재 glioma 5 임상 평가를 받고 HGF로 이동. 우리는 누드 생쥐의 두뇌에서 intracranial U87MG 종양을 설정하는 방법 여기서 설명하는 데 사용됩니다. 우리의 연구는 명확하게 방법의 유틸리티를 보여줍 AMG102 크게 orthotopic U87MG의 xenografts의 성장을 억제 것을 보여줍니다. 우리는 다른 치료제가 종양 성장의보다 효과적인 억제를 얻을 AMG102와 함께 사용할 수있는 어떤 결정하기 위해이 모델을 계속 사용할 것입니다.
Disclosures
이 작품은 Amgen 주식 회사에서 연구 그랜트에 의해 지원되었다
Acknowledgments
저자는이 모델을 개발 지원 Verlene 헨리와 린지 홈즈 감사하고 싶습니다. 이 작품은 부분적으로 제임스 S. 맥도넬 재단 (# 220,020,173)에 의해 재정 지원되었다.
Materials
| Name | Company | Catalog Number | Comments |
| DMEM/F12 | Invitrogen | 12634010 | |
| FCS | Bovogen | SFBS | |
| Trypsin | Invitrogen | 15050065 | |
| EDTA | Sigma-Aldrich | E6758 | |
| Balb/c nu/nu mice | ARC Perth | ||
| Screw Holder | Plastics One | SD-1 | |
| Drill Holder | Plastics One | DH-1 | |
| Drill Bit | Plastics One | D#60 | |
| Screw guide (metal) | Plastics One | C212SG | |
| Screw Dummy (stylus) | Plastics One | C212SD | |
| Hamilton Syringe (10 μl 26g cemented needle) | Grace Division Discovery Science | 80075 | |
| PHD 22/2000 infusion pump | Harvard Apparatus | 70-2003 | Optional |
| Vetbond | 3M | 1469SB | |
| Thermo pad | Harvard Apparatus | 340390 |
References
- Lal, S. An implantable guide-screw system for brain tumor studies in small animals. J Neurosurg. 92, 326-333 (2000).
- Jun, H. T. AMG 102, a fully human anti-hepatocyte growth factor/scatter factor neutralizing antibody, enhances the efficacy of temozolomide or docetaxel in U-87 MG cells and xenografts. Clin Cancer Res. 13, 6735-6742 (2007).
- Pillay, V. The plasticity of oncogene addiction: implications for targeted therapies directed to receptor tyrosine kinases. Neoplasia. 11, 448-458 (2009).
- Buchanan, I. M. Radiosensitization of glioma cells by modulation of Met signaling with the hepatocyte growth factor neutralizing antibody. AMG102. J Cell Mol Med. 15, 1999-2006 (2011).
- Wen, P. Y. A phase II study evaluating the efficacy and safety of AMG 102 (rilotumumab) in patients with recurrent glioblastoma. Neuro Oncol. 13, 437-446 (2011).
- Caretti, V. Monitoring of Tumor Growth and Post-Irradiation Recurrence in a Diffuse Intrinsic Pontine Glioma Mouse Model. Brain Pathol. 4, 441-451 (2011).
- Jallo, G. I., Volkov, A., Wong, C., Carson, B. S., Penno, M. B. A novel brainstem tumor model: functional and histopathological characterization. Childs Nerv. Syst. 22, 1519-1525 (2006).
- Johns, T. G. The efficacy of epidermal growth factor receptor-specific antibodies against gliomaxenografts is influenced by receptor levels, activation status, and heterodimerization. Clin Cancer Res. 13, 1911-1925 (2007).
- Scott, A. M. A phase I clinical trial with monoclonal antibody ch806 targeting transitional state and mutant epidermal growth factor receptors. Proc. Natl. Acad. Sci. U. S. A. 104, 4071-4076 (2007).
- Niyazi, M. Therapeutic options for recurrent malignant glioma. Radiother. Oncol. 98, 1-14 (2011).



