Summary
A fim de avaliar romance paradigmas terapêuticos para o tratamento de glioma, fisiológicos modelos relevantes são essenciais. Nós utilizamos um procedimento de parafuso implantáveis guia para criação de modelos de xenoenxerto intracraniana que é mais rápido e mais seguro do que as abordagens estereotáxica.
Abstract
A enxertia de células tumorais humanas no cérebro de camundongos imunossuprimidos é um método estabelecido para o estudo dos cânceres de cérebro, incluindo glioblastoma (glioma) e meduloblastoma. A abordagem estereotáxica amplamente utilizado só permite a injeção de um único animal de cada vez, é trabalhoso e requer equipamentos altamente especializados. O método parafuso guia, inicialmente desenvolvido por Lal et al., 1 foi desenvolvido para eliminar procedimentos estereotáxica pesado. Vamos agora descrever uma abordagem modificada parafuso guia que é rápida e excepcionalmente segura; sendo que ambos são críticos considerações éticas. Nomeadamente, o nosso procedimento agora incorpora uma bomba de infusão que permite que até 10 animais a ser simultaneamente injetados com células tumorais.
Para demonstrar a utilidade deste procedimento, nós estabelecemos células glioma U87MG como xenoenxertos intracraniana em camundongos, que foram então tratados com AMG102; um anticorpo totalmente humano direcionado para HGF / fator de dispersão actualmente em fase de avaliação clínica 2-5. Injeção sistêmica de AMG102 prolongou significativamente a sobrevivência de todos os camundongos com xenotransplantes U87MG intracraniana e resultou em uma série de curas completas.
Este estudo demonstra que o método parafuso guia é uma abordagem, de baixo custo altamente reprodutível para o estabelecimento de xenoenxertos intracraniana. Além disso, fornece um modelo fisiológico relevantes para a validação de novas estratégias terapêuticas para o tratamento de câncer no cérebro.
Protocol
1. Linhagens de células
- U87MG células glioma são cultivadas em frascos grandes de tecido cultura com DMEM-F12 suplementado com 5% de soro fetal bovino (FBS).
- As células são colhidas por lavagem frascos duas vezes com fosfato quente Buffered Saline (PBS) e incubando-os a 37 ° C por 5 minutos com 10 ml de PBS contendo 0,25% de tripsina e EDTA 0,05%. Uma vez que as células são levantadas, eles são colocados em um tubo de 50 ml contendo 10 ml de meios de cultura e centrifugadas (300 g X para 4 min).
- Após a lavagem, as células são ressuspendidas a uma concentração de 10 x 10 6 / ml em meios de cultura, o que permitiu uma inoculação de 50.000 células / 5 mL.
- As células são mantidas em gelo até injeção intracraniana.
2. Guia parafuso intracraniana bolting
Este procedimento pode ser realizado alguns dias antes da injeção das células. Todos os procedimentos aqui descritos foram realizados sob estritas condições estéreis.
- Camundongos (BALB / c nu / nu feminino; 5-6 semanas, aproximadamente 18g) são numerados para fins de identificação, pesados e anestesiados com uma injeção intraperitoneal (ip) de uma mistura de cetamina (100 mg / kg) e xilazina (5 mg / kg).
- A pele é varrida para baixo com uma solução de iodo e de uma pequena incisão (2-3 mm) é feita no lado direito da linha média e anterior à linha interaural. Isso expõe as suturas coronal e sagital do crânio. O bregma é posicionado na junção destas duas suturas.
- O guia de ponto de entrada do parafuso é então marcada a um ponto 2.5 mm lateral e 1 mm anterior ao bregma. Este ponto está localizado diretamente acima do núcleo caudado 1.
- A 1 x 1 mm de profundidade buraco é perfurado com uma mão estéril realizada broca através do crânio para a dura.
- Um parafuso guia esterilizado que se estenderá 1,6 milímetros abaixo da superfície crânios na dura é, então, fugiu para o buraco com uma chave de fenda até que esteja alinhado com o crânio (Figura 1A).
- Um estilete estéril ou dummy parafuso é então colocada no orifício central do parafuso guia para fechar a abertura (Figura 1B).
- A ferida é fechada com adesivo de tecido Vetbond (n-butil cianoacrilato) e os ratos recebem uma injeção intraperitoneal de reversine (pequenos animais) (0,1 ml / kg) e carprofeno (5 mg/kg/100 mL) para analgesia. Os ratos são, então, permitiu recuperar em uma esteira de aquecimento (36 ° C), que pode levar até 20 minutos. Ratos são freqüentemente monitoradas e observadas durante este tempo de recuperação até que sejam plenamente consciente.
3. Enxerto celular intracraniana
- A seringa estéril Hamilton algemado é preparado pela aplicação de um pequeno anel de plástico para a ponta da agulha permitindo apenas dois milímetros da agulha para estender abaixo da saída do parafuso guia (Figura 1B). Do ponto de inoculação final é, portanto, 3,5 milímetros abaixo da superfície do crânio.
- Quatro dias após a cirurgia parafuso guia, os ratos são novamente anestesiados como descrito acima (2.1) e uma pequena incisão é feita sobre o parafuso guia para retirar o estilete.
- A seringa Hamilton algemado é então preenchido com 5 mL de bem comum, tendo as células precaução para não criar ou elaborar as bolhas de ar.
- A seringa é fixada à bomba de perfusão ea agulha é inserida no parafuso guia (Figura 1C). As células são então infundido a uma taxa de 30 mL por hora.
- O aparelho automatizado (Figura 1D) permitiu-nos a injetar até 10 animais de cada vez, a um fluxo constante. As células também podem ser injetados manualmente usando a seringa hamilton algemado ou, alternativamente, a seringa pode ser algemado por uma ponteira 200 mL que foi cortado por 3 mm para permitir que a ponta da agulha se estender além do parafuso guia por 2 mm. A injeção deve ser realizada em um ritmo constante estacionário.
- Quando a infusão estiver concluída, a seringa é cuidadosamente removido eo estilete é substituído no parafuso guia. A ferida é fechada colada e os ratos são dadas medicamentos de recuperação como antes (2,7) e tempo para se recuperar em uma esteira de aquecimento.
4. Desafio terapêutico
- Quatro dias após a inoculação de células U87MG, os ratos são pesados e divididos aleatoriamente em grupos controle e tratamento.
- O grupo controle é dada uma injeção intra-peritoneal (IP) da PBS (100 l), enquanto o grupo de tratamento é dada uma injeção IP de AMG102 (100 mg em 100 ml de PBS).
- As injeções são repetidas a cada segundo dia por 14 dias, um total de 6 injeções (Figura 2).
- Após a última injeção, os ratos são monitoradas diariamente e pesados a cada segundo dia.
- Quando os ratos começaram a mostrar significativas disfunções neurológicas (saldo perturbação, paralisia), desidratação, ou perda de peso mais de 10% ou moribundo, eles foram abatidos de forma humana. Estes humano ponto final dia foram, então, registada na curva de sobrevida de Kaplan-Meier.
5. Avaliação de eficácia terapêutica
6. Resultados representativos:
Animais de controle começou a mostrar sinais de perturbação neurológica e perda de peso 23 dias após a inoculação inicial de células. Este foi um atraso significativo no grupo tratado AMG102 a 35 dias. Na verdade o dia 35, 77% (n = 09/07) do grupo controle foram sacrificados. A curva de sobrevida de Kaplan-Meier demonstra claramente o aumento significativo da sobrevida em resposta a AMG102 tratamento (Figura 3). Por 70 dias, 88% dos ratos controle foram sacrificados (n = 09/08) em comparação com 37% (n = 08/03) de AMG102 grupo tratado. A análise histológica do cérebro confirmou que todos os nove animais do grupo controle desenvolveram tumores em comparação com apenas 3 dos 8 AMG102 ratos tratados (Figura 4).
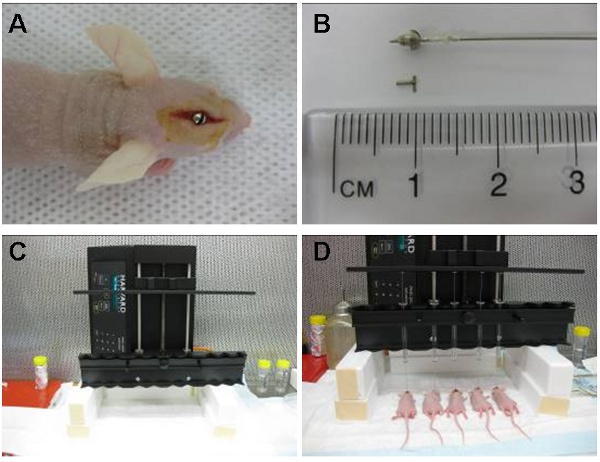
Figura 1: Imagem (A) mostra parafuso guia intracraniana posicionados em uma área localizada diretamente acima do núcleo caudado. O algemado hamilton seringa (pré-carregado com células) é então colocado dentro do parafuso guia de forma que 2 mm de agulha se estende além do guia e as células são injetadas 3,5 milímetros no interior do núcleo caudado. A seringa é posteriormente removido e substituído por um estilete (B). O dispositivo automático de infusão (C) pode injetar até 10 animais de cada vez. Aqui mostrados são cinco injeções simultâneas (D).

Figura 2: Esquema de protocolo do estudo. Células foram injetadas no dia 0 com o tratamento começa no dia 4. Animais controle receberam uma injeção de PBS (100 l) IP enquanto o grupo de tratamento recebeu uma injeção de AMG102 (100 μg/100 mL) IP. Estas injecções foram dadas a cada segundo dia por 10 dias. Um total de 6 injeções foram dadas. Animais foram monitorados por 70 dias para sinais de distúrbios neurológicos e físicos.

Figura 3: Kaplan-Meier comparando a sobrevivência e controle de AMG102 camundongos tratados. Significante de sobrevivência foi obtida após o tratamento com AMG102 (p = 0,005).

Figura 4: Microfotografias de seções cérebro coronal demonstrando o desenvolvimento de tumores nos animais controle (A) e não o desenvolvimento do cérebro tumor no AMG102 animais tratados (B). Barra de escala é de 1 mm.
Discussion
O método parafuso intracraniana guia aqui apresentado permite a criação rápida e reprodutível de xenoenxertos intracraniana e nas mãos de um técnico de animais treinados, este procedimento é muito facilmente realizada sem a necessidade de um dispositivo estereotáxico. Nosso método combina o uso de um parafuso guia, para localizar com precisão a região do cérebro mais adequado para o desenvolvimento do tumor in vivo, e uma bomba de infusão automatizado que permite a inoculação simultânea de até 10 animais de cada vez. O guia procedimento de aumento do parafuso leva menos de 5 minutos para ser realizado. A infusão de células automatizadas de 30 mL / hora leva apenas 10 minutos para um volume de 5 mL. Isso garante uma dosagem exacta a uma taxa constante e reduz o risco de expulsão de células para a área extra-craniana devido ao aumento da pressão intracraniana. Temos também realizado este procedimento com 10 volumes mL e não observou qualquer crescimento tumoral extra-craniano, devido ao refluxo celular. Como a bomba de infusão automática também permite que vários animais a ser inoculado simultaneamente que pode injetar até 60 animais por hora, em comparação a um procedimento de estereotaxia, que é limitada a aproximadamente 15 animais por hora.
O passo mais crítico neste procedimento é a localização do parafuso guia no crânio como sua posição determina a localização final da maior parte do tumor. Se o parafuso guia é muito central, as células serão injetadas em uma região entre os dois hemisférios do cérebro enquanto que se a guia é posicionada para a frente, as células não vai ser injetado no cérebro. Portanto, é essencial para ser o mais preciso possível para localizar o guia 2,5 milímetros laterais e 1 mm anterior ao bregma 1. Neste estudo foi utilizado um parafuso guia de aço, embora parafusos-guia de plástico também estão disponíveis para aqueles que necessitam de estudos de imagens cerebrais, tais como ressonância magnética ou PET 6. Mesmo se a bomba de infusão automatizado é o custo proibitivo para alguns grupos, as células ainda podem ser injetadas manualmente mais rapidamente do que as abordagens estereotáxica. No geral, este método rápido, preciso e reprodutível pode ser usado para estudar meduloblastoma glioma e os tumores do tronco cerebral 7. Este procedimento tem sido realizado em mais de 500 ratos entre os nossos dois laboratórios com mortes devido a reações inesperadas anestésico (<1%). Ratos que foram aparafusadas com o parafuso guia e, posteriormente, infundido com células não morrem ou sofrem qualquer complicações neurológicas, como resultado do procedimento. Animais tenham sobrevivido nos últimos 100 dias, sem quaisquer complicações. Embora nós preferimos usar um mouse sem pêlos, um mouse imuno-comprometidos com o cabelo como o SCID seria tão apropriado, desde que o cabelo crânio foi removido antes da cirurgia para manter o local limpo e para evitar que o cabelo interferir com parafuso guia.
Existem diversas novas terapêuticas actualmente a ser desenvolvido para o tratamento de glioma 8-10. Recentemente, nós mostramos que xenoenxertos subcutânea U87MG glioma pode ser inibida pelo tratamento com AMG102 3; um anticorpo humanizado direcionado para HGF actualmente em fase de avaliação clínica em glioma 5. Foi utilizado o método descrito aqui para estabelecer tumores intracranianos U87MG no cérebro de ratos nude. Nosso estudo mostra claramente a utilidade do método e demonstra que AMG102 significativamente inibe o crescimento de xenoenxertos U87MG ortotópico. Vamos continuar a usar este modelo para determinar o que outras terapêuticas podem ser usadas em combinação com AMG102 para obter a inibição mais eficaz de crescimento do tumor.
Disclosures
Este trabalho foi financiado por uma bolsa de pesquisa da Amgen Inc.
Acknowledgments
Os autores gostariam de agradecer Verlene Henry e Lindsay Holmes para a assistência no desenvolvimento deste modelo. Este trabalho foi parcialmente financiado pela Fundação S. James McDonnell (# 220020173).
Materials
| Name | Company | Catalog Number | Comments |
| DMEM/F12 | Invitrogen | 12634010 | |
| FCS | Bovogen | SFBS | |
| Trypsin | Invitrogen | 15050065 | |
| EDTA | Sigma-Aldrich | E6758 | |
| Balb/c nu/nu mice | ARC Perth | ||
| Screw Holder | Plastics One | SD-1 | |
| Drill Holder | Plastics One | DH-1 | |
| Drill Bit | Plastics One | D#60 | |
| Screw guide (metal) | Plastics One | C212SG | |
| Screw Dummy (stylus) | Plastics One | C212SD | |
| Hamilton Syringe (10 μl 26g cemented needle) | Grace Division Discovery Science | 80075 | |
| PHD 22/2000 infusion pump | Harvard Apparatus | 70-2003 | Optional |
| Vetbond | 3M | 1469SB | |
| Thermo pad | Harvard Apparatus | 340390 |
References
- Lal, S. An implantable guide-screw system for brain tumor studies in small animals. J Neurosurg. 92, 326-333 (2000).
- Jun, H. T. AMG 102, a fully human anti-hepatocyte growth factor/scatter factor neutralizing antibody, enhances the efficacy of temozolomide or docetaxel in U-87 MG cells and xenografts. Clin Cancer Res. 13, 6735-6742 (2007).
- Pillay, V. The plasticity of oncogene addiction: implications for targeted therapies directed to receptor tyrosine kinases. Neoplasia. 11, 448-458 (2009).
- Buchanan, I. M. Radiosensitization of glioma cells by modulation of Met signaling with the hepatocyte growth factor neutralizing antibody. AMG102. J Cell Mol Med. 15, 1999-2006 (2011).
- Wen, P. Y. A phase II study evaluating the efficacy and safety of AMG 102 (rilotumumab) in patients with recurrent glioblastoma. Neuro Oncol. 13, 437-446 (2011).
- Caretti, V. Monitoring of Tumor Growth and Post-Irradiation Recurrence in a Diffuse Intrinsic Pontine Glioma Mouse Model. Brain Pathol. 4, 441-451 (2011).
- Jallo, G. I., Volkov, A., Wong, C., Carson, B. S., Penno, M. B. A novel brainstem tumor model: functional and histopathological characterization. Childs Nerv. Syst. 22, 1519-1525 (2006).
- Johns, T. G. The efficacy of epidermal growth factor receptor-specific antibodies against gliomaxenografts is influenced by receptor levels, activation status, and heterodimerization. Clin Cancer Res. 13, 1911-1925 (2007).
- Scott, A. M. A phase I clinical trial with monoclonal antibody ch806 targeting transitional state and mutant epidermal growth factor receptors. Proc. Natl. Acad. Sci. U. S. A. 104, 4071-4076 (2007).
- Niyazi, M. Therapeutic options for recurrent malignant glioma. Radiother. Oncol. 98, 1-14 (2011).



