Summary
Con el fin de evaluar nuevos paradigmas terapéuticos para el tratamiento del glioma, fisiológicos modelos pertinentes son esenciales. Utilizamos un procedimiento de guía de tornillo implantable para el establecimiento de modelos de xenoinjerto intracraneal que es más rápido y más seguro que los enfoques estereotáctica.
Abstract
El injerto de células tumorales humanas en el cerebro de ratones inmunodeprimidos es un método establecido para el estudio de los cánceres de cerebro, incluyendo glioblastoma (glioma) y el meduloblastoma. El abordaje estereotáctico utilizado sólo permite la inyección de un solo animal a la vez, es un trabajo intensivo y requiere de un equipo altamente especializado. El método de tornillo guía, inicialmente desarrollado por Lal et al., 1 fue desarrollado para eliminar los engorrosos procedimientos estereotáctica. Ahora describir un enfoque guía de tornillo modificado que es excepcionalmente rápida y segura, los cuales son fundamentales las consideraciones éticas. Cabe destacar que nuestro procedimiento ahora incorpora una bomba de infusión que permite hasta 10 animales a ser a la vez inyectados con células tumorales.
Para demostrar la utilidad de este procedimiento, se estableció humanos U87MG células de glioma intracraneal como xenoinjertos en ratones, que fueron tratados con AMG102, un anticuerpo totalmente humano dirigido a HGF / factor de dispersión actualmente en fase de evaluación clínica 2-5. Inyección sistémica de AMG102 prolongó significativamente la supervivencia de todos los ratones con xenoinjertos U87MG intracraneal y dio lugar a una serie de curaciones completas.
Este estudio demuestra que el método de tornillo guía es un enfoque de bajo costo, altamente reproducible para el establecimiento de xenoinjertos intracraneal. Además, proporciona un modelo relevante fisiológicos para la validación de nuevas estrategias terapéuticas para el tratamiento de los cánceres de cerebro.
Protocol
1. Las líneas celulares
- U87MG células de glioma se cultivan en grandes frascos de cultivo de tejidos con DMEM-F12 suplementado con suero fetal bovino al 5% (FBS).
- Las células se recogen por lavado de botellas en dos ocasiones con fosfato caliente (PBS) y la incubación a 37 ° C durante 5 minutos con 10 ml de PBS que contiene 0,25% de tripsina y EDTA al 0,05%. Una vez que las células se levantan, se colocan en un tubo de 50 ml que contiene 10 ml de medios de cultivo y se centrifuga (300 X g durante 4 minutos).
- Tras el lavado, las células se resuspenden a una concentración de 10 x 10 6 / ml en medios de cultivo, lo que permitió la inoculación de 50.000 células / l 5.
- Las células se mantienen en hielo hasta que la inyección intracraneal.
2. Guía intracraneal tornillo atornillado
Este procedimiento puede ser llevado a cabo varios días antes de la inyección de las células. Todos los procedimientos descritos aquí se han llevado a cabo bajo estrictas condiciones de esterilidad.
- Ratones (BALB / c nu / nu hembra; 5-6 semanas, aproximadamente 18 g) se numeran para su identificación, peso y anestesiados con una intraperitoneal (IP) la inyección de una mezcla de ketamina (100 mg / kg) y xilazina (5 mg / kg).
- La piel es limpiar con una solución de yodo y de una pequeña incisión (2-3 mm) se realiza a lo largo de la parte derecha de la línea media y anterior a la línea interaural. Esto expone a las suturas coronal y sagital del cráneo. El bregma se coloca en la unión de estos dos puntos de sutura.
- El tornillo de guía de punto de entrada se marca en un punto de 2,5 mm lateral y 1 mm anterior al bregma. Este punto está situado directamente sobre el núcleo caudado 1.
- Un agujero de 1 x 1 mm de profundidad se perfora con una mano estéril cabo fresa espiral a través del cráneo a la duramadre.
- Un tornillo de guía esterilizada que se extiende 1,6 mm por debajo de la superficie del cráneo en la duramadre se atornilla en el agujero con un destornillador hasta que quede nivelado con el cráneo (Figura 1).
- Un estilete estéril o ficticia tornillo se coloca en el orificio central de la guía de tornillo para cerrar la abertura (fig. 1B).
- La herida se cierra con adhesivo tisular Vetbond (cianoacrilato de n-butilo) y los ratones se les da una inyección intraperitoneal de reversine (animales pequeños) (0,1 ml / kg) y carprofeno (5 mg/kg/100 l) para la analgesia. Los ratones se dejan de recuperar en una estera de calentamiento (36 ° C), que puede tardar hasta 20 minutos. Los ratones son frecuentemente monitoreados y observados durante este tiempo de recuperación hasta que estén plenamente conscientes.
3. El injerto celular intracraneal
- Una jeringa con manguito Hamilton se prepara mediante la aplicación de un anillo de plástico a la punta de la aguja que permite sólo 2 mm de la aguja para extenderse por debajo de la salida del tornillo de guía (fig. 1B). El punto final es por lo tanto, la inoculación de 3,5 mm por debajo de la superficie del cráneo.
- Cuatro días después de la cirugía tornillo guía, los ratones son anestesiados de nuevo que el anterior (2,1) y una pequeña incisión sobre el tornillo de trabajo para retirar el estilete.
- El manguito jeringa Hamilton se llena con 5 l de las células y en común, teniendo precaución de no crear o elaborar cualquier burbuja de aire.
- La jeringa se sujeta a la bomba de perfusión y la aguja se inserta en el tornillo de guía (fig. 1C). Las células se infunden a una velocidad de 30 l por hora.
- El aparato automatizado (Figura 1 D) nos ha permitido inyectar un máximo de 10 animales a la vez, con un caudal constante. Las células también se puede inyectar de forma manual mediante el uso de la jeringa Hamilton esposadas o, alternativamente, la jeringa puede ser esposado por una punta de la pipeta 200 l que se ha reducido en 3 mm para permitir que la punta de la aguja para extender más allá de la guía de tornillo de 2 mm. La inyección se debe realizar a un ritmo constante constante.
- Cuando se haya completado la infusión, la jeringa se retira cuidadosamente el estilete y se sustituye en el tornillo de guía. La herida está cerrada y pegada a los ratones se les da medicamentos recuperación como antes (2,7) y les permite recuperar en una estera de calentamiento.
4. Desafío terapéutico
- Cuatro días después de la inoculación de células U87MG, los ratones se pesan y se dividieron aleatoriamente en los grupos control y tratamiento.
- El grupo control se le da una intraperitoneal (IP) de inyección de PBS (100 l), mientras que el grupo de tratamiento es una inyección IP de AMG102 (100 mg en 100 l de PBS).
- Las inyecciones se repiten cada dos días durante 14 días, un total de 6 inyecciones (Figura 2).
- Después de la última inyección, los ratones son monitoreados diariamente y se pesaron cada dos días.
- Cuando los ratones comenzaron a mostrar importantes disfunciones neurológicas (balance de perturbación, parálisis), deshidratación, o más del 10% de pérdida de peso o moribundos, que fueron sacrificados humanitariamente. Estos humano de punto final de día se registraron luego de la curva de supervivencia de Kaplan-Meier.
5. Evaluación de la eficacia terapéutica
6. Los resultados representativos:
Control de los animales comenzaron a mostrar signos de trastornos neurológicos y pérdida de peso 23 días después de la inoculación inicial de las células. Esta se retrasó significativamente en el grupo tratado AMG102 a 35 días. De hecho el día 35, el 77% (n = 7 / 9) del grupo de control habían sido sacrificados. La curva de supervivencia Kaplan-Meier muestra claramente el aumento significativo de la supervivencia en respuesta a AMG102 tratamiento (Figura 3). Al día 70, el 88% de los ratones de control había sido sacrificado (n = 8 / 9) en comparación con el 37% (n = 3 / 8) de AMG102 grupo tratado. El análisis histológico de los cerebros confirmó que todos los 9 animales del grupo control desarrollaron tumores en comparación con sólo 3 de los 8 AMG102 ratones tratados (Figura 4).
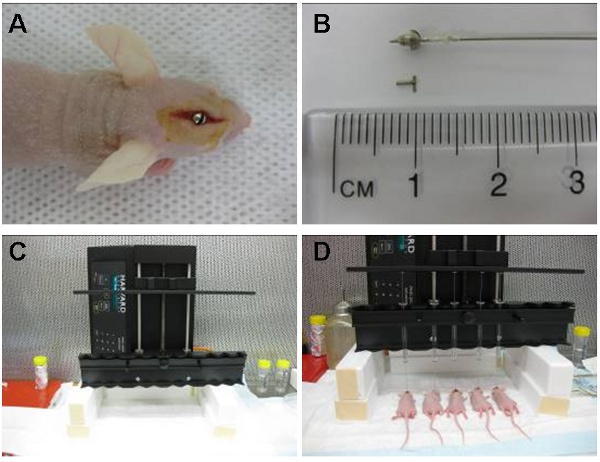
Figura 1: Imagen (A) muestra el tornillo guía intracraneal colocado en un área situada directamente sobre el núcleo caudado. El manguito jeringa Hamilton (pre-cargado con células) se coloca en el interior del tornillo de guía para que 2 mm de la aguja se extiende más allá de la guía y las células se inyectan 3,5 mm en el interior del núcleo caudado. La jeringa más tarde se extrae y se reemplaza por un mandril (B). El dispositivo de infusión automática (C) puede inyectar hasta 10 animales a la vez. Aquí se muestran cinco inyecciones simultáneas (D).

Figura 2: Esquema del protocolo del estudio. Las células fueron inyectadas en el día 0 con el tratamiento a partir del día 4. Los animales control recibieron una inyección de PBS (100 l) IP, mientras que el grupo de tratamiento recibió una inyección de AMG102 (100 mg/100 l) IP. Estas inyecciones se administraron en días alternos durante 10 días. Un total de 6 inyecciones se administraron. Los animales fueron controlados después de 70 días para detectar signos de trastornos neurológicos y físicos.

Figura 3: curvas de Kaplan-Meier comparando el control y AMG102 los ratones tratados. Significativa en la supervivencia se obtuvo tras el tratamiento con AMG102 (p = 0,005).

Figura 4: Microfotografías de las secciones del cerebro coronal que demuestra el desarrollo de tumores en los animales control (A) y no el desarrollo de tumores cerebrales en los animales tratados AMG102 (B). Barra de escala es de 1 mm.
Discussion
El método de guía de tornillo intracraneal que aquí se presenta permite la creación rápida y reproducible de xenoinjertos intracraneal y en las manos de un técnico en animales entrenados, este procedimiento es muy fácil de realizar sin la necesidad de un dispositivo de estereotaxia. Nuestro método combina el uso de un tornillo de guía, para localizar con precisión la región del cerebro más adecuado para el desarrollo de tumores in vivo, y una bomba de infusión automatizado que permite la inoculación simultánea de hasta 10 animales a la vez. El tornillo de guía de procedimiento de aumento en menos de 5 minutos para llevar a cabo. La infusión de células automatizado a los 30 l / hora tiene 10 minutos para un volumen de 5 microlitros. Esto asegura una dosificación precisa a una velocidad constante y reduce el riesgo de expulsión de células en el área extra-craneal debido a un aumento de la presión intracraneal. También hemos realizado este procedimiento con 10 volúmenes de l y no han observado ningún crecimiento del tumor extra-craneal debido a un reflujo celular. A medida que la bomba de infusión automatizado permite a varios animales a inocular al mismo tiempo que podemos inyectar hasta 60 animales por hora en comparación con un procedimiento estereotáxico que se limita a unos 15 animales por hora.
El paso más crítico en este procedimiento es la ubicación del tornillo de guía en el cráneo, ya que su posición determina la ubicación definitiva de la masa tumoral. Si el tornillo de guía es muy central, las células se inyectan en una región entre los dos hemisferios cerebrales, mientras que si la guía se coloca demasiado lejos hacia adelante, las células no se inyecta en el cerebro a todos. Por tanto, es esencial para ser lo más preciso posible en la localización de la guía de 2,5 mm lateral y 1 mm anterior al bregma 1. En este estudio se utilizó un tornillo de guía de acero, a pesar de tornillos de plástico guía también están disponibles para los estudios que requieren imágenes cerebrales, tales como resonancia magnética o PET 6. Incluso si la bomba de infusión automatizado es un costo prohibitivo para algunos grupos, las células todavía se puede inyectar de forma manual con más rapidez que los enfoques estereotáctica. En general, este método rápido, exacto y reproducible puede ser utilizado para estudiar el glioma, el meduloblastoma y los tumores del tronco cerebral 7. Este procedimiento se ha realizado en más de 500 ratones entre los dos laboratorios con las muertes debidas a reacciones inesperadas anestesia (<1%). Los ratones que fueron atornilladas con el tornillo de guía y, posteriormente, infundidos con las células no mueren o sufren complicaciones neurológicas, como resultado del procedimiento. Los animales han sobrevivido más allá de 100 días sin ninguna complicación. A pesar de que prefiere usar un ratón sin pelo, un ratón inmuno-comprometidos con el pelo como el SCID sería tan apropiado siempre y cuando el pelo del cráneo se retiró antes de la cirugía para mantener el sitio limpio y evitar que el pelo interferir con el tornillo guía.
Existen varias terapias nuevas están desarrollando actualmente para el tratamiento del glioma 10.08. Recientemente hemos demostrado que por vía subcutánea U87MG xenoinjertos glioma puede ser inhibida por el tratamiento con AMG102 3, un anticuerpo humanizado dirigido a HGF actualmente en fase de evaluación clínica en el glioma 5. Se utilizó el método descrito aquí para establecer los tumores intracraneales U87MG en los cerebros de ratones desnudos. Nuestro estudio demuestra claramente la utilidad del método y demuestra que AMG102 inhibe significativamente el crecimiento de xenoinjertos U87MG ortotópico. Vamos a seguir utilizando este modelo para determinar qué otros productos terapéuticos se pueden utilizar en combinación con AMG102 para obtener una inhibición más eficaz del crecimiento del tumor.
Disclosures
Este trabajo fue apoyado por una beca de investigación de Amgen Inc.
Acknowledgments
Los autores desean agradecer a Verlene Henry Holmes y Lindsay para la asistencia en el desarrollo de este modelo. Este trabajo fue financiado parcialmente por la Fundación James S. McDonnell (# 220020173).
Materials
| Name | Company | Catalog Number | Comments |
| DMEM/F12 | Invitrogen | 12634010 | |
| FCS | Bovogen | SFBS | |
| Trypsin | Invitrogen | 15050065 | |
| EDTA | Sigma-Aldrich | E6758 | |
| Balb/c nu/nu mice | ARC Perth | ||
| Screw Holder | Plastics One | SD-1 | |
| Drill Holder | Plastics One | DH-1 | |
| Drill Bit | Plastics One | D#60 | |
| Screw guide (metal) | Plastics One | C212SG | |
| Screw Dummy (stylus) | Plastics One | C212SD | |
| Hamilton Syringe (10 μl 26g cemented needle) | Grace Division Discovery Science | 80075 | |
| PHD 22/2000 infusion pump | Harvard Apparatus | 70-2003 | Optional |
| Vetbond | 3M | 1469SB | |
| Thermo pad | Harvard Apparatus | 340390 |
References
- Lal, S. An implantable guide-screw system for brain tumor studies in small animals. J Neurosurg. 92, 326-333 (2000).
- Jun, H. T. AMG 102, a fully human anti-hepatocyte growth factor/scatter factor neutralizing antibody, enhances the efficacy of temozolomide or docetaxel in U-87 MG cells and xenografts. Clin Cancer Res. 13, 6735-6742 (2007).
- Pillay, V. The plasticity of oncogene addiction: implications for targeted therapies directed to receptor tyrosine kinases. Neoplasia. 11, 448-458 (2009).
- Buchanan, I. M. Radiosensitization of glioma cells by modulation of Met signaling with the hepatocyte growth factor neutralizing antibody. AMG102. J Cell Mol Med. 15, 1999-2006 (2011).
- Wen, P. Y. A phase II study evaluating the efficacy and safety of AMG 102 (rilotumumab) in patients with recurrent glioblastoma. Neuro Oncol. 13, 437-446 (2011).
- Caretti, V. Monitoring of Tumor Growth and Post-Irradiation Recurrence in a Diffuse Intrinsic Pontine Glioma Mouse Model. Brain Pathol. 4, 441-451 (2011).
- Jallo, G. I., Volkov, A., Wong, C., Carson, B. S., Penno, M. B. A novel brainstem tumor model: functional and histopathological characterization. Childs Nerv. Syst. 22, 1519-1525 (2006).
- Johns, T. G. The efficacy of epidermal growth factor receptor-specific antibodies against gliomaxenografts is influenced by receptor levels, activation status, and heterodimerization. Clin Cancer Res. 13, 1911-1925 (2007).
- Scott, A. M. A phase I clinical trial with monoclonal antibody ch806 targeting transitional state and mutant epidermal growth factor receptors. Proc. Natl. Acad. Sci. U. S. A. 104, 4071-4076 (2007).
- Niyazi, M. Therapeutic options for recurrent malignant glioma. Radiother. Oncol. 98, 1-14 (2011).



