Summary
För att utvärdera nya behandlingsmetoder paradigm för behandling av gliom, fysiologiska relevanta modeller är väsentliga. Vi använder en implanterbar förfarande styrskruven för etablering av intrakraniell xenograft modeller som är snabbare och säkrare än stereotaktisk strategier.
Abstract
Ympning av humana tumörceller i hjärnan av immunsupprimerade möss är en etablerad metod för att studera hjärnan cancerformer, inklusive glioblastom (gliom) och medulloblastom. Den utbredda stereotaktisk metod tillåter endast för injektion av ett enda djur i taget, är arbetskraftsintensiv och kräver högt specialiserad utrustning. Styrskruven Metoden, som ursprungligen utvecklats av Lal et al. 1 utvecklades för att eliminera besvärliga stereotaktisk förfaranden. Vi beskriver nu en uppdaterad strategi guide skruv som är snabb och extremt säker, som båda är viktiga etiska överväganden. Framför allt innehåller vårt förfarande nu en infusionspump som gör att upp till 10 djur som ska samtidigt injiceras med tumörceller.
För att visa nyttan av detta förfarande har vi etablerat mänskliga U87MG gliom celler intrakraniella implanterad hos möss, som sedan behandlades med AMG102, en human antikropp riktad mot HGF / skingra faktor genomgår för närvarande klinisk utvärdering 2-5. Systemisk injektion av AMG102 förlängde signifikant överlevnad av alla möss med intrakraniell U87MG implanterad och resulterat i ett antal komplett botemedel.
Denna studie visar att styrskruven metoden är ett billigt, mycket reproducerbar metod för att fastställa intrakraniella implanterad. Dessutom ger det en relevant fysiologisk modell för validering av nya behandlingsstrategier för behandling av hjärnan cancer.
Protocol
1. Cellinjer
- U87MG gliom celler odlas i stora flaskor vävnadsodling med DMEM-F12 kompletterad med 5% fetalt bovint serum (FBS).
- Celler skördas genom att tvätta flaskor två gånger med varmt Fosfatbuffrad saltlösning (PBS) och ruva dem vid 37 ° C i 5 minuter med 10 ml PBS innehållande 0,25% trypsin och 0,05% EDTA. När cellerna lyfts, de placeras i ett 50 ml rör som innehåller 10 ml odlingsmedia och centrifugeras (300 x g 4 min).
- Efter tvätt, celler resuspenderas vid en koncentration på 10 x 10 6 / ml i kultur media, vilket möjliggjorde en ympning av 50.000 celler / 5 l.
- Celler hålls på is tills intrakraniella injektion.
2. Guide skruv intrakraniell bultning
Denna procedur kan göras flera dagar före injektionen av celler. Alla förfaranden som beskrivs här har utförts under strikt sterila förhållanden.
- Möss (BALB / c nu / nu hona, 5-6 veckor, ca 18g) är numrerade för identifiering, vägs och sövda med en intraperitoneal (IP) injektion av en blandning av ketamin (100 mg / kg) och xylazin (5 mg / kg).
- Huden torkas av med en jodlösning och ett litet snitt (2-3 mm) görs längs den högra sidan av mittlinjen och främre till interaural linjen. Detta exponerar koronalt och sagittal suturer av skallen. Den bregma är placerad vid korsningen av dessa två suturer.
- Guiden skruv startpunkt är då markerad i en punkt 2,5 mm i sidled och 1 mm främre till bregma. Denna punkt ligger direkt ovanför den caudatus nucleus 1.
- En 1 x 1 mm djupt hål borras med en steril handhållen spiralborr genom skallen till dura.
- En steriliserad guide skruven som kommer att förlänga 1,6 mm under skallar ytan i duran är sedan skruvas in i hålet med en skruvmejsel tills jäms med skallen (Figur 1A).
- En steril stylet eller skruv dockan placeras sedan in i det centrala hålet styrskruven att sluta öppningen (Figur 1B).
- Såret avslutas med Vetbond Tissue Adhesive (n-butyl cyanoakrylat) och möss får en intraperitoneal injektion av reversine (små djur) (0,1 ml / kg) och karprofen (5 mg/kg/100 l) för smärtlindring. Möss är då tillåtet att återhämta sig på en värmande matta (36 ° C) som kan ta upp till 20 minuter. Möss är ofta övervakas och observeras under denna återhämtning tid tills de är vid fullt medvetande.
3. Intrakraniell cellulära engraftment
- En steril cuffed Hamilton sprutan är framställas genom en liten plastring till nålspetsen att endast 2 mm av nålen för att sträcka sig under styrskruven utlopp (Figur 1B). Den sista inokuleringspunkten är alltså 3,5 mm under skallen ytan.
- Fyra dagar efter styrskruven kirurgi, möss igen bedövas enligt ovan (2,1) och ett litet snitt görs över styrskruven att ta bort stylet.
- Den cuffed Hamilton sprutan fylls med 5 ìl av väl blandad celler tar försiktighetsåtgärd inte skapa eller upprätta några luftbubblor.
- Sprutan är fastsatt i perfusion pumpen och nålen sätts in i handboken skruven (Figur 1C). Därefter är cellerna infunderas med en hastighet av 30 l per timme.
- Den automatiserade utrustningen (figur 1D) tillät oss att injicera upp till 10 djur i en tid med konstant flöde. Celler kan också injiceras manuellt med hjälp av handbojor Hamilton spruta eller alternativt sprutan kan handbojor med en 200 l pipettspets som har trimmat med 3 mm så att nålspetsen sträcka sig längre än styrskruven med 2 mm. Injektionen måste då ske vid en konstant stadig takt.
- När infusionen är klar sprutan försiktigt bort och stylet ersätts i guiden skruven. Såret limmas stängd och mössen ges återhämtning läkemedel som tidigare (2,7) och får återhämta sig på en värmande matta.
4. Terapeutisk utmaning
- Fyra dagar efter U87MG cellen inokulationen möss vägas och slumpmässigt delas in i kontroll-och behandlingsgrupperna.
- Kontrollgruppen ges ett intraperitonealt (IP) injektion av PBS (100 l), medan den behandlade gruppen ges en IP-injektion av AMG102 (100 mikrogram i 100 l PBS).
- Injektionerna upprepas varannan dag i 14 dagar, totalt 6 injektioner (figur 2).
- Efter den sista injektionen, är möss övervakas dagligen och vägde varannan dag.
- När möss började visa betydande neurologiska dysfunktioner (balans störning, förlamning), uttorkning, eller mer än 10% viktminskning eller döende, de var ett humant avlivas. Dessa humana slutpunkt dagar därefter spelas in på Kaplan-Meier överlevnad kurva.
5. Utvärdering av terapeutiska effektivitet
6. Representativa resultat:
Kontroll djuren började visa tecken på neurologiska störningar och viktminskning 23 dagar efter den första inympning av celler. Detta var betydligt försenat i den behandlade AMG102 gruppen till 35 dagar. Faktiskt på dagen 35, 77% (n = 7 / 9) i kontrollgruppen hade avlivas. Kaplan-Meier överlevnad kurvan visar tydligt den stora ökningen i överlevnad som svar på AMG102 behandling (Figur 3). På dagen 70 hade 88% av kontroll möss har avlivats (n = 8 / 9) jämfört med 37% (n = 3 / 8) av AMG102 behandlade gruppen. Histologiska analysen av hjärnan bekräftat att alla nio djur i kontrollgruppen utvecklade tumörer jämfört med endast 3 av de behandlade 8 AMG102 möss (Figur 4).
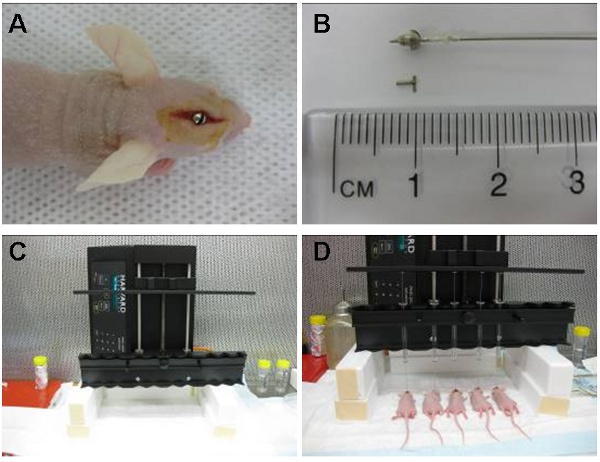
Figur 1: Bild (A) visar intrakraniell styrskruven placeras i ett område som ligger direkt ovanför caudatus nucleus. Den cuffed Hamilton spruta (förinstallerad med celler) är sedan placeras i guiden skruven så att 2 mm av nål sträcker sig utanför den guiden och cellerna injiceras 3,5 mm innanför caudatus nucleus. Sprutan är senare bort och ersättas med en stylet (B). Den automatiska infusionen enhet (C) kan injicera upp till 10 djur i taget. Som visas här är fem samtidiga injektioner (D).

Figur 2: Schematisk av studie protokollet. Celler injiceras dag 0 med behandling påbörjas på dag 4. Kontroll djuren fick en injektion av PBS (100 l) IP medan den behandlade gruppen fick en injektion av AMG102 (100 μg/100 l) IP. Dessa injektioner gavs varannan dag i 10 dagar. Totalt 6 injektioner fick. Djuren var då upp i 70 dagar efter tecken på neurologiska och fysiska störningar.

Figur 3: Kaplan-Meier överlevnad kurva jämföra kontroll och AMG102 behandlade möss. Signifikant överlevnadsfördel erhölls efter behandling med AMG102 (p = 0,005).

Figur 4: mikrofotografier av koronalt hjärnan sektioner visar tumörutveckling i kontrollgruppen djur (A) och ingen hjärntumör utveckling i de behandlade AMG102 djur (B). Skala bar är 1 mm.
Discussion
Den intrakraniell styrskruven metod som presenteras här möjliggör snabb och reproducerbar etablering av intrakraniell implanterad och i händerna på en utbildad djur tekniker, är detta förfarande mycket lätt utföras utan att det behövs en stereotaktisk enhet. Vår metod kombinerar användandet av en guide skruv, för att exakt lokalisera den region av hjärnan mest lämplig för in vivo tumörutveckling och en automatiserad infusionspump som möjliggör samtidig ympning av upp till 10 djur i taget. Guiden skruv augmentation förfarande tar mindre än 5 minuter att utföra. Den automatiserade infusion av celler vid 30 l / tim tar bara 10 minuter för en 5 l volym. Detta säkerställer korrekt dosering med konstant hastighet och minskar risken för cellen utvisning i den extra-kraniala området på grund av ökat intrakraniellt tryck. Vi har också utfört den här proceduren med 10 l volym och har inte observerat några extra kraniella tumörtillväxt grund av cellulära reflux. Eftersom den automatiserade infusionspumpen tillåter också flera djur som skall inokuleras samtidigt att vi kan injicera upp till 60 djur per timme jämfört med en stereotaktisk förfarande som är begränsad till cirka 15 djur per timme.
Det mest kritiska steget i detta förfarande är platsen för vägledning skruven i skallen som sin position bestämmer den ultimata platsen för tumören bulk. Om guiden skruven är för centralt, kommer cellerna injiceras i en region mellan de två hjärnhalvorna medan om guiden är placerad för långt fram, kommer cellerna inte injiceras in i hjärnan alls. Det är därför viktigt att vara så noggranna som möjligt att hitta guiden 2,5 mm i sidled och 1 mm främre till bregma 1. I denna studie använde vi en skruv av stål guide, även plast styrskruvarna finns också för de studier som kräver hjärnan såsom MR eller PET 6. Även om den automatiska infusionspumpen är kostnadseffektivt oöverkomliga för vissa grupper, kan cellerna fortfarande injiceras manuellt snabbare än stereotaktisk strategier. Sammantaget kan detta snabbt, korrekt och reproducerbar metod användas för att studera gliom, medulloblastom och hjärntumörer stam 7. Detta förfarande har utförts på över 500 möss mellan våra två laboratorier med dödsfall på grund av oväntade bedövning reaktioner (<1%). Möss som var bultade med guiden skruv och därefter infunderas med celler inte dör eller drabbas av någon neurologiska komplikationer som en följd av förfarandet. Djur har överlevt senaste 100 dagarna utan några komplikationer. Även om vi föredrog att använda en hårlös mus, ett nedsatt immunförsvar mus med hår som SCID skulle vara lika lämpliga, förutsatt att skallen håret togs bort före det kirurgiska ingreppet för att hålla platsen ren och för att förhindra håret att störa guide skruv.
Det finns flera nya behandlingar närvarande utvecklas för behandling av gliom 8-10. Nyligen visade vi att subkutan U87MG gliom xenografter kan hämmas genom behandling med AMG102 3, en humaniserad antikropp riktad mot HGF genomgår för närvarande klinisk utvärdering i gliom 5. Vi använde metoden beskrivs här för att skapa intrakraniella U87MG tumörer i hjärnan hos nakna möss. Vår studie visar tydligt nyttan av metoden och visar att AMG102 avsevärt hämmar tillväxten av orthotopic U87MG implanterad. Vi kommer att fortsätta att använda denna modell för att bestämma vilka andra läkemedel kan användas i kombination med AMG102 för att få mer effektiv hämning av tumörtillväxt.
Disclosures
Detta arbete stöddes av ett forskningsanslag från Amgen Inc.
Acknowledgments
Författarna vill tacka Verlene Henry och Lindsay Holmes för att få hjälp att utveckla denna modell. Detta arbete har delvis finansierats av James S. McDonnell Foundation (# 220.020.173).
Materials
| Name | Company | Catalog Number | Comments |
| DMEM/F12 | Invitrogen | 12634010 | |
| FCS | Bovogen | SFBS | |
| Trypsin | Invitrogen | 15050065 | |
| EDTA | Sigma-Aldrich | E6758 | |
| Balb/c nu/nu mice | ARC Perth | ||
| Screw Holder | Plastics One | SD-1 | |
| Drill Holder | Plastics One | DH-1 | |
| Drill Bit | Plastics One | D#60 | |
| Screw guide (metal) | Plastics One | C212SG | |
| Screw Dummy (stylus) | Plastics One | C212SD | |
| Hamilton Syringe (10 μl 26g cemented needle) | Grace Division Discovery Science | 80075 | |
| PHD 22/2000 infusion pump | Harvard Apparatus | 70-2003 | Optional |
| Vetbond | 3M | 1469SB | |
| Thermo pad | Harvard Apparatus | 340390 |
References
- Lal, S. An implantable guide-screw system for brain tumor studies in small animals. J Neurosurg. 92, 326-333 (2000).
- Jun, H. T. AMG 102, a fully human anti-hepatocyte growth factor/scatter factor neutralizing antibody, enhances the efficacy of temozolomide or docetaxel in U-87 MG cells and xenografts. Clin Cancer Res. 13, 6735-6742 (2007).
- Pillay, V. The plasticity of oncogene addiction: implications for targeted therapies directed to receptor tyrosine kinases. Neoplasia. 11, 448-458 (2009).
- Buchanan, I. M. Radiosensitization of glioma cells by modulation of Met signaling with the hepatocyte growth factor neutralizing antibody. AMG102. J Cell Mol Med. 15, 1999-2006 (2011).
- Wen, P. Y. A phase II study evaluating the efficacy and safety of AMG 102 (rilotumumab) in patients with recurrent glioblastoma. Neuro Oncol. 13, 437-446 (2011).
- Caretti, V. Monitoring of Tumor Growth and Post-Irradiation Recurrence in a Diffuse Intrinsic Pontine Glioma Mouse Model. Brain Pathol. 4, 441-451 (2011).
- Jallo, G. I., Volkov, A., Wong, C., Carson, B. S., Penno, M. B. A novel brainstem tumor model: functional and histopathological characterization. Childs Nerv. Syst. 22, 1519-1525 (2006).
- Johns, T. G. The efficacy of epidermal growth factor receptor-specific antibodies against gliomaxenografts is influenced by receptor levels, activation status, and heterodimerization. Clin Cancer Res. 13, 1911-1925 (2007).
- Scott, A. M. A phase I clinical trial with monoclonal antibody ch806 targeting transitional state and mutant epidermal growth factor receptors. Proc. Natl. Acad. Sci. U. S. A. 104, 4071-4076 (2007).
- Niyazi, M. Therapeutic options for recurrent malignant glioma. Radiother. Oncol. 98, 1-14 (2011).



