Summary
Применение классических страх кондиционирования поведенческие парадигмы для слуховых протезов исследования на крысах описано. Эта парадигма представляет собой механизм для выявления и обнаружения, а также различия между, отличные акустические и электрические стимулы использования сердечного ритма в качестве результата измерения.
Abstract
Острые препараты животного были использованы в исследованиях проспективно исследования электроды конструкции и методы стимулирования для интеграции в нейронных протезов слуховых, таких как слуховые имплантаты 1-3 мозга и слуховых имплантатов 4,5 мозга. В то время острого опыта может дать начальные соображения по поводу эффективности имплантатов, тестирование хронически имплантированных и бодрствования животных дает преимущество изучения психофизических свойств индуцированных ощущения использованием имплантируемых устройств 6,7.
Некоторые методы, такие как вознаграждение на основе оперантного обусловливания 6-8, обусловленное избежание 9-11, или классическое обусловливание страха 12 были использованы для обеспечения поведенческого подтверждения обнаружения соответствующих атрибутов стимула. Выбор методики включает в себя аспекты, включая балансировку время эффективность (часто в награду бедный подходов), возможность проверить множествостимул приписывает одновременно (ограничен в условных избегание), а мера надежности повторных раздражителей (потенциальные ограничения, когда физиологические меры применяются).
Здесь классический страх кондиционирования поведенческий метод представлен, которые могут быть использованы для одновременного тестирования и обнаружения стимула, и различия между двумя стимулами. Сердце ставка используется в качестве меры реакция страха, которая снижает или устраняет требование времени кодирования видео для замораживания поведение или другие подобные меры (хотя такие меры могут быть включены для получения сходящегося доказательств). Животные были обусловлены использованием этих методов в трех 2-часового кондиционирования сессий, каждая из которых обеспечивает 48 испытаний стимул. После 48 судебных заседаний тестирования были использованы для тестирования для выявления каждый стимул представлен в пар, и тест дискриминации между государствами-членами стимулов каждой пары.
Этот поведенческий метод представлен вконтексте их использования в исследованиях слухового протеза. Имплантация устройств ЭКГ телеметрии показали. После имплантации электродов в мозг кохлеарных ядра, руководствуясь мониторинга нейронных ответов на акустические стимулы, а также фиксация электрода на месте хронических использование также показано на рисунке.
Protocol
1. Электрокардиограмма телеметрии имплантации
- За час до начала операции имплантации, управлять Carprofen (4 мг / кг подкожно) для обеспечения послеоперационного обезболивания.
- Вводите кетамин / Ксилазин (Ke: 70 мг / кг, Ху: 10 мг / кг, внутрибрюшинно) для анестезии, чтобы первоначальной подготовки животных, включая бритье и вставки баров уха до перехода на Изофлюран анестезии, которая является более стабильной во время операции позволяет улучшить регулирование глубины и сокращает послеоперационный восстановление после наркоза.
- На начало анестезии, применять смазку глаз глаза животного, а затем побрить живот грудь и горло. Протрите участки кожи с помощью хирургического скраб, затем алкогольные подготовка кожи, а затем раствором антисептика. Установите дома клетке на тепло одеяло, чтобы согреться.
- Поместите животное в положении лежа на homeothermic пластины. Вставьте ваты под шею, чтобы поднять и выявить горло.
- Поместите носа сотрудничествапе (доставка 1-3% об / об Изофлюран в кислороде, 2 л в минуту) на нос животного и зафиксировать конус на место.
- Закрепите передние конечности в полу выдвинутом положении для создания натяжения кожи на груди и в горле, и, чтобы предотвратить скольжение нос свободной от носа конус.
- Вставьте зонд homeothermic одеяло в прямую кишку животного.
- Сделайте срединный разрез в коже, простирающейся от мечевидного отростка 20 мм каудально, чтобы разоблачить мышечного слоя. Сделать соответствующий разрез вдоль белой линии, а затем в брюшную полость.
- Вставьте устройство ЭКГ телеметрии в брюшную полость ведет простирается от ростральной конце отверстие, и сшивать хвостового 15 мм отверстие в брюшной полости.
- Сделайте срединный разрез на горле покрывающей трахеи, обнажая мышцы грудинно-подъязычный.
- Вставьте щипцы аллигатора ухо в пространстве подкожной ростральной разрез перед каудально, и использовать их для формирования subcutaneous туннель от ростральной в хвостовой разрез. Возьмитесь за положительный (красный) приводят в щипцы и убрать свинца через туннель.
- Поднимите грудинно-подъязычный мышцы с помощью щипцов и вставьте кончик положительный провод сверху на правую сторону переднего средостения, оставив примерно 1 мм петлю кабеля ростральнее вставки. Сшивать свинца, где она выходит из грудной полости и в верхней части цикла основных мышц.
- Вынести спинной стенке мечевидного и сшивать кончик отрицательный провод открытой поверхности.
- Проверьте имплантированным устройством сигнала для обеспечения адекватного ЭКГ могут быть получены.
- Поток избыток кабеля в брюшную полость. Шовный закрытия брюшной стенки, белой линии, а кожа живота.
- Шовный закрыты кожей горла.
- Прекратить поставки Изофлюран и продолжают доставлять кислород до стихийного движения не наблюдается.
- При движении не наблюдается, освободить передних конечностейг вернуть животных в родную клетку. Перемещение дома клетку так, что примерно половина клетки на тепло панели. Это позволит животному, когда мобильные, для перемещения между теплых и холодных областей в клетке. Мониторинг животного до амбулаторно, и выходить из дома клетку на тепло одеяло в течение 24 часов.
- Администрирование Carprofen (4 мг / кг подкожно) каждые 24 часа в течение 3-5 дней.
2. Имплантат мозг электродов
- За час до начала внедрения, администрирования Carprofen (4 мг / кг подкожно) для послеоперационного обезболивания.
- Вводите кетамин / Ксилазин (Ke: 70 мг / кг, Ху: 10 мг / кг, внутрибрюшинно) для анестезии.
- На начало анестезии, применять глазную мазь для защиты глаз, то брить голову животного. Протрите участки кожи бетадин использованием скраба, затем спиртом, а затем бетадин.
- Поместите животное в положении лежа на homeothermic пластины.
- Первая позиция полые панели уха примерно ожидаемого конечного положения,и снять и расположить животное так, чтобы ухо бар расположен в наружный слуховой проход.
- Вставьте второй полый бар в ухо противоположной наружного слухового прохода.
- Использование крыс зуб щипцами, открыть челюсти животного и подключить верхних резцов на зуб держателя.
- Вставьте носа конус над носом, и начать поставки Изофлюран (1-3% объем / объем кислорода). Животные в настоящее время сохраняется в течение операции с этим наркозом.
- Сделайте надрез в коже головы, около 1 мм слева от средней линии и простирается от 3-4 мм ростральной до 2-3 мм хвостовой лямбда.
- Уберите кожи и мышц сбоку от разреза, подвергая теменной кости и межтеменной кости. Скраб поверхности подвергаются кости с использованием 20% раствора перекиси водорода и марлевым тампоном.
- Просверлите небольшое отверстие в левой и правой теменной кости, и закрепите винтом хирургической стали в каждое отверстие, оставляя небольшой (0,5 мм) расстояние между HEAг каждого винта и навыков. Соедините эти винты на землю и ориентиры электрод высокого импеданс headstage.
- Просверлите отверстие размером примерно 2 мм Площадь боковой наибольшей степени от interpariental кости. Промойте отверстие с помощью стерильного физиологического раствора, чтобы удалить пыль костей или фрагментов костей, которые могут повредить электрод.
- Установите соединение динамиков слева полые панели уха.
- С помощью кончика иглы, сделать разрез в твердой мозговой оболочки в сагиттальной плоскости.
- Принесите электродов манипулятор на место над проемом, с caudorostral углом 10 °. Вставьте электрод вручную примерно на 2 мм на поверхности мозга. Убедитесь, что усилитель включен, то запечатать записи камеры.
- Приступить к циклическим доставки низкой (2-8 кГц), средних (16-24 кГц) и высокой (32 кГц, 44 кГц) частотный диапазон частот фильтром шумов. Максимальная скорость, с которой всплески должны быть доставлены является одним взрыв каждые 200 мс. Мониторинг нейронной активностит каждый канал для обнаружения ответов на шум презентации.
- Продолжить введение электродов, пока не вставлен общий расстояние приближается к 8 мм. Если 8 мм лимита без нервных реакций обнаружения, снять и переставить на другой электрод вставки. Если кохлеарные ядра (CN) была достигнута, сайты на кончике электрода должно показываться в первую очередь ответы на высокочастотных стимулов. Если электроды расположены в брюшной кохлеарные ядра (VCN), ответы на акустический стимул должен быть сильным компонентом начала (1-5 мс), а затем быстрое снижение активности.
- Продолжить, чтобы вставить электрод до кончиков электродов обнаружить ответы на низкочастотных стимулов, или слуховой управляемой деятельности перестает происходить (в этом случае, электрод может полностью прошли через CN и это может быть необходимо пересмотреть электрод размещения).
- Построить амплитудно-частотную ответ карту нейронов на электрод сITES. Это достигается за счет представленных звук через желаемый диапазон частот (обычно 1-44 кГц или 1-80 кГц) при амплитудах 1-70 дБ, с 10 повторений каждого стимула. Один стимул может быть доставлен через каждые 300 мс при сопоставлении CN. Если карта является неадекватным, рассмотреть вопрос о пересмотре размещения электродов.
- Нанесите тонкий слой кремния эластомера чуть выше подвергается хвостовиков электродов, например, что эластомер будет стекать черенки и пальто, как черенки и открытой поверхности мозга.
- Нанесите первый слой цемента протез полимера вокруг электрода. Цемент должен быть минимально вязким, чтобы уменьшить риск того, что электрод перемещается в процессе применения. Убедитесь, что полимер не распространяется на винты в теменной кости или подключенных кабелей. Подождите, акриловые, чтобы укрепиться, которая обычно занимает 5-10 минут.
- Снимите землю и ссылки провода headstage из винтов в теменной кости. Используя щипцы, гвидимому ветра провод заземления электрода вокруг винта в левой теменной кости.
- Нанесите второй слой зубной протез цемента полимером. Этот второй слой должен инкапсулировать оба винта, и впадают в пространство между головкой винта и черепа. При этом винты проведет акриловые и электрод к черепу. Подождите, акриловые, чтобы укрепиться.
- Удалить headstage от электрода разъем.
- Используя щипцы крысы зуб, снять кожу сбоку от полимера в полимер и использовать кисетный шов, чтобы закрыть кожи вокруг электродов подвергается разъем.
- Удалить ухо баров, освобождая голову.
- Последняя поставка Изофлюран и продолжают доставлять кислород через носовой конус, пока стихийное движение не наблюдается.
- Вернуть животное в дом клетке. Перемещение дома клетку так, что примерно половина клетки на тепло панели. Это позволит животному, когда мобильные, для перемещения между теплых и холодных областейклетке.
- Мониторинг животного до амбулаторно. Оставьте дома клетку на площадку тепла в течение 24 часов.
- Администрирование Carprofen (4 мг / кг подкожно) каждые 24 часа в течение 3-5 дней.
3. Кондиционирование
- Поместите животных в испытательную камеру.
- Включите устройство ЭКГ телеметрии.
- Дайте животным, чтобы акклиматизироваться к испытательной камере в течение пяти минут до начала кондиционирования. Это позволит частота сердечных сокращений, чтобы вернуться к базовым, так как обработка приводит к сердечным повышение ставки.
- Выполните процедуру кондиционирования:
- Доставка одного случайно выбранного члена пары акустических стимулов раз в 250 мс очередей, разделенных 250 мс молчания 80-170 сек. Каждый стимул презентации должны быть взлеты и падения время 10 мс, чтобы избежать 'щелчок' воспринимается, которые восприятия охватывает диапазон звуковых частот.
- Начать переменного второй член пары акустических стимулов с первым, представляя еч тон 250 мс затем 250 мс молчания.
- После 9,5 х 10 с периодом переменный тон презентации, управлять 0,5 мс ног шока (0,7 мА).
- Перестаньте тон презентации в течение 30 с, чтобы частота сердечных сокращений стабилизироваться.
- Возобновить поставки тон пара (с 3.4.1). Тон пары должны оптимально представлены в случайном порядке, и по крайней мере 12 пар тон должен быть использован для обеспечения кондиционирования обобщает все частоты пар и не является специфичным для частот, используемых тон. Продолжайте этот процесс до 48 циклов процедуры (испытания) были завершены.
- Отключите устройство ЭКГ, и вернуть животное в дом клетке.
4. Тестирование
- Anesthetise животных с использованием Изофлюран (1-3% объем / объем кислорода).
- Прикрепите кабель нейронной стимуляции подвергаются электродом разъем.
- Поместите животных в испытательную камеру.
- Включите устройство ЭКГ телеметрии. </ LI>
- Дайте животным, чтобы оправиться от Изофлюран анестезии и акклиматизироваться в испытательной камере в течение десяти минут до начала тестирования. Это позволит частота сердечных сокращений, чтобы вернуться к базовым и восстановления после краткого обезболивающий эффект.
- Выполните процедуру тестирования.
- Доставка одного случайно выбранного члена пары акустических стимулов раз в 250 мс очередей, разделенных 250 мс молчания 80-170. Каждый стимул презентации должны быть взлеты и падения время 10 мс, чтобы избежать 'щелчок' воспринимается, которые восприятия охватывает диапазон звуковых частот.
- Начать переменного второй член пары акустических стимулов с первым, представляя каждый тон 250 мс затем 250 мс молчания.
- После 9,5 х 10 с периодом переменный тон презентации, управлять 0,5 мс футов шок.
- Перестаньте тон презентации в течение 30 с, чтобы частота сердечных сокращений стабилизироваться.
- Начать поставки одного случайно СелеИДКТК член электрической стимуляции мозга пару раз, используя 250 мс периода стимуляции, разделенных на 250 мс без стимуляции 80-170 сек.
- Начать переменного второй член пары стимулов с первым, представляя каждый стимул для 250 мс затем 250 мс без стимуляции период. Продолжить переменного стимуляция в течение 10 с.
- Перестаньте стимул презентаций в течение 30 секунд, чтобы частота сердечных сокращений стабилизироваться.
- Возобновить поставки стимул пары (от 4.6.5 или 4.6.1). Стимул пары должны быть представлены в случайном порядке, и не менее 20 испытаний каждой пары стимул должен быть доставлен для обеспечения достаточного сердечного ритма данные собираются для обеспечения четкого средний результат и минимизировать изменчивость. Распределение испытаний с использованием акустических стимулов всей сессии тестирования снижает вероятность того, что вымирание будет происходить во время процедуры.
- Отсоедините кабель от стимуляции животного.
- Отключите ЭКГ девисе.
- Вернуть животное в дом клетке.
5. Представитель Результаты
Запись ЭКГ образец сделанный с помощью имплантированных устройств телеметрии через неделю после имплантации показано на рисунке 1. Такая запись обычно можно получить из имплантированных устройств, а также устройства продолжают функционировать надлежащим образом для записи на более шести месяцев, даже если растворимый шовный используется для прикрепления кабеля к мышце. ЭКГ показано на рисунке 2, была получена из животных в течение восьми месяцев после имплантации.
Рисунок 3 показывает расположение успешной имплантации. Электрод размещения есть много сайтов электрода в задне-кохлеарные ядра (PVCN), обеспечивающих стимулирование и записи доступ к большей части дорсовентральной аспект. Частоты ответов каждого электрода сайт для этого имплантации приведены на рисунке 4. Долго области PVCN, в которой электроды расположены приводит к популяции клеток, доступных для записи и стимуляции "настроенный" на широком диапазоне частот. Кроме того, население самих узко настроены - они реагируют только на узкой полосе звуковых частот (см. рисунок 5).
В отличие от неудачного расположения показан на рисунке 6. В этом случае электрод был сделан слишком медиально, а не вставлен достаточно глубоко проникнуть в PVCN. Как следствие, только электрод участков вблизи ответы кончик шоу звучать, как показано на рисунке 7. Кроме того, диапазон частот, которым доступны клеточных популяций настроены очень ограничены. Настройка населения себя узкий (см. рисунок 8), но кластерного распределения центральной частоты клеточных популяций делает стимулирования различных регионов частоты невозможно.
_content "> Базовый сердце скорость передачи данных варьируется от условного акустической презентации стимула. Для учета этой изменчивости, сырые частоты сердечных сокращений (HR) данные были нормированы доля HR наблюдается при чередовании стимулом начала (время 0). На рисунке 9 показано данных в различных формы, собранные в ходе первой сессии кондиционирования. пример HR результаты, полученные в других животных во второй половине начальных сессий кондиционирования представлена на рисунке 10. кондиционирования процесс акустических стимулов является быстрым и сильным изменениям в HR можно наблюдать с несколько испытаний; 7. в случае рисунках 9 и 10 изменений в HR наблюдается сразу же после начала стимула чередования (см. 3.4.1 и 3.4.2) свидетельствует о том, что животное способно различать начальный повторяется стимулов и второй стимул впоследствии добавлены.После начала сессии тестов, в которых электрическоеческих нейронных стимулов, а не акустические стимулы, как правило, поставляются, включение акустического стимула презентаций позволяет подтвердить, что кондиционирования эффекты все еще присутствуют. Общее изменение HR в ответ на начало презентации акустического стимула подтверждает, что условный эффект на акустических стимулов остается настоящим, как показано на рисунке 11. Кроме того, рис 12 представлены средние HR пропорционального изменения вокруг начала акустических чередование тон в первой тестовой сессии. Как и в рисунке 9 и 10, относительно устойчивый HR до введения второго раздражителя в отличие от быстрых изменений в области управления персоналом после введения второго раздражителя свидетельствует, что дискриминация между двумя тонами произошло.
С другой стороны, отсутствие обнаружения можно увидеть на рисунке 13, в которых электрическая стимуляция начинается. Средний пропорциональной HR канал GE в 10 испытаниях показывает никаких признаков соответствует быстрое падение наблюдается при обнаружении происходит, как показано на рисунке 11. Кроме того, отсутствие последовательной и быстрое изменение частоты сердечных сокращений на рисунке 14 показывает, что два электрических стимулов доставляется не являются достаточно разными для дискриминации происходят. И до начала переменного периода (до времени 0) и после смены начинается, среднее пропорциональное изменение HR остается близкой к линии без изменений.
Картина более характерна для дискриминации между членами нейронной пары стимул показано на рисунке 15. Снижение частоты сердечных сокращений происходит быстро после начала стимула чередования, а затем значительное увеличение частоты сердечных сокращений. Конкретной стратегии стимулирования, используемые в данном случае была успешной в создании соответствующего поведенческого ответа.
"SRC =" / files/ftp_upload/3598/3598fig1.jpg "/>
Рисунок 1. ЭКГ получены с помощью имплантированных устройств телеметрии одной недели после имплантации. Сигнал видел в этой записи в значительной степени характерно для записей, полученных с помощью этих устройств.

Рисунок 2. ЭКГ получены с помощью имплантированных устройств телеметрии через шесть месяцев после имплантации. Существует незначительное ухудшение сигнала, записанных в течение этого периода, и этот сигнал, безусловно, достаточно для расчета частоты сердечных сокращений животных.

Рисунок 3. 3D-реконструкция успешное размещение электродов, с помощью комбинированного рентгеновской компьютерной томографии и гистологических срезов. Оба электрода черенки проникли в задне-кохлеарного ядра с электродами ориентацииТед к лицу структуры.

Рисунок 4. Карта электрофизиологические ответы записаны с электродом размещения на рисунке 3. Каждая гистограмма показывает данные по активности на одном электроде сайт в ответ на презентации одной акустической частоты, каждая колонка 25 мс период времени. В обоих черенков множество электрода, ответов обнаружены в каждом отдельном сайте электрод только в ответ на довольно узкой полосе частот, но эти узкие полосы распределены в широком диапазоне частот. Такое распределение идеально, как много различных частот связанных областей мозга можно стимулировать самостоятельно.

Рисунок 5. Электрофизиологические реакции на канал 10 из имплантата представлены на рисунках 3 и утрастр. 4. В идеале, электрод размещения должно привести к нервных реакций на звуковой стимул быть обнаружены на нескольких каналах с амплитуды звука на уровне 10 дБ, как это видно в этом примере.

Рисунок 6. 3D-реконструкция неудачного расположения электродов. В то время как caudorostral угол электрода была правильной, она была слишком медиальной. Кроме того, электрод не был вставлен достаточно глубоко, в результате чего в местах ближайших кончик электрода расположены в спинном кохлеарные ядра.

Рисунок 7. Карта электрофизиологические ответы записаны с электродом размещения, как показано на рисунке 6. Активность происходит на концах каждого стержня электрода массив, но есть небольшое изменение в акустическом стимула частотычастоты, которые вызывает деятельность на каждый электрод сайта. Такая имплантация не позволяет стимуляции различных слоев частоты для дискриминации тестирования.

Рисунок 8. Электрофизиологические реакции на канал 28 на электрод размещение показано на рисунках 6 и 7. Акустический стимул производить сильные всплески активности, похожий на всплеск частоты, которое наблюдалось в очень успешной имплантации (рис. 3). Порог также довольно низкие, с ответами обнаружения в ответ на тон на 20 дБ. Если бы не было больших изменений в частотах на котором произошла сильная ответы на другие каналы массива этот канал, конечно, будет достаточно для стимуляции.
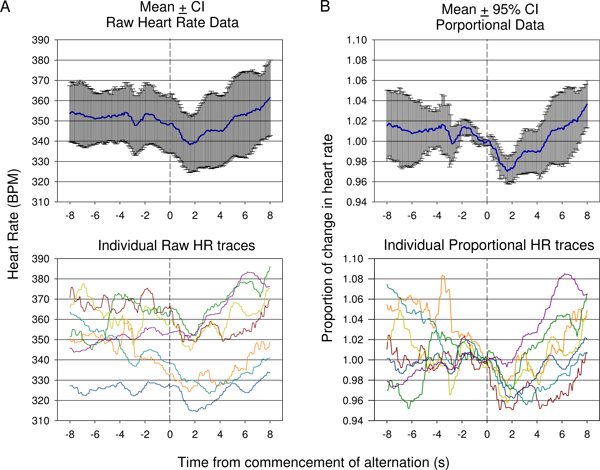
Рисунок 9. Сравнение сырья частоты сердечных сокращений () Verses означать пропорциональное (B) Данные, собранные в ходе первой сессии кондиционирования в одном животном. Ответы от 7 презентации показано на рисунке. В связи с изменением частоты сердечных сокращений, начиная до начала тон изменения означают, сырые частоты сердечных сокращений (± 95% доверительный интервал) не в полной мере показать степень изменения первоначальное падение частоты сердечных сокращений затем рост, как это указано в отдельных сырья следы (внизу). Среднее пропорциональное изменение частоты сердечных сокращений данных, в которой частота сердечных сокращений, делится на частоту сердечных сокращений во время условного акустической презентации стимулом для каждой трассы представлена в (B). Это свидетельствует о статистически значимое падение после условного раздражителя презентация конце значительный рост отраженного использованием 95% доверительными интервалами. Индивидуальные пропорциональной следы сердечного ритма показаны (B, внизу).
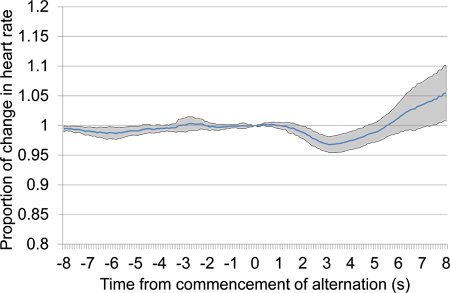
Рисунок 10. Средние пропорциональные сердце т ели переход от 8 с до 8 с после начала переменного акустического стимула презентации, объединив данные из второй и третьей сессиях кондиционирования. Представленные данные включают в себя семь испытаний представлены в течение двух сессий кондиционирования, четыре в первой сессии кондиционирования и три во второй. В ответ на переменный стимул презентации, большие начальные падение частоты сердечных сокращений произошла следуют конце увеличение частоты сердечных сокращений.
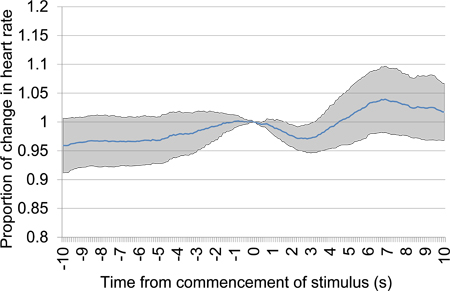
Рисунок 11. Среднее пропорциональное изменение частоты сердечных сокращений от 10 с до 10 с после начала презентации акустического стимула после 30 секунд молчания. Пробная данные были взяты из первой сессии тестирования и включает в себя шесть акустических презентации стимула. Ясно рано падение пульса свидетельствует о дискриминации между акустическими стимулами представлены.
es/ftp_upload/3598/3598fig12.jpg "/>
Рисунок 12. Среднее пропорциональное изменение частоты сердечных сокращений от 8 с до 8 с после начала переменное акустическое представление стимулов, принятых на первой сессии тестирования и в том числе пять акустических презентации стимула. Ясно рано падение пульса свидетельствует о дискриминации между акустическими стимулами представлены.
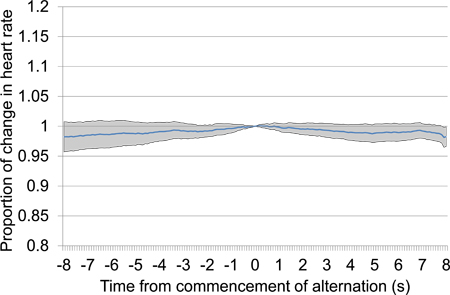
Рисунок 13. Среднее пропорциональное изменение частоты сердечных сокращений от 10 с до 10 с после начала электрической стимуляции мозга после 30 секунд молчания. Пробная данные были взяты из первой и второй сессий тестирования и включает в себя 18 электрических презентации стимуляции, все с теми же параметрами стимуляции. Отсутствие того или иного падение частоты сердечных сокращений, особенно проксимальных времени 0, в которых стимуляция начинается, наводит на мысль, что животное не в состоянии обнаружить Стимулнас.

Рисунок 14. Среднее пропорциональное изменение частоты сердечных сокращений от 8 с до 8 с после начала переменный электрический стимул презентации (см. 4.6.5 и 4.6.6), взятые из первой сессии тестирования и в том числе 33 докладов электрических стимулов. Нет постоянной практики изменение частоты сердечных сокращений происходит ближайшее время 0, что означает, что переменная стимулов недостаточно для различных дискриминация происходит.
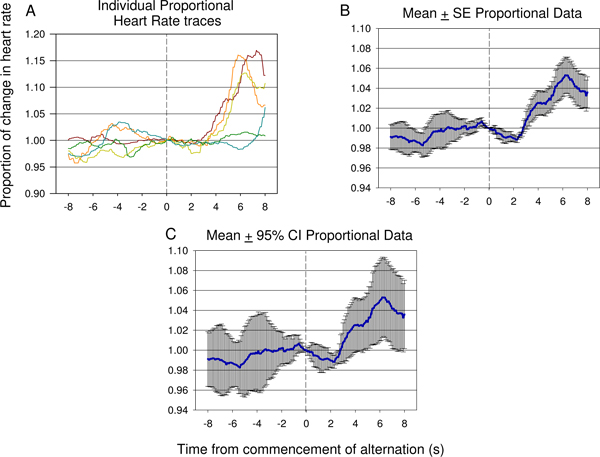
Рисунок 15. Типичные примеры отдельных следов (А) и означает пропорциональное сердце скорость передачи данных (B, C) от 8 с до 8 с после начала переменный электрический стимул презентации, взятые из седьмой сессии тестирования второго животного и в том числе 12 докладов электрических стимулов. Значительное уменьшение HR происходит быстро после введения второй нервный стимул сопровождается значительным ростом частоты сердечных сокращений отражение свидетельствует разница между первой и второй стимул был обнаружен в животных. Степень погрешности и дисперсия ответов можно увидеть в пропорциональном среднее ± стандартная ошибка (SE) сюжет показанный в (B). Значение падения и роста после второй презентации стимула можно проверить с помощью 95% доверительные интервалы применяются в данных, представленных в (С). Ответ видел в (С) похож на ответ показано на рисунке 9 B.
Discussion
Методы, описанные здесь, являются средством для тестирования целого ряда задач, дискриминация быстро, с коротким временем обучения и позволяет существенным автоматизации, минимизируя таким образом исследователь время, необходимое для обработки данных. Используя данные, полученные из имплантированных ЭКГ, расчет частоты сердечных сокращений (HR) изменение во времена стимул презентации могут быть автоматизированы. Ошибки обработки ЭКГ (например, пропуская ни одного сердца, удар) можно легко определить, поскольку они производят ложное большие изменения очевидны сердечного ритма в течение очень короткого периода, и такой легкий обнаружения ошибок сводит к минимуму требования к времени интенсивный ручной проверки данных .
Техника, описанная для имплантации устройства телеметрии ЭКГ постоянно производит запись практически без помех (рис. 1 и 2). Тем не менее, относительно небольшие изменения в размещении на себя инициативу в области средостения может привести к помехам от соседних мышцс и особенности дыхания, связанные шумы. Проверка правильного размещения проводов в процессе имплантации, особенно после наложения швов приводит в месте, позволяет точную настройку свинца размещения, чтобы минимизировать помехи.
Процесс имплантации в мозг кохлеарного ядра трудно. При использовании серийных презентаций полосового фильтра шумов несколько частотных диапазонов, а не широкополосный шум, которые ранее были использованы 3 ответов клеточных популяций на электроде сайты можно быстро проанализировать на АЧХ, а не менее конкретные шума ответ. Способность быстро определить, когда достаточно диапазоне частот настроенный клеточных популяций доступны имеет решающее значение для исследований, когда электрический стимул дискриминации подвергается испытанию. Если недостаточны распределения частот получается, то сравнение между стимуляцией различных диапазонах частот просто не возможно. Тем не менее, более длительный процессчастотно-амплитудная характеристика отображения имеет решающее значение для обеспечения подробно о широте настройки клеточных популяций и должно быть выполнено до фиксации электродов на месте.
В поведенческих обучения и тестирования, включение без стимула (или молчание) период испытаний, до начала стимула, позволяет в ответ на первоначальный стимул для начала изучить. При использовании электрических нервного возбуждения, в ответ на стимул начало свидетельствует, по той простой обнаружения стимула. Таким образом, когда нет ответа начала стимула, но ответ, когда второй стимул чередование вводится, можно сделать вывод, что только последний стимул может быть обнаружена. Без включения такой тихий период, не было бы никакого способа определить, что первый стимул не был обнаружен.
Ограничения в этой поведенческой техникой тестирования является то, что отсутствие футов потрясений, произнесенная после представления neuraл стимуляция может привести к развитию специфика в условных страх, страх, что выражается только когда акустический стимул представлен. Это означает, что животное может узнать, что особенности сенсорных эффектов нервного возбуждения, связанные с не получает ногой удар. В отличие от доставки футов потрясения после презентации нервного возбуждения может привести к условный страх нервного стимула себя, отличное от любого звука, как свойства нервной стимул может иметь. Результаты, полученные при исключении футов шока после нервного возбуждения, конечно, обеспечить более убедительные доказательства для нейронных стимул быть звук, как, чем те, которые используют ноги шока после нервного возбуждения, как и в первом случае условный страх обобщил от акустических до нервного возбуждения. Тем не менее, риск развития специфики акустических, а не нервного возбуждения присутствует. Использование полосового фильтра шума акустический стимул, а не чистый тон очередей, первая из которыхможет лучше отразить опыт восприятия нервного возбуждения, может уменьшить риск таких специфика разработки. Тем не менее, такая процедура вводит дополнительные переменные полосы пропускания фильтра, которые будут влиять на дискриминацию задач.
Дополнительные ограничения связаны с какими-либо хроническими нейронной имплантации, такие, как требуется для поведенческого тестирования, является изменение в зависимости от электродов или связанных нервной ткани с течением времени. Стимуляция нервных тканей может привести как к временным подавление нейронной активности 13 и изменения тканей, таких как потеря клеток 14 и прямой ответ мозговой ткани к электроду 15.
Описанный подход к имплантации и поведенческого тестирования предоставляет средства для тестирования и обнаружения и распознавания акустических и электрических стимулов с краткого обучения, а также возможность осуществлять контроль проб частоты. Методика использования изменения ЧСС в измерениие условный страх может быть применим не только для тестирования слуховых, но и в более общем плане любой сенсорной тестирования, в которой стимулы могут быть представлены для любого дискретного периода, в котором обнаружение сенсорных дискриминации лучшего.
Disclosures
Доктор Антонио Паолини является директором Bioengenesis Technologies Pty Ltd, которые являются представителями австралийской для Такер Дэвиса технологии и австралийский дистрибьютор Зонды NeuroNexus.
Acknowledgments
Финансирование данного исследования была предоставлена Гарнетт пропусков и Родни Уильямс Мемориальный фонд и La Trobe университета.
Materials
| Name | Company | Catalog Number | Comments |
| PowerLab |  ADInstruments ADInstruments |
ML880 | Records data received from the implanted TR40 transmitter |
| SmartCtrl controller card | Med Associates, Inc. | DIG-716B | Controls the behavioral test chamber, including foot shock |
| Modular behavioral test chamber | Med Associates, Inc. | ENV-009 | Test chamber size: 30.5cm x 39.4cm |
| Aversive stimulus generator | Med Associates, Inc. | ENV-410B | Delivers aversive foot-shock to metal-bar floor of the cage through a Solid State Scrambler unit |
| Programmable Attenuator | TDT | PA5 | Controls the amplitude of delivered acoustic signal to ensure stable amplitude across frequencies |
| Electrostatic speaker driver | TDT | ED1 | Drives the electrostatic speakers (EC1, ES1) |
| Free-field electrostatic speaker | TDT | ES1 | Sounds are presented using this speaker in the behavioral test chamber |
| Coupled electrostatic speaker | TDT | EC1 | Sounds are presented using this speaker during neural implant surgery |
| Stimulator Base Station | TDT | RX7 | Controls delivery of electrical neural stimulation (used with MS16) |
| Microstimulator | TDT | MS16 | Delivers multichannel electrical neural stimulation |
| Processing base station | TDT | RZ2 | Records neural activity during brain implantation (using PZ2 preamplifier) |
| Preamplifier | TDT | PZ2-256 | 256-channel high impedance preamplifier |
| Telemetry device receiver | Telemetry Research | TR162 | Receives digital signal from TR40, and converts to amplified analogue output |
| Implantable electrocardiogram telemetry device | Telemetry Research | TR40 | The implanted transmitter device, sampling at 2kHz |
| Multifunction Processor | Tucker-Davis Technologies | RX6 | Used to generate acoustic stimuli |
| Vertex Castavaria | Vertex Dental | Dental acrylic used to fix the electrode in place | |
| Kwik-Sil Adhesive, low viscosity | World Precision Instruments, Inc. | Silicon elastomer used to coat the electrode shanks | |
| Multichannel electrode | NeuroNexus Technologies | a2x16-10mm 100-500-413 | The 2-shank 32-channel extracellular electrode array used for implantation. The electrode sites have been activated to produce a coating of iridium oxide in preparation for stimulation. |
References
- Mauger, S. J., Shivdasani, M. N., Rathbone, G. D., Argent, R. E., Paolini, A. G. An in vivo investigation of first spike latencies in the inferior colliculus in response to multichannel penetrating auditory brainstem implant stimulation. Journal of Neural Engineering. 7, 036004-036004 (2010).
- Shivdasani, M. N., Mauger, S. J., Argent, R. E., Rathbone, G. D., Paolini, A. G. Inferior colliculus responses to dual-site intralamina stimulation in the ventral cochlear nucleus. J. Comp. Neurol. 518, 4226-4242 (2010).
- Shivdasani, M. N., Mauger, S. J., Rathbone, G. D., Paolini, A. G. Inferior colliculus responses to multichannel microstimulation of the ventral cochlear nucleus: Implications for auditory brain stem implants. Journal of Neurophysiology. 99, 1-13 (2007).
- Lenarz, M., Lim, H. H., Patrick, J. F., Anderson, D. J., Lenarz, T. Electrophysiological Validation of a Human Prototype Auditory Midbrain Implant in a Guinea Pig Model. JARO. 7, 383-398 (2006).
- Lim, H. H. Auditory Cortical Responses to Electrical Stimulation of the Inferior Colliculus: Implications for an Auditory Midbrain Implant. Journal of Neurophysiology. 96, 975-988 (2006).
- Otto, K. J., Rousche, P. J., Kipke, D. R. Microstimulation in auditory cortex provides a substrate for detailed behaviors. Hearing research. 210, 112-117 (2005).
- Gai, Y. Detection of Tones in Reproducible Noise Maskers by Rabbits and Comparison to Detection by Humans. JARO. 8, 522-538 (2007).
- Miller, C. A., Woodruff, K. E., Pfingst, B. E. Functional responses from guinea pigs with cochlear implants. I. Electrophysiological and psychophysical measures. Hearing Research. 92, 85-99 (1995).
- Beitel, R. E., Vollmer, M., Snyder, R. L., Schreiner, C. E., Leake, P. A. Behavioral and neurophysiological thresholds for electrical cochlear stimulation in the deaf cat. Audiology & Neurotology. 5, 31-38 (2000).
- Beitel, R. E., Snyder, R. L., Schreiner, C. E., Raggio, M. W., Leake, P. A. Electrical cochlear stimulation in the deaf cat: comparisons between psychophysical and central auditory neuronal thresholds. J. Neurophysiol. 83, 2145-2162 (2000).
- Vollmer, M., Beitel, R. E., Snyder, R. L. Auditory detection and discrimination in deaf cats: Psychophysical and neural thresholds for intracochlear electrical signals. Journal of Neurophysiology. 86, 2330-2343 (2001).
- LeDoux, J. E., Cicchetti, P., Xagoraris, A., Romanski, L. M. The lateral amygdaloid nucleus: sensory interface of the amygdala in fear conditioning. Journal of Neuroscience. 10, 1062-1069 (1990).
- McCreery, D. B., Yuen, T. G., Agnew, W. F., Bullara, L. A. A characterization of the effects on neuronal excitability due to prolonged microstimulation with chronically implanted microelectrodes. IEEE Transactions on Biomedical Engineering. 44, 931-939 (1997).
- Liu, X., McPhee, G., Seldon, H. L., Clark, G. M. Histological and physiological effects of the central auditory prosthesis: surface versus penetrating electrodes. Hearing Research. 114, 264-274 (1997).
- Polikov, V. S., Tresco, P. A., Reichert, W. M. Response of brain tissue to chronically implanted neural electrodes. Journal of Neuroscience Methods. 148, 1-18 (2005).



