Summary
Anvendelsen av en klassisk frykt condition atferds paradigme for auditiv protese forskning på rotter er beskrevet. Dette paradigmet gir en mekanisme for å identifisere både deteksjon av, og diskriminering mellom, tydelig akustisk og elektrisk stimuli ved hjelp av hjerte-rate som et resultat mål.
Abstract
Akutte dyr preparater har blitt brukt i forskning prospektivt å undersøke elektrode design og stimulering teknikker for integrering i nevrale auditive proteser, som auditive hjernestammen implantater 1-3 og auditiv midbrain implantater 4,5. Mens akutte eksperimenter kan gi innledende innsikt til effektiviteten av implantatet, teste de kronisk implantert og våken dyr gir fordelen med å undersøke psykofysiske egenskaper følelsene indusert ved hjelp av implanterte enheter 6,7.
Flere teknikker som belønning-baserte operant conditioning 6-8, under forutsetning unngåelse 9-11, eller klassisk frykt conditioning 12 har blitt brukt til å gi atferdsmessige bekreftelse på påvisning av et relevant stimulus attributt. Valg av en teknikk innebærer balansering aspekter inklusive tid effektivitet (ofte dårlig i belønning tilnærminger), muligheten til å teste et mangfold avstimulus tilskriver samtidig (begrenset i kondisjonert unngåelse), og mål pålitelighet av gjentatte stimuli (en potensiell begrensning når fysiologiske tiltak er ansatt).
Her er en klassisk frykt condition atferdsmessige metoden presenteres som kan brukes til å samtidig teste både deteksjon av en stimulus, og diskriminering mellom to stimuli. Hjerte-rate brukes som et mål på frykt respons, noe som reduserer eller eliminerer behovet for tidkrevende video koding for fryse oppførsel eller andre slike tiltak (selv om slike tiltak kan være inkludert for å gi konvergent bevis). Dyrene ble kondisjonert ved hjelp av disse teknikkene i tre 2-timers condition økter som hver gir 48 tiltakspakker prøvelser. Etterfølgende 48-rettssaken testing økter ble deretter brukt til å teste for deteksjon av hver stimulus i framlagte par, og test diskriminering mellom medlemslandene stimuli til hvert par.
Dette atferdsmessige metoden er presentert isammenheng med utnyttelsen sin i auditiv protese forskning. Implantasjon av elektrokardiogram telemetri enheter vises. Etterfølgende implantasjon av hjernen elektroder inn i Cochlear Nucleus, ledet av overvåking av nevrale responser til akustiske stimuli, og fiksering av elektroden på plass for kronisk bruk er likeledes vist.
Protocol
1. Elektrokardiogram Telemetri Device Implantasjon
- En time før implantering kirurgi oppstart, administrere carprofen (4 mg / kg sc) for å gi postoperativ smertelindring.
- Injiser Ketamin / xylazin (Ke: 70 mg / kg, XY: 10 mg / kg, ip) for anestesi å tillate innledende dyr forberedelse inkludert barbering og sette øret barer før du bytter til isofluran anestesi som er mer stabil under operasjonen slik at bedre regulering av dybde og forkorter etter kirurgi utvinning fra anestesi.
- Ved anestesi utbruddet, gjelder øye smøremiddel for dyrets øyne, og så barbere magen thorax og hals. Tørk den eksponerte huden ved hjelp av kirurgisk skrubb, etterfulgt av alkoholholdig hud forberedelse, etterfulgt av antiseptisk løsning. Plasser hjem buret på en varme teppe til å varme.
- Plasser dyret i liggende stilling på en homeothermic plate. Sett vatt under nakken å heve og utsetter halsen.
- Plasser nese-cone (levere 1-3% vol / vol isofluran i oksygen, 2 l pr min) over nesen på dyret og fikse membranen på plass.
- Fest forskjeftet lemmer i en semi-utvidet posisjon til å generere stramming av huden over thorax og hals, og for å forhindre nesen sklir fri for nesen-membran.
- Sett sonden av homeothermic teppe inn i endetarmen av dyret.
- Lag en midtlinjen snitt i huden og går fra xiphoid prosessen 20 mm caudally å utsette muskelen laget. Lag en matchende snitt langs linea alba, og deretter i bukhulen.
- Sett EKG telemetri-enheten inn i bukhulen med ledninger som går ut fra rostral enden av åpningen, og sy på bakre del av 15 mm av åpningen i peritoneum.
- Lag en midtlinjen snitt i halsen overliggende luftrøret, utsette sternohyoid muskelen.
- Sett alligator øret tang til subkutan plass på rostral snitt vender caudally, og bruke disse til å danne en subcutaneous tunnel fra rostral til kaudal snitt. Grip den positive (røde) bly i pinsett og trekke ledningen gjennom tunnelen.
- Løft sternohyoid muskel bruke pinsett og sette tuppen av den positive dorsally mot høyre fremre mediastinum, etterlot ca 1 mm sløyfe av kabel rostral til innsetting. Suture ledningen der den strekker seg fra brysthula og på toppen av loopen til underliggende muskler.
- Utsett dorsal veggen av xiphoid, og sy tuppen av den negative den eksponerte overflaten.
- Sjekk den implanterte enheten signal å sikre en tilstrekkelig EKG kan skaffes.
- Fôr overskytende kabelen inn i bukhulen. Sutur lukket peritoneal veggen, linea alba, og abdominal hud.
- Sutur stengt huden på halsen.
- Slutt levering av isofluran, og fortsetter å levere oksygen til spontan bevegelse blir observert.
- Når bevegelsen er observert, slipper forbein end tilbake dyret til sin hjem bur. Flytt hjem buret slik at omtrent halvparten av buret er på varmen pad. Dette vil gi dyret, når mobilen, for å flytte mellom varmere og kjøligere områder av buret. Overvåk dyret til ambulerende, og forlate hjemmet buret på varme teppet i 24 timer.
- Administrer carprofen (4 mg / kg sc) hver 24. time i 3-5 dager.
2. Brain elektrode Implant
- En time før implantering oppstart, administrere carprofen (4 mg / kg sc) for postoperativ smertelindring.
- Injiser Ketamin / xylazin (Ke: 70 mg / kg, XY: 10 mg / kg, ip) for anestesi.
- Ved anestesi utbruddet, gjelder øyesalve for å beskytte øynene, så barbere hodet på dyret. Tørk av eksponert hud med Betadine skrubb, etterfulgt av alkohol, etterfulgt av Betadine.
- Plasser dyret i liggende stilling på en homeothermic plate.
- Plasser en hul øre bar i omtrent den forventede endelige posisjon,og løfte og posisjonere dyret slik at øret baren ligger i de eksterne akustiske meatus.
- Skyv andre hul øret bar inn i kontralaterale eksterne akustiske meatus.
- Bruk av rotte-tann tang, åpner dyrets kjeve og hekt øvre fortennene over tann holderen.
- Skyv nese-membran over nesen, og starter levering av isofluran (1-3% vol / vol i oksygen). Dyr er nå opprettholdt gjennom kirurgi med denne narkosen.
- Lag et snitt i huden av hodet, ca 1 mm igjen av midtlinjen og strekker seg fra 3-4 mm rostral til 2-3 mm kaudal av lambda.
- Trekk huden og muskel sidelengs fra snittet, utsette issebeinet og interparietal bein. Skrubb overflaten av eksponert bein bruker 20% hydrogen peroxide løsning og en gaskompress.
- Bor et lite hull i venstre og høyre parietal bein, og skru en kirurgisk stål skrue inn i hvert hull igjen en liten (0,5 mm) mellomrom mellom head av hver skrue og dyktighet. Koble disse skruene til bakken og referanseelektrode poeng av high-impedans headstage.
- Bor et hull ca 2 mm torg i den laterale-mest omfanget av interpariental bein. Skyll hull med sterilt saltvann for å fjerne bein støv eller beinrester som kan skade elektroden.
- Fest koblingen høyttaleren til venstre hul øre bar.
- Bruk tuppen av en nål, gjør et snitt i dura på sagittal planet.
- Ta elektroden manipulator på plass over åpningen, med en caudorostral vinkel på 10 °. Sett elektroden manuelt ca 2 mm i overflaten av hjernen. Sørg for at forsterkeren er slått på, deretter forsegle innspillingen kammeret.
- Commence syklisk levering av lav (2-8 kHz), mid-range (16-24 kHz) og høy (32 kHz-44kHz) frekvensbåndet-pass filtrert støy. Den maksimale hastigheten som pakker skal leveres er en burst hvert 200 ms. Overvåk nevral aktivitet ent hver kanal for å oppdage svar på støy presentasjon.
- Fortsett innsetting av elektroden til enten total satt distanse nærmer 8 mm. Dersom 8 mm grensen er nådd uten nevrale responser å bli oppdaget, ta ut og flytte elektrode for en annen innsetting. Hvis cochlear nucleus (CN) er nådd, bør nettsteder på tuppen av elektroden bli vist responser primært til høyfrekvente stimuli. Hvis elektrodene er plassert i den ventrale cochlear nucleus (VCN), svar på akustisk stimulus bør ha en sterk debut komponent (1-5 ms), etterfulgt av en rask nedgang i aktiviteten.
- Fortsett å sette elektroden til tuppene av elektroden oppdage responser til lavfrekvente stimuli, eller auditiv-drevet virksomhet opphører å forekomme (i dette tilfellet kan elektroden har gått helt gjennom CN og det kan være nødvendig å revidere elektroden plassering).
- Konstruer en frekvens-amplitude respons kart av nevroner ved elektroden sITES. Dette oppnås ved presenteres lyd over ønsket frekvensområde (typisk 1-44 kHz eller 1-80 kHz) ved amplituder 1-70 dB, med 10 repetisjoner av hver stimulus. En stimulus kan leveres hver 300 ms når kartlegge CN. Hvis kartet er utilstrekkelig, kan du vurdere å revidere plasseringen av elektroden.
- Påfør et tynt lag av silisium elastomer litt over de utsatte elektroden Shanks, slik at elastomer vil flyte ned skankene og frakk både de Shanks og den eksponerte overflaten av hjernen.
- Påfør et første lag med protese sement polymer rundt elektroden. Sementen skal være minimalt tyktflytende, for å redusere risikoen for elektroden blir flyttet i forbindelse med søknaden. Påse at polymeren ikke dekker skruene i parietal bein eller de vedlagte kablene. Vent til akryl å herde, som vanligvis tar 5-10 minutter.
- Ta av bakken og referanse ledninger av headstage fra skruene i parietalbena. Ved hjelp av tang, gently vikle jordledning av elektroden rundt skruen i venstre issebeinet.
- Påfør et andre lag protese sement polymer. Denne andre lag bør kapsle både skruer og flyt inn i mellomrommet mellom skruehodet og skallen. Ved å gjøre dette, vil skruene holde akryl og elektroden til skallen. Vent til akryl til å herde.
- Fjern headstage fra elektroden kontakten.
- Bruke rotte tann tang, løfte huden lateralt til polymer over polymer, og bruke en pung-streng sutur å lukke huden rundt utsatt elektroden kontakten.
- Fjern øret barer og frigjør hodet.
- Slutt levering av isofluran, og fortsetter å levere oksygen gjennom nesen kjeglen inntil spontan bevegelse blir observert.
- Tilbake dyret til hjemmet buret. Flytt hjem buret slik at omtrent halvparten av buret er på varmen pad. Dette vil gi dyret, når mobilen, for å flytte mellom varmere og kjøligere områder avbur.
- Overvåk dyret til ambulerende. Forlate hjemmet buret på varme puten i 24 timer.
- Administrer carprofen (4 mg / kg sc) hver 24. time i 3-5 dager.
3. Conditioning
- Plasser dyret i testen kammeret.
- Aktiver EKG telemetri-enheten.
- La dyret akklimatisere seg til testen kammeret i fem minutter før du begynner condition. Dette vil tillate pulsen å gå tilbake til en baseline, som håndtering fører til hjertefrekvens høyde.
- Utfør condition prosedyren:
- Lever en tilfeldig valgt medlem av akustisk stimulus paret gjentatte ganger i 250 ms serieopptak atskilt av 250 ms stillhet for 80-170 s. Hver stimulus presentasjon må ha en vekst og fall på 10 ms for å unngå et "klikk" blir oppfattet som perceptually dekker et spekter av lydfrekvenser.
- Commence vekslende det andre medlem av akustisk stimulus paret med det første, presentere each tone for 250 ms etterfulgt av en 250 ms med stillhet.
- Etter 9,5 s av 10 s periode av vekslende tone presentasjon, administrere en 0,5 ms fot-sjokk (0,7 mA).
- Slutt tone presentasjoner for 30 s for å tillate hjertefrekvensen for å stabilisere.
- Gjenopptas tone par levering (fra 3.4.1). Tonepar bør optimalt bli presentert i en tilfeldig rekkefølge, og minst 12 tonepar bør brukes for å sikre at conditioning generaliserer alle frekvens par og er ikke spesifikk for tone frekvenser som brukes. Fortsett denne prosessen til 48 sykluser av prosedyren (forsøk) har blitt fullført.
- Deaktiver EKG-enheten, og returnere dyret til hjemmet buret.
4. Testing
- Anesthetise dyret ved hjelp av isofluran (1-3% vol / vol i oksygen).
- Fest nervestimulering kabelen til utsatt elektroden kontakten.
- Plasser dyret i testen kammeret.
- Aktiver EKG telemetri-enheten. </ Li>
- La dyret å komme seg fra isofluran anestesi og akklimatisere seg til testen kammeret i ti minutter før du begynner testing. Dette vil tillate pulsen å gå tilbake til en baseline og utvinningen fra kort narkosen effekt.
- Utfør testprosedyre.
- Lever en tilfeldig valgt medlem av en akustisk stimulus par ganger i 250 ms serieopptak atskilt av 250 ms stillhet for 80-170s. Hver stimulus presentasjon må ha en vekst og fall på 10 ms for å unngå et "klikk" blir oppfattet som perceptually dekker et spekter av lydfrekvenser.
- Commence vekslende det andre medlem av akustisk stimulus paret med det første, presenterer hver tone for 250 ms etterfulgt av 250 ms av stillhet.
- Etter 9,5 s av 10 s periode av vekslende tone presentasjon, administrere en 0,5 ms fot-sjokk.
- Slutt tone presentasjoner for 30 s for å tillate hjertefrekvensen for å stabilisere.
- Commence levering av en tilfeldig Selected medlem av en elektrisk hjernestimulering par ganger, med 250 ms perioder med stimulering adskilt med 250 ms av ikke-stimulering for 80-170 s.
- Commence vekslende det andre medlemmet av stimulus paret med det første, presenterer hver stimulus for 250 ms etterfulgt av en 250 ms ikke-stimulering periode. Fortsett vekslende stimulering for 10 s.
- Slutt stimulans presentasjoner for 30 s for å tillate hjertefrekvensen for å stabilisere.
- Gjenopptas stimulus par levering (fra 4.6.5 eller 4.6.1). Stimulans parene skal presenteres i en tilfeldig rekkefølge, og minst 20 studier av hver stimulus par skal leveres for å sikre tilstrekkelig hjerte-rate data samles for å gi et klart gjennomsnittlig resultat og redusere variabiliteten. Distribuere forsøk med akustiske stimuli hele testøkt reduserer sannsynligheten for at utryddelsen vil skje under inngrepet.
- Løsne stimulering kabelen fra dyret.
- Deaktiver EKG device.
- Tilbake dyret til hjemmet buret.
5. Representative Resultater
En prøve EKG tatt ved hjelp av implanterte telemetri-enheten en uke etter implantasjon er vist i Figur 1. Et slikt opptak kan vanligvis fås fra de implanterte enheter, og enhetene fortsetter å fungere tilstrekkelig for opptak for i overkant av seks måneder, selv om løselig sutur brukes til å feste kabler til muskel. EKG opptak er vist i Figur 2 er hentet fra et dyr over åtte måneder etter implantasjon.
Figurene 3 viser plasseringen av en vellykket implantasjon. Elektroden plasseringen har mange elektrodestedene i posteroventral cochlear nucleus (PVCN), som gir stimulering og opptak tilgang til mye av dorsoventral aspektet. De frekvens-reaksjoner fra hver elektrode stedet for dette implantering presenteres i figur 4. Den lange delen av PVCN hvor elektrodene er distribuert fører til celle populasjoner tilgjengelige for opptak og stimulering "tuned" til et bredt spekter av frekvenser. Videre er bestandene selv snevert stemt - de reagerer bare på et smalt bånd av lydfrekvenser (se figur 5).
I kontrast er en dårlig plassering vist i Figur 6. I dette tilfellet ble elektroden plasseres for medialt, og ikke satt tilstrekkelig dypt for å trenge gjennom PVCN. Som en konsekvens, til bare elektrodestedene nær tuppen viser svarene høres ut som vist i Figur 7. I tillegg er utvalget av frekvenser som de tilgjengelige celle populasjoner er innstilt meget begrenset. Tuning av bestandene selv er smal (se figur 8), men samlet fordeling av de sentrale frekvenser for celle populasjoner gjør stimulere forskjellige frekvenser regioner umulig.
_content "> Baseline pulsdata varierte mellom aircondition akustiske stimuli presentasjoner. ta hensyn til denne variasjonen, ble rå hjertefrekvens (HR) data normaliseres som en andel av HR observert når stimulus veksling påbegynt (tidspunkt 0). Figur 9 viser data i ulike skjemaene samlet inn under den første condition økten. Et eksempel på HR resultatene oppnådd i et annet dyr i siste del av de innledende condition øktene er presentert i Figur 10. Den beskrevne prosessen på akustiske stimuli er rask, og sterke endringer i HR kan observeres med få studier, 7. i tilfelle av figur 9 og 10 Endringen i HR observert umiddelbart etter oppstart av stimulus alternering (se 3.4.1 og 3.4.2) gir bevis på at dyret er i stand til å skjelne mellom det første gjentatte stimulans og den andre stimulus senere lagt til.Etter oppstart test sesjoner, der elektrke nevrale stimuli fremfor akustiske stimuli er vanligvis levert, tillater inkludering av akustiske stimuli presentasjoner bekreftelse på at condition effekter er fortsatt til stede. En generell endring i HR som svar på begynnelsen av akustisk stimulus presentasjon bekrefter at en betinget effekt på akustiske stimuli fortsatt til stede, som vist i Figur 11. Tilsvarende presenterer Figur 12 gjennomsnittlig HR proporsjonal endring rundt oppstart av akustisk tone vekslingen i den første testen økten. Som med Figur 9 og 10, gir relativt jevn HR før introduksjon av andre stimulus i kontrast med de raske endringene i HR etter innføringen av den andre stimulus bevis for at diskriminering mellom de to tonene har oppstått.
I kontrast, kan fravær av påvisning sees i figur 13 der elektrisk stimulering er påbegynt. Middelverdien proporsjonale HR chan ge over 10 studier viser ingen indikasjon på konsistent raske fallet observert når gjenkjenning skjer, som i figur 11. Tilsvarende foreslår fraværet av en konsistent og raske endringer i hjertefrekvensen i Figur 14 at de to elektriske stimuli blir levert ikke er tilstrekkelig forskjellig for diskriminering å skje. Både før oppstart av vekslende periode (før tiden 0) og etter veksling starter, gjenstår gjennomsnittlig proporsjonal endring i HR nær linjen ingen endring.
Et mønster mer karakteristisk for diskriminering mellom de to medlemmer av en nevral stimulus par er vist i Figur 15. En reduksjon i hjertefrekvens skjer raskt etter oppstart av stimulus alternering, etterfulgt av en betydelig økning i hjertefrekvensen. Den spesielle stimulering strategien brukes i dette tilfellet var vellykket i å produsere en adferdsmessig relevant respons.
"Src =" / files/ftp_upload/3598/3598fig1.jpg "/>
Figur 1. Et EKG opptak innhentet ved hjelp av implanterte telemetri-enheten en uke etter implantasjon. Signalet sett i denne innspillingen er i stor grad typisk av opptakene innhentet ved hjelp av disse enhetene.

Figur 2. Et EKG opptak innhentet ved hjelp av implanterte telemetri-enheten seks måneder etter implantasjon. Det er ubetydelig degradering av signalet blir registrert i løpet av den tiden, og dette signalet er absolutt tilstrekkelig for beregning av dyret hjertefrekvens.

Figur 3. En 3D rekonstruksjon av en vellykket plassering av elektrodene, bruk kombinert X-ray computertomografi og histologiske seksjoner. Begge elektrode Shanks penetrert posteroventral cochlear kjerne med elektroder oriented å møte strukturen.

Figur 4. Kartet over elektrofysiologiske responser er tatt opp med elektroden plassering av figur 3. Hver histogram viser data for virksomheten på en elektrode stedet i respons til presentasjon av en akustisk frekvens; hver kolonne representerer en 25 ms tidsperiode. På begge Shanks av elektroden array, er svarene oppdaget ved hver enkelt elektrode stedet bare som svar på en ganske smalt bånd av frekvenser, men disse smale band er fordelt over et bredt spekter av frekvenser. En slik fordeling er ideelt, så mange forskjellige frekvens-assosierte regioner av hjernen kan stimuleres uavhengig.

Figur 5. Den elektrofysiologisk respons ved kanal 10 fra implantatet presentert i figur 3 & amp; 4. Ideelt sett bør elektrode plasseringer føre til nevrale responser til akustisk stimulus som blir oppdaget på flere kanaler med lyd amplitude så lavt som 10 dB, som vises i dette eksempelet.

Figur 6. En 3D rekonstruksjon av en dårlig elektrodene skal plasseres. Mens caudorostral vinkelen på elektroden var riktig, var det for medial. Videre ble elektroden ikke satt tilstrekkelig dyp, noe som resulterer det i områder nærmest spissen av elektroden blir plassert innenfor dorsal cochlear kjernen.

Figur 7. Kartet over elektrofysiologiske responser er tatt opp med elektrodene skal plasseres som vist i Figur 6. Aktiviteten skjer på tuppen av hver stamme av elektroden array, men det er lite variasjon i det akustiske stimulus frekvensen som utløser aktivitet ved hver elektrode stedet. En slik implantasjon aktiverer ikke stimulering av forskjellig frekvens lag for diskriminering testing.

Figur 8. The elektrofysiologisk respons ved kanalen 28 på elektroden plassering vist i figur 6 og 7. Akustisk stimulus produsere sterke utbrudd av aktivitet, som ligner på spikefrekvens som ble sett i den meget vellykkede implantasjon (figur 3). Terskel er også ganske lav, med svar som blir oppdaget i respons til toner ved 20 dB. Hvis det var større variasjon i de frekvensene som de sterkeste reaksjonene inntraff tvers andre kanaler i tabellen denne kanalen ville sikkert være tilstrekkelig for stimulering.
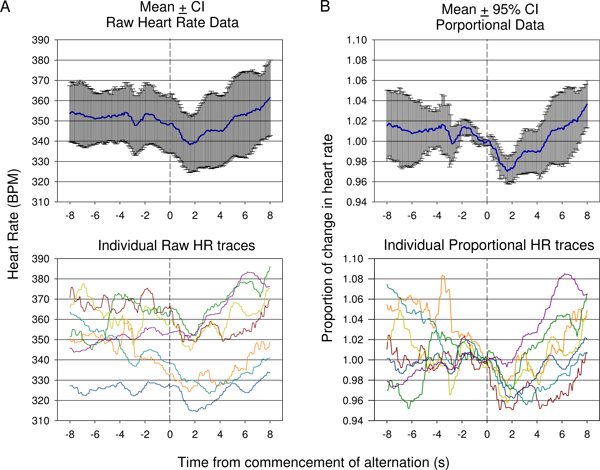
Figur 9. Sammenligning av rå hjertefrekvens (A) verses bety proporsjonale (B) data samlet inn under første condition sesjon i en dyr. Responses fra 7 presentasjoner vises. På grunn av variasjonen i start puls før oppstart av tonen endring, mener rå hjertefrekvens (± 95% konfidensintervall) ikke i tilstrekkelig grad viser graden av endring av en innledende fall i hjertefrekvens etterfulgt av økning som angitt i individuell rå spor (A, nederst). Mean proporsjonal endring i pulsdata der pulsen er delt pulsen på tidspunktet for betinget akustisk stimulus presentasjon for hvert spor er presentert i (B). Dette viser en statistisk signifikant nedgang etter betinget stimulus presentasjon med en sen betydelig økning reflektert bruk av 95% konfidensintervall. Individuelle proporsjonale hjertefrekvens spor vises (B, nederst).
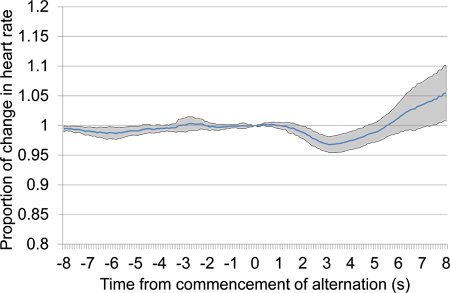
Figur 10. Mean proporsjonal hjerte r spiste endring fra 8 s før 8 s etter oppstart av vekslende akustisk stimulus presentasjon, kombinere data fra den andre og tredje condition økter. Den presenterte data inneholder syv studier som presenteres i løpet av de to condition økter, fire i den første condition sesjon og tre i andre. Som svar på vekslende stimulus presentasjon, en stor initial fall i hjertefrekvens skjedde etterfulgt av en sen økning i hjertefrekvensen.
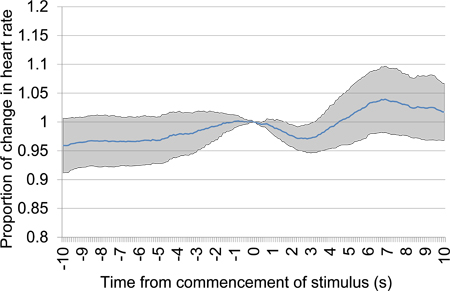
Figur 11. Mean proporsjonal hjertefrekvens endring fra 10 s før 10 s etter oppstart av akustisk stimulus presentasjon etter en 30 s. stillhet periode. Trial data ble hentet fra den første testøkt og inneholder seks akustiske stimulans presentasjoner. En tidlig klart fall i hjertefrekvens gir bevis for diskriminering mellom de akustiske stimuli presenteres.
es/ftp_upload/3598/3598fig12.jpg "/>
Figur 12. Mean proporsjonal hjertefrekvens endring fra 8 s før 8 s etter oppstart av vekslende akustisk stimulus presentasjon, hentet fra den første testøkt og med fem akustiske stimulans presentasjoner. En tidlig klart fall i hjertefrekvens gir bevis for diskriminering mellom de akustiske stimuli presenteres.
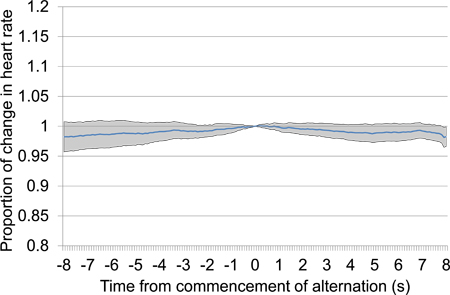
Figur 13. Mean proporsjonal hjertefrekvens endring fra 10 s før 10 s etter oppstart av elektrisk hjernestimulering etter en 30 s. stillhet periode. Trial data ble hentet fra første og andre test sesjoner og består av 18 elektriske stimulering presentasjoner, alle med de samme stimulering innstillingene. Fraværet av noen spesiell nedgang i hjertefrekvensen, spesielt proksimalt for tiden 0 der stimulering starter, antyder at dyret ikke er i stand til å oppdage stimuloss.

Figur 14. Mean proporsjonal hjertefrekvens endring fra 8 s før 8 s etter oppstart av vekslende elektrisk stimulans presentasjon (se 4.6.5 og 4.6.6), hentet fra den første testøkt og med 33 elektriske stimulans presentasjoner. Ingen konsistent mønster av endring i hjertefrekvensen forekommer nær tid 0, noe som tyder på at de vekslende stimuli er tilstrekkelig annerledes for diskriminering å skje.
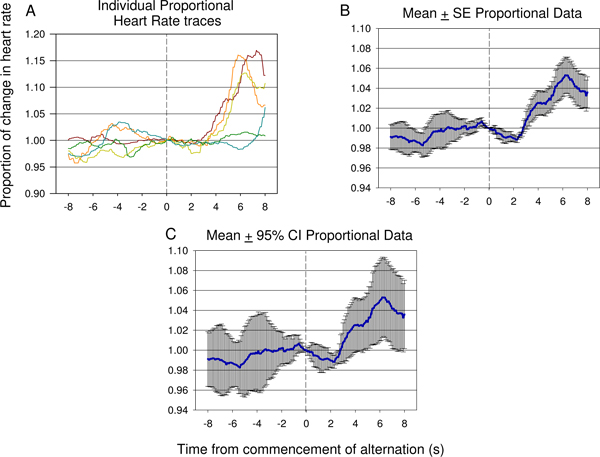
Figur 15. Representative eksempler på individuelle spor (A) og gjennomsnittlig proporsjonale pulsdata (B, C) fra 8 s før 8 s etter oppstart av vekslende elektrisk stimulans presentasjon, tatt fra den syvende testøkt av et sekund dyr, og inkludert 12 elektriske stimulans presentasjoner. En betydelig reduksjon i HR oppstår raskt etter innføringen av andre nevrale stimulus følges av en betydelig økning i hjertefrekvens reflektert tyder forskjellen mellom første og andre stimuli har blitt oppdaget av dyret. Graden av feil og avvik på responsen kan sees i den proporsjonale gjennomsnitt ± standard feil (SE) plottet vist i (B). Betydningen av dip og veksten etter den andre stimulus presentasjonen kan verifiseres ved hjelp 95% konfidensintervall er brukt på de data som vises i (C). Responsen sett i (C) er lik responsen se i figur 9 B.
Discussion
Teknikkene som beskrives her et middel for å teste en rekke diskriminering oppgaver raskt, med korte treningstiden og åpner for betydelig automatisering, og dermed minimere forsker tid som kreves for databehandling. Ved hjelp av data hentet fra implantert EKG, beregning av hjerte-rate (HR) endringer i tider med stimulus presentasjon kan automatiseres. Feil i EKG behandling (for eksempel glipp av en eneste hjerte-beat) lett kan identifiseres som de produserer spuriously store endringer i tilsynelatende hjerte-rate for en meget kort periode, og slik lett feildeteksjon minimerer behovet for tidkrevende manuelle data gjennomgang .
Teknikken er beskrevet for implantering av EKG telemetri-enheten produserer konsekvent opptak med lite eller ingen forstyrrelser (se figur 1 & 2). Imidlertid kan relativt små variasjoner i plasseringen av bly i mediastinum regionen føre til forstyrrelser fra nærliggende muskels og særlig respirasjon-assosiert støy. Bekrefter korrekt plassering av ledningene under implantasjon prosessen, særlig etter suturing leads på plass, gjør finjusteringer av bly plassering for å minimalisere interferens.
Prosessen av hjernen implantasjon inn et cochlea-kjernen er vanskelig. Ved å bruke serielle fremstillingene av band-pass filtrert støy av flere frekvensområder, snarere enn bredbånd støy som tidligere har blitt brukt 3, kan svarene av celle populasjoner ved elektrodestedene bli raskt anmeldt i form av frekvens-respons i stedet for den mindre-spesifikke støy respons. Evnen til raskt å identifisere når et tilstrekkelig utvalg av frekvens-justerte celle populasjoner er tilgjengelige er kritisk i forskning når elektrisk stimulans diskriminering blir testet. Hvis utilstrekkelig frekvens-fordeling oppnås, så sammenligning mellom stimulering av forskjellige frekvensområder er rett og slett ikke mulig. Likevel, jo lenger prosessav frekvens-amplitude respons kartlegging er fortsatt kritisk til å gi detaljer om broadness av tuning av celle populasjoner og bør utføres før feste elektroden på plass.
I atferds opplæring og testing, gjør at inkludering av en ikke-stimulus (eller stille) perioden mellom studier, før stimulus onset, responsen på første stimulans utbruddet å bli undersøkt. Ved bruk av elektrisk nervestimulering, gir svar på stimulus onset bevis for den enkle påvisning av stimulus. Så når det ikke er stimulus onset svar, men en reaksjon når den andre veksling stimulus blir innført, kan det utledes at det bare er sistnevnte stimulus kan oppdages. Uten inkludering av en slik stille periode, ville det ikke være noen måte å fastslå at den tidligere stimulus ikke ble oppdaget.
En begrensning i denne atferdsmessige testing teknikken er at fravær av munn-sjokk etter presentasjonen av neural stimulering kan føre til utvikling av spesifisitet i kondisjonert frykt, er slik at frykten bare uttrykt når akustisk stimulus presenteres. Det er, kan dyret lære at de særlige sensoriske effekter av nervestimulering er tilknyttet mottar ikke en fot sjokk. I kontrast kunne levere fot-sjokk etter presentasjonen av nevrale stimulering føre til en betinget frykt for nevrale stimulus selv, atskilt fra eventuelle lyd-lignende egenskaper det nevrale stimulus kan ha. Resultater oppnådd når unntatt en fot-sjokk etter nervestimulering sikkert gi sterkere bevis for nevrale stimulus er forsvarlig-aktig enn de som bruker en fot-sjokk etter nervestimulering, som i den tidligere saken betingede frykten har generalisert fra akustisk til nevrale stimulering. Likevel er risikoen for å utvikle spesifisitet til akustisk snarere enn nervestimulering stede. Bruk av band-pass filtrert støy som akustisk stimulus i stedet for rene tone bursts, tidligere somkan bedre reflektere den perseptuelle opplevelse av nevrale stimulering, kan redusere risikoen for slik spesifisitet utvikle. Men innfører en slik prosedyre ytterligere variable av båndbredde av filteret, noe som vil påvirke diskriminering oppgaver.
En ekstra begrensning knyttet til enhver kronisk nevrale implantasjon, som kreves for behavioral testing, er endringen i funksjon av elektroden eller den tilknyttede nevrale vev over tid. Stimulering av nevrale vev kan føre til både midlertidig undertrykkelse av nevral aktivitet 13 og vevsforandringer som celle tap 14 og direkte hjernevev respons til elektroden. 15
Den beskrives tilnærming til implantasjon og atferdsmessige testing gir et middel for å teste både deteksjon og diskriminering av akustiske og elektriske stimuli med kort opplæring, og evnen til å utøve kontroll av rettssaken frekvens. Teknikken med å bruke endring i HR som en målee av betinget frykt kan være aktuelt å ikke bare auditiv testing, men mer generelt til et sensorisk testing som stimuli kan presenteres for noen diskrete periode, og der påvisning av sensorisk diskriminering er ønsket.
Disclosures
Dr. Antonio Paolini er en direktør for Bioengenesis Technologies Pty Ltd som er de australske representanter for Tucker Davis Technologies og australske distributør av NeuroNexus prober.
Acknowledgments
Finansiering for denne forskningen ble gitt av Garnett Passes og Rodney Williams Memorial Foundation og La Trobe University.
Materials
| Name | Company | Catalog Number | Comments |
| PowerLab |  ADInstruments ADInstruments |
ML880 | Records data received from the implanted TR40 transmitter |
| SmartCtrl controller card | Med Associates, Inc. | DIG-716B | Controls the behavioral test chamber, including foot shock |
| Modular behavioral test chamber | Med Associates, Inc. | ENV-009 | Test chamber size: 30.5cm x 39.4cm |
| Aversive stimulus generator | Med Associates, Inc. | ENV-410B | Delivers aversive foot-shock to metal-bar floor of the cage through a Solid State Scrambler unit |
| Programmable Attenuator | TDT | PA5 | Controls the amplitude of delivered acoustic signal to ensure stable amplitude across frequencies |
| Electrostatic speaker driver | TDT | ED1 | Drives the electrostatic speakers (EC1, ES1) |
| Free-field electrostatic speaker | TDT | ES1 | Sounds are presented using this speaker in the behavioral test chamber |
| Coupled electrostatic speaker | TDT | EC1 | Sounds are presented using this speaker during neural implant surgery |
| Stimulator Base Station | TDT | RX7 | Controls delivery of electrical neural stimulation (used with MS16) |
| Microstimulator | TDT | MS16 | Delivers multichannel electrical neural stimulation |
| Processing base station | TDT | RZ2 | Records neural activity during brain implantation (using PZ2 preamplifier) |
| Preamplifier | TDT | PZ2-256 | 256-channel high impedance preamplifier |
| Telemetry device receiver | Telemetry Research | TR162 | Receives digital signal from TR40, and converts to amplified analogue output |
| Implantable electrocardiogram telemetry device | Telemetry Research | TR40 | The implanted transmitter device, sampling at 2kHz |
| Multifunction Processor | Tucker-Davis Technologies | RX6 | Used to generate acoustic stimuli |
| Vertex Castavaria | Vertex Dental | Dental acrylic used to fix the electrode in place | |
| Kwik-Sil Adhesive, low viscosity | World Precision Instruments, Inc. | Silicon elastomer used to coat the electrode shanks | |
| Multichannel electrode | NeuroNexus Technologies | a2x16-10mm 100-500-413 | The 2-shank 32-channel extracellular electrode array used for implantation. The electrode sites have been activated to produce a coating of iridium oxide in preparation for stimulation. |
References
- Mauger, S. J., Shivdasani, M. N., Rathbone, G. D., Argent, R. E., Paolini, A. G. An in vivo investigation of first spike latencies in the inferior colliculus in response to multichannel penetrating auditory brainstem implant stimulation. Journal of Neural Engineering. 7, 036004-036004 (2010).
- Shivdasani, M. N., Mauger, S. J., Argent, R. E., Rathbone, G. D., Paolini, A. G. Inferior colliculus responses to dual-site intralamina stimulation in the ventral cochlear nucleus. J. Comp. Neurol. 518, 4226-4242 (2010).
- Shivdasani, M. N., Mauger, S. J., Rathbone, G. D., Paolini, A. G. Inferior colliculus responses to multichannel microstimulation of the ventral cochlear nucleus: Implications for auditory brain stem implants. Journal of Neurophysiology. 99, 1-13 (2007).
- Lenarz, M., Lim, H. H., Patrick, J. F., Anderson, D. J., Lenarz, T. Electrophysiological Validation of a Human Prototype Auditory Midbrain Implant in a Guinea Pig Model. JARO. 7, 383-398 (2006).
- Lim, H. H. Auditory Cortical Responses to Electrical Stimulation of the Inferior Colliculus: Implications for an Auditory Midbrain Implant. Journal of Neurophysiology. 96, 975-988 (2006).
- Otto, K. J., Rousche, P. J., Kipke, D. R. Microstimulation in auditory cortex provides a substrate for detailed behaviors. Hearing research. 210, 112-117 (2005).
- Gai, Y. Detection of Tones in Reproducible Noise Maskers by Rabbits and Comparison to Detection by Humans. JARO. 8, 522-538 (2007).
- Miller, C. A., Woodruff, K. E., Pfingst, B. E. Functional responses from guinea pigs with cochlear implants. I. Electrophysiological and psychophysical measures. Hearing Research. 92, 85-99 (1995).
- Beitel, R. E., Vollmer, M., Snyder, R. L., Schreiner, C. E., Leake, P. A. Behavioral and neurophysiological thresholds for electrical cochlear stimulation in the deaf cat. Audiology & Neurotology. 5, 31-38 (2000).
- Beitel, R. E., Snyder, R. L., Schreiner, C. E., Raggio, M. W., Leake, P. A. Electrical cochlear stimulation in the deaf cat: comparisons between psychophysical and central auditory neuronal thresholds. J. Neurophysiol. 83, 2145-2162 (2000).
- Vollmer, M., Beitel, R. E., Snyder, R. L. Auditory detection and discrimination in deaf cats: Psychophysical and neural thresholds for intracochlear electrical signals. Journal of Neurophysiology. 86, 2330-2343 (2001).
- LeDoux, J. E., Cicchetti, P., Xagoraris, A., Romanski, L. M. The lateral amygdaloid nucleus: sensory interface of the amygdala in fear conditioning. Journal of Neuroscience. 10, 1062-1069 (1990).
- McCreery, D. B., Yuen, T. G., Agnew, W. F., Bullara, L. A. A characterization of the effects on neuronal excitability due to prolonged microstimulation with chronically implanted microelectrodes. IEEE Transactions on Biomedical Engineering. 44, 931-939 (1997).
- Liu, X., McPhee, G., Seldon, H. L., Clark, G. M. Histological and physiological effects of the central auditory prosthesis: surface versus penetrating electrodes. Hearing Research. 114, 264-274 (1997).
- Polikov, V. S., Tresco, P. A., Reichert, W. M. Response of brain tissue to chronically implanted neural electrodes. Journal of Neuroscience Methods. 148, 1-18 (2005).



