Summary
古典恐惧制约行为模式大鼠的听觉假肢研究中的应用介绍。这个范例提供一个机制,确定双方的检测和歧视之间,独特的声学和电刺激采用心率作为测量结果。
Abstract
急性动物制剂已用于电极设计和技术集成的刺激听觉神经假肢,如听觉脑干植入1-3和听觉中脑植入4,5前瞻性调查研究。虽然急性实验可以给植入的成效初步的洞察力,长期植入和清醒动物测试提供了研究的感觉的心理属性的优势诱导植入设备使用6,7。
如奖励为基础的操作条件6-8,条件避税9-11,或古典恐惧空调12几种技术已被用于提供相关的刺激属性的行为检测确认。技术的选择涉及平衡的各个方面,包括时间效率(通常是基于奖励办法中的穷人),能力测试多个刺激属性同时(空调避税有限),并测量反复刺激(生理措施时,一个潜在的约束)的可靠性。
在这里,古典恐惧制约行为的方法,可以用来同时测试两种检测刺激,两个刺激之间的歧视。心率是用来作为衡量的恐惧反应,从而减少或消除了耗时的视频编码冻结行为或其他类似措施的规定(尽管这些措施可包括提供收敛的证据)。空调使用这些技术,在3个2小时的空调会议,各提供48个刺激试验动物。随后的48个试验测试,然后用来测试提出对每个刺激,检测和测试对每个成员的刺激之间的歧视。
这种行为的方法利用其在听觉假肢研究中。植入心电图遥测设备。随后脑电极植入到声刺激耳蜗核神经反应监测指导,并到地方长期使用固定电极同样所示。
Protocol
1。心电图遥测装置植入
- 植入手术开始前一小时,管理卡洛芬(4毫克/千克SC)提供手术后的镇痛作用。
- 注射氯胺酮/甲苯噻嗪(克:70毫克/千克,XY:10毫克/千克,IP)麻醉前允许开关这是更稳定的异氟醚麻醉在手术可以更好地调节深度初步的动物准备,包括剃须和插入耳酒吧并缩短麻醉手术后的恢复。
- 在麻醉起效,适用于动物的眼睛和眼部润滑剂,然后剃腹部胸部和喉咙。使用手术擦洗,其次是酒精的皮肤准备,消毒液擦拭裸露的皮肤。家庭笼上放置一个热毯温暖。
- 放置在仰卧位上homeothermic板的动物。插入颈部下方的填料提升和公开的喉咙。
- 将鼻子的合作NE(体积/体积的氧气,每分钟2升)在异氟醚在动物的鼻子和修复到位锥提供1-3%。
- 脱颖而出,四肢固定在一个半延伸位置在胸部和喉咙产生皮肤张力,以防止打滑的鼻子的鼻锥。
- 插入动物的直肠探头的homeothermic毯子。
- 请在中线延长从剑突过程20毫米的尾端暴露肌肉层皮肤切口。请沿白线匹配的切口,然后腹腔。
- 插入腹腔心电图遥测设备,延长延髓年底开幕的线索,缝合腹膜开幕尾15毫米。
- 覆气管喉咙正中切口,暴露胸骨舌骨肌。
- 面临延髓尾端切口插入皮下空间鳄鱼耳钳,使用这些形成subcut,aneous隧道从吻端到尾部的切口。握正(红)中铅的镊子,并收回率先通过隧道。
- 使用镊子提起胸骨舌骨肌和插入右前纵隔背面朝着积极的主导作用的一角,留下约1毫米的电缆环路喙插入。缝合的情况下,率先从胸腔和底层肌肉的循环顶部延伸。
- 揭露的剑突背墙,缝合负极露出水面的一角。
- 检查植入装置的信号,以确保能获得足够的心电图。
- 多余的电缆送入腹腔。缝合关闭腹腔壁,白线,腹部皮肤。
- 缝合关闭皮肤的喉咙。
- 停止交货,异氟醚和继续输送氧气,直到观察自发运动。
- 观察运动时,释放的前肢D的返回到其家笼子里的动物。移动的家,约一半的笼笼,使热垫。这将使动物,移动时,移动之间的笼子里的温暖和凉爽的地区。监测动物,直到门诊和热毯上的24小时内离开家笼。
- 卡洛芬(4毫克/千克SC)每24小时(3-5天)管理。
2。脑电极植入
- 植入开始前一小时,手术后的镇痛管理卡洛芬(4毫克/千克SC)。
- 麻醉注射氯胺酮/甲苯噻嗪(克:10毫克/千克,IP:70毫克/千克,XY)。
- 在麻醉起效,适用于眼膏,以保护眼睛,然后剃了头的动物。擦拭裸露的皮肤,使用优碘擦洗,其次是酒精,优碘。
- 放置俯卧上homeothermic板的动物。
- 放置一个中空的耳朵吧,约为预期的最终位置解除和动物的位置,使耳栏是位于外耳道。
- 滑动到对侧外耳道第二中空的耳朵吧。
- 用鼠齿钳,打开动物的下颚和勾在牙齿持有人的上门牙。
- 滑过鼻子的鼻锥,并开始交付异氟醚(1-3%VOL /氧卷)。这种麻醉的手术,现在保持整个动物。
- 使头部皮肤切口,约1毫米的中线左侧,从3-4毫米,喙2-3毫米的lambda尾延伸。
- 收回的皮肤和肌肉的横向切口,露出顶叶骨骼和interparietal的骨。擦洗表面使用20%的双氧水和纱布暴露骨。
- 钻一个小孔,在左,右顶骨外科钢螺丝拧入每个孔之间留下一个小空间(0.5毫米)的HEA每个螺丝和技能。这些螺钉连接地面和高阻抗探头参比电极点。
- 在横向最大程度的interpariental骨钻一个约2毫米见方的洞。冲洗孔,用无菌生理盐水,以消除任何骨粉或骨头碎片,这可能会损坏电极。
- 将耦合扬声器左空心耳酒吧。
- 使用一针的尖端,使硬脊膜矢状平面上的一个切口。
- 带入开幕以上地方电极操纵,与caudorostral角为10°。手动约2毫米电极插入大脑的表面。确保放大器打开,然后密封的录音室。
- 开始周期性交付低(2-8千赫),中档(16-24千赫)和高频率的关系(32 kHz-44kHz的)带通滤波器噪声。阵阵时,应交付的最大速率是一个突发每200毫秒。监测神经活动ţ每个通道检测噪声演示的响应。
- 继续插入电极插入任总距离,直到接近8毫米。如果没有被发现的神经反应达到8毫米的限制,退出并重新插入另一电极。如果已达到耳蜗核(CN),在电极尖端的网站应显示反应主要以高频率的刺激。如果电极在位于腹侧耳蜗核(VCN),声刺激的反应,应该有一个强大的发病组件(1-5毫秒),其次是在活动急剧下降。
- 继续插入电极,直到电极提示检测到低频率的刺激,或听觉驱动的活动不再发生(在这种情况下,可能通过电极完全通过CN可能有必要修改电极反应安置)。
- 电极小号构建一个神经元的频率幅度响应图ITES。这是通过提出跨越所需的频率范围内(一般为1-44 kHz或1-80千赫)声音振幅1-70分贝与10重复,每个刺激。一个刺激可交付每300毫秒时,映射的点数。如果地图是不足的,可以考虑修改电极的位置。
- 应用略高于暴露在外的电极柄薄薄的一层,硅橡胶等弹性体将流下来的柄和外套都柄和大脑露出水面。
- 应用义齿水泥聚合物电极周围的第一层。水泥应该是最低限度的粘性,在应用过程中提出的电极,以减少风险。确保该聚合物不包括在顶骨螺钉或连接电缆。等待丙烯酸变硬,通常需要5-10分钟。
- 从顶骨螺丝,拆下探头的接地和参考线。使用镊子,Gently风地线电极周围左顶骨螺钉。
- 应用义齿水泥聚合物的第二层。这第二层应该封装成两个螺丝,和流量之间的螺丝头颅骨的空间。这样做,螺丝将举行丙烯酸和电极的头骨。等待硬化的丙烯酸。
- 取下电极连接器的探头。
- 用鼠齿钳,解除以上的高分子聚合物外侧的皮肤,并用荷包缝合关闭周围皮肤暴露在外的电极接头。
- 取下耳酒吧,释放头部。
- 异氟醚年底交付,并继续提供氧气通过鼻锥,直到观察自发运动。
- 返回家笼动物。移动的家,约一半的笼笼,使热垫。这将使动物,移动时,移动之间的温暖和凉爽的地区笼。
- 监测动物,直到门诊。离开家24小时的热垫笼。
- 卡洛芬(4毫克/千克SC)每24小时(3-5天)管理。
3。空调
- 将动物试验室。
- 激活心电遥测设备。
- 五分钟前开始空调让动物适应环境的试验室。这将允许返回到基线心率,作为处理导致心率升高。
- 执行空调过程:
- 提供一个在250毫秒,250毫秒的沉默分开80-170小号阵阵多次声刺激对随机选择的成员。每个刺激呈现必须有一个10毫秒的上升和下降时间,以避免“点击'被察觉,感知涵盖的声音频率范围。
- 声刺激对第二个成员展开交流与第一,呈现EACH音为250毫秒250毫秒的沉默之后。
- 后10秒交替基调演讲期间的9.5小号,管理0.5毫秒脚震(0.7毫安)。
- 停止30秒的基调演讲,让心率稳定。
- 重新开始调对交付(从3.4.1)。音对最佳应提交在一个随机序列,并应使用至少12个音对,以确保空调推广到对所有频率和使用的音调频率是不特定。继续这个过程,直到已完成48个周期的程序(审判)。
- 心电图设备停用,并返回家笼的动物。
4。测试
- Anesthetise使用异氟醚的动物(1-3%VOL /氧卷)。
- 将神经刺激电缆暴露在外的电极连接器。
- 将动物试验室。
- 激活心电图遥测设备。</ LI>
- 让动物从异氟醚麻醉和适应环境的恢复,10分钟前开始测试试验室。这将允许心率恢复到基线和恢复短暂的麻醉效果。
- 执行测试程序。
- 提供一个由250毫秒的沉默分隔为80-170S在250毫秒阵阵多次声刺激对随机选择的成员。每个刺激呈现必须有一个10毫秒的上升和下降时间,以避免“点击'被察觉,感知涵盖的声音频率范围。
- 声刺激对第二个成员展开交流与第一,呈现每个音250毫秒之后250毫秒沉默。
- 经过10秒交替基调演讲期间的9.5小号,管理0.5毫秒脚休克。
- 停止30秒的基调演讲,让心率稳定。
- 一个随机塞莱开始交付的电脑刺激对重复使用250毫秒刺激,无刺激250毫秒分开80-170小号期间,执行局成员。
- 开始交替刺激对第一,第二个成员,每个刺激呈现250毫秒250毫秒无刺激期间其次。 10秒,继续交替刺激。
- 停止刺激简报30秒的允许心率稳定。
- 重新开始刺激对交付(从4.6.5或4.6.1)。应刺激对随机序列,并交付至少20刺激对每个试验应确保足够的心率数据收集提供了一个清晰的平均结果,并尽量减少变异。分布试验,整个测试会议使用的声刺激减少,灭绝将发生在手术过程中的可能性。
- 脱离动物的刺激电缆。
- 停用的心电图黛维CE。
- 返回家笼动物。
5。代表结果
植入遥测设备,植入后的一个星期采取的一个范例记录心电图如图1所示。从植入式设备,通常可以得到这样的录音和设备继续充分发挥作用超过六个月记录,可溶性缝合,即使是用来贴上电缆肌肉。在图2所示的心电图记录是从动物获得了八个多月后植入。
图3显示了一个成功植入的位置。电极放置posteroventral耳蜗核(PVCN)有许多电极网站,提供许多背腹方面的刺激和记录访问。这种植入电极每个站点的频率响应在图4。只要PVCN面积分布在电极,导致细胞群的访问记录和刺激“微调”的频率范围。此外,人口本身是狭义的调整-他们只响应一个声音频率的窄带( 见图5)。
与此相反,一个贫穷的位置如图6所示。在这种情况下,电极被放置太内侧,并没有充分插入深入渗透PVCN的。因此,只有附近的尖端显示反应的电极位置声音,如在图7所示。此外,访问的细胞群是调整的频率范围非常受限。调整自己的人口是窄( 见图8),但聚集分布的细胞群的中心频率,使刺激不同的频率区域不可能。
_content“>基准心脏率数据,空调声刺激演示之间不等。这种变化,原料心率(HR)数据作为人力资源的比例观察刺激交替时开始(0)正常化。 图9显示了在不同的数据第一的空调会议期间收集的形式。在另一种动物的后半部分的初始空调会议期间获得的人力资源结果的一个例子是在图10。声刺激的调节过程是迅速的,并在人力资源可以观察到强的转变少数试验; 7 图9和10的情况下,在人力资源的变化观察交替刺激(参见3.4.1和3.4.2)生效后立即提供的证据表明,动物是能够区分初始反复刺激和后来加入的第二个刺激。后开始测试会议,其中ELECTR通常提供的iCal的神经刺激,而不是声刺激,声刺激简报列入允许确认空调效果仍然存在。在人力资源响应声刺激呈现生效的一般变化证实,声刺激条件的影响仍然存在,如在图11所示。同样, 图12给出了周围的声音交替在第一次测试会议开始时的平均心率比例变化。 图9和10,相对稳定的人力资源引入对比后在人力资源引进的第二个刺激的迅速变化中的第二个经济刺激前提供的证据表明,两个音之间的歧视发生。
相比之下,没有检测的情况下,可以看到在图13中电刺激开始。平均比例人力资源陈 GE在10个试验显示没有一致的迅速下降的迹象观察,检测时出现, 如图11。同样,在一致和快速变化的心率在图14的情况下,建议正在交付的两个电刺激是不够不同的歧视发生。既之前的交替时期的开始(0时前)和交替开始后,在人力资源的平均比例变化仍然接近线没有变化。
图15显示了一个模式特征的神经刺激对两个成员之间的歧视。出现心率下降迅速交替刺激开始后,随后在大幅增加心率。在这种情况下,使用特定的刺激策略是成功的生产行为有关的反应。
“SRC =”/ files/ftp_upload/3598/3598fig1.jpg“/>
图1。使用一个星期后植入植入遥测设备获得的心电图记录。在这个录音中看到的信号,主要是典型的利用这些设备的录音。

图2。心电图记录获得使用植入遥测装置植入后6个月。有超过这段时间内被记录的信号可以忽略不计的退化,这个信号肯定是足够的动物心率计算。

图3。一个成功的电极位置的三维重建,使用组合的X-射线计算机断层扫描和病理切片。这两个电极柄侵入电极澳凌posteroventral耳蜗核面对特德结构。

图4。地图与电极位置图3记录的电生理反应。每个直方图显示在介绍一个声频电极网站活动数据,每一列代表一个25毫秒时间。电极阵列的两个柄上,反应在每一个人只在很窄波段的频率响应电极网站被发现,但这些窄带分布跨越的频率范围。这样的分布是理想的,因为许多不同的频率相关的大脑区域可以刺激独立。

从图3&上午植入的电生理反应通道10 图5。P; 4。理想的情况下,电极存款,导致被检测到低至10分贝的声音振幅的几个渠道的声刺激的神经反应,在这个例子中出现。

图6。三维重建的一个贫穷的电极位置。虽然是正确的的电极caudorostral角度,这是太内侧。此外,电极未插入足够深,在最近的地点位于背侧耳蜗核内的电极尖端产生的。

图7。图记录电极放置在图6所示的电生理反应。活动是发生在每个电极阵列柄的技巧,但有声刺激小的变化频率频率,得出每个电极在现场的活动。这种植入不使刺激歧视的测试不同频率层。

在图6和图7所示的图8通道28日电电极上放置响应。声刺激产生强烈的阵阵活动,在穗的频率非常成功植入( 图3)中看到,类似。门槛也相当低,响应时间应在20分贝的音检测。如果有更大的跨越阵列中的其他渠道的强烈反应发生的频率变化,这个通道将肯定会有足够的刺激。
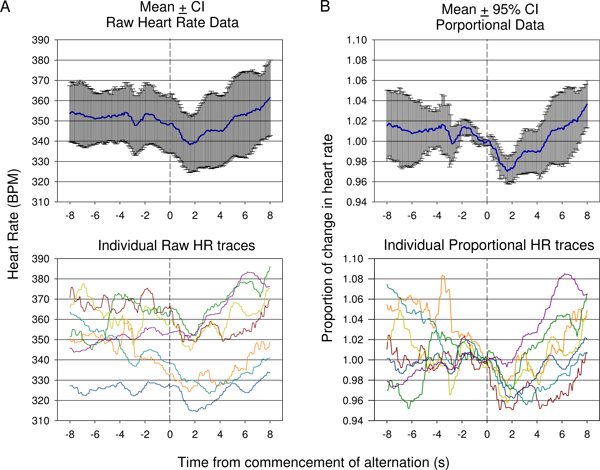
图9。原料心率比较(一)Verses平均比例(二)在一个动物的第一个空调会议期间收集的数据。 7演示的反应。因为在基调改变开始之前开始心率变化,意味着原材料心率(±95%置信区间),没有充分显示最初由上升心率下降程度的变化,表示在个别原料痕迹(一,底部)。 (二)平均心率心率,心率除以每个跟踪的空调声刺激呈现时间的数据的比例变化。这显示有统计学显着下降,反映使用95%置信区间,后期显着上升后,条件刺激呈现。个别比例心率痕迹(乙,底部)。
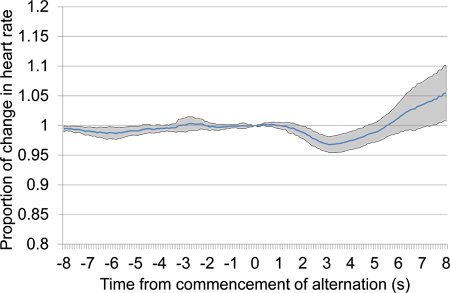
图10。平均比例心脏ŕ前8小号交替声刺激呈现,结合数据从第二和第三的空调会议开始后吃了8秒的变化。该数据包括七个试验,提出了两个空调会议上,四个第一的空调会议,并在第二个三。随后在年底增加心率发生在交替刺激演示,大降心率的初步回应。
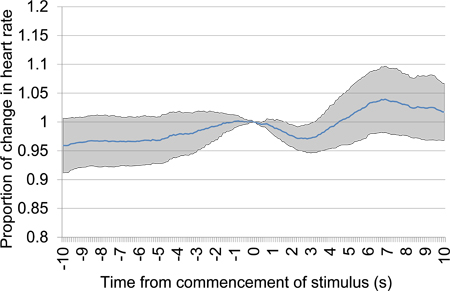
图11。平均比例心率声刺激呈现后30的沉默期开始后的变化,前10秒到10秒。试验数据从第一个测试会议,包括6个声刺激演示。早期心率下降提供一个明确的证据提出的声刺激之间的歧视。
es/ftp_upload/3598/3598fig12.jpg“/>
图12。平均比例心脏前8秒8小号交替刺激声介绍,从第一个测试会议,包括五个声刺激演示开始后的汇率变动。早期心率下降提供一个明确的证据提出的声刺激之间的歧视。
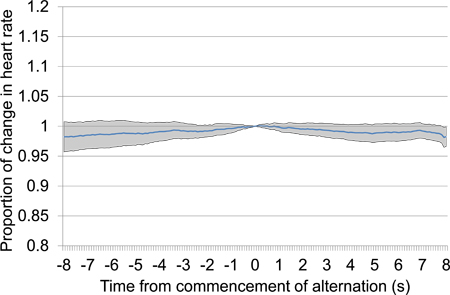
图13。平均比例心脏前从10秒至10小号30的沉默期后开始的电脑刺激后的汇率变动。试验数据,从第一次和第二次测试,包括18电刺激的介绍,所有使用相同的刺激设置。任何心率,尤其是近端时间0时开始刺激,特别是下降的情况下表明,动物是无法检测到的stimul我们。

图14。平均比例心脏前8秒8小号交替电刺激演示(参阅4.6.5和4.6.6),从第一个测试会议,其中包括33电刺激演示开始后的汇率变动。没有心率的变化相一致的格局发生不久的时间为0,这表明交替的刺激是不够不同的歧视发生。
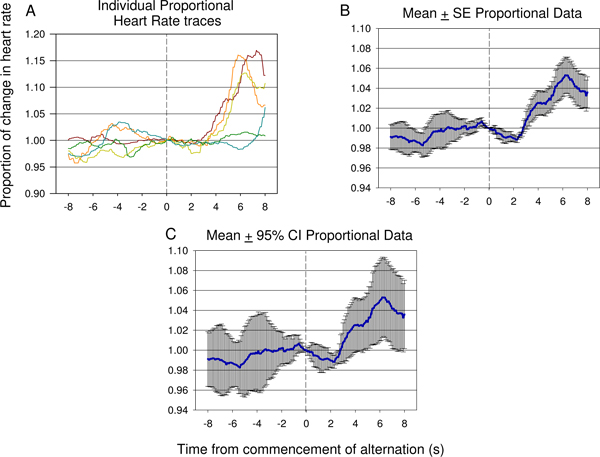
图15。代表性的例子,个别的痕迹(A)和平均比例心率数据(B,C),8秒前8后开始交替电刺激介绍,从第二个动物第七届测试会议,小号,包括12个电刺激演示。 H中的一个显着减少ŕ发生后迅速引进第二神经在心率显着上升的刺激,反映第一次和第二次刺激之间的差异已通过动物检测。错误和响应方差的程度可以看出,在比例平均值±标准误差(SE)(二)所示情节。第二刺激呈现后倾角和崛起的意义,可以使用95%的信心区间在(C)所示的数据验证。在(C)看到的反应是类似的反应,看到在图9 B。
Discussion
这里描述的技术为手段测试了一系列的歧视任务迅速,短期培训时间和大量的自动化,从而最大限度地减少研究人员进行数据处理所需的时间。使用植入心电图,计算心率(HR)在刺激呈现时间的变化,从获得的数据可以实现自动化。心电信号处理中的错误(如缺少一个单一的心拍)可以很容易地确定为它们产生大的变化,一个非常短暂的时期明显心率不合逻辑,这种简单的错误检测,最大限度地减少时间密集型的数据手册审查的要求。
心电图遥测装置植入中描述的技术不断产生很少或根本没有干扰的录音(参见图1和图2)。然而,在率先在纵隔区域的位置相对小的变化可能导致的干扰,从附近的肌肉和特定的呼吸相关的噪音。验证正确的位置,特别是缝合到位线索后,在植入过程中的线索,让领先位置的微调,以减少干扰。
大脑植入到耳蜗核的过程是困难的。通过使用带通滤波器的几个频率范围的噪音,而不是宽带噪声序列介绍,先前已使用3,可迅速审查电极位置的细胞群的反应,而在频率响应方面比少特定的噪音响应。能够迅速找出足够的频率调谐的细胞群访问时正在测试时,电刺激歧视的研究是至关重要的。如果得到足够的频率分布,然后比较不同频率的刺激之间是根本没有可能。然而,较长的过程频率幅度响应的映射仍然提供细节方面的调节细胞群的广度和固定在电极前应执行的关键。
在行为训练和测试,列入非刺激(或沉默)之间的试验期间,刺激发病前,允许初始刺激发病的响应进行审查。使用电神经刺激时,刺激发病的响应提供了刺激的简单检测的证据。因此,有没有刺激发病响应,但时引入第二交替刺激的反应时,它可以推断,只有后者的刺激可以检测。没有列入这样一个沉默的时间内,将有没有办法确定,前者刺激未检出。
这种行为检测技术的限制是没有脚的冲击交付后neura介绍升的刺激可能会导致发展的特殊性,在条件恐惧,这种恐惧声刺激时表示。也就是说,动物学习,特别是神经刺激的感官效果不接受足部电击。相比之下,提供神经刺激后在脚的冲击可能导致的神经刺激本身,从不同的神经刺激可能有任何声音,像空调的恐惧。不包括神经刺激后,脚休克时,得到的结果肯定神经刺激比使用脚休克,神经刺激后,在前者的情况下,空调的恐惧已普遍从声刺激神经的声音,像提供更有力的证据。然而,发展的特殊性,而不是神经刺激声的风险是存在的。使用带通过滤噪音声刺激,而不是纯音阵阵,其中前可以更好地反映神经刺激的知觉经验,可以减少风险的这种发展的特殊性。然而,这样一个过程,介绍了滤波器的频带宽度的额外的变数,这将影响歧视任务。
额外的限制,如行为测试所需,任何慢性神经植入相关的是,随着时间的推移电极或相关的神经组织的功能变化。刺激可导致神经组织都暂时抑制神经活动13和组织的变化,如细 胞损失14和直接的脑组织反应的电极15。
植入和行为测试所描述的方法提供了一种手段来测试用简短的培训,检测和声学和电刺激的歧视和能力发挥审判频率控制。作为测量电在人力资源变化的技术空调恐惧E可能是适用的,不仅听觉测试,但更普遍地刺激可以提交任何离散时期,并在其中检测感官歧视的需要任何感官检验。
Disclosures
安东尼奥·保利尼是博士Bioengenesis科技控股有限公司是澳大利亚的,塔克戴维斯技术和NeuroNexus探头澳大利亚经销商的代表董事。
Acknowledgments
加内特传球和罗德尼·威廉斯纪念基金会和La Trobe大学的这项研究提供了资金。
Materials
| Name | Company | Catalog Number | Comments |
| PowerLab |  ADInstruments ADInstruments |
ML880 | Records data received from the implanted TR40 transmitter |
| SmartCtrl controller card | Med Associates, Inc. | DIG-716B | Controls the behavioral test chamber, including foot shock |
| Modular behavioral test chamber | Med Associates, Inc. | ENV-009 | Test chamber size: 30.5cm x 39.4cm |
| Aversive stimulus generator | Med Associates, Inc. | ENV-410B | Delivers aversive foot-shock to metal-bar floor of the cage through a Solid State Scrambler unit |
| Programmable Attenuator | TDT | PA5 | Controls the amplitude of delivered acoustic signal to ensure stable amplitude across frequencies |
| Electrostatic speaker driver | TDT | ED1 | Drives the electrostatic speakers (EC1, ES1) |
| Free-field electrostatic speaker | TDT | ES1 | Sounds are presented using this speaker in the behavioral test chamber |
| Coupled electrostatic speaker | TDT | EC1 | Sounds are presented using this speaker during neural implant surgery |
| Stimulator Base Station | TDT | RX7 | Controls delivery of electrical neural stimulation (used with MS16) |
| Microstimulator | TDT | MS16 | Delivers multichannel electrical neural stimulation |
| Processing base station | TDT | RZ2 | Records neural activity during brain implantation (using PZ2 preamplifier) |
| Preamplifier | TDT | PZ2-256 | 256-channel high impedance preamplifier |
| Telemetry device receiver | Telemetry Research | TR162 | Receives digital signal from TR40, and converts to amplified analogue output |
| Implantable electrocardiogram telemetry device | Telemetry Research | TR40 | The implanted transmitter device, sampling at 2kHz |
| Multifunction Processor | Tucker-Davis Technologies | RX6 | Used to generate acoustic stimuli |
| Vertex Castavaria | Vertex Dental | Dental acrylic used to fix the electrode in place | |
| Kwik-Sil Adhesive, low viscosity | World Precision Instruments, Inc. | Silicon elastomer used to coat the electrode shanks | |
| Multichannel electrode | NeuroNexus Technologies | a2x16-10mm 100-500-413 | The 2-shank 32-channel extracellular electrode array used for implantation. The electrode sites have been activated to produce a coating of iridium oxide in preparation for stimulation. |
References
- Mauger, S. J., Shivdasani, M. N., Rathbone, G. D., Argent, R. E., Paolini, A. G. An in vivo investigation of first spike latencies in the inferior colliculus in response to multichannel penetrating auditory brainstem implant stimulation. Journal of Neural Engineering. 7, 036004-036004 (2010).
- Shivdasani, M. N., Mauger, S. J., Argent, R. E., Rathbone, G. D., Paolini, A. G. Inferior colliculus responses to dual-site intralamina stimulation in the ventral cochlear nucleus. J. Comp. Neurol. 518, 4226-4242 (2010).
- Shivdasani, M. N., Mauger, S. J., Rathbone, G. D., Paolini, A. G. Inferior colliculus responses to multichannel microstimulation of the ventral cochlear nucleus: Implications for auditory brain stem implants. Journal of Neurophysiology. 99, 1-13 (2007).
- Lenarz, M., Lim, H. H., Patrick, J. F., Anderson, D. J., Lenarz, T. Electrophysiological Validation of a Human Prototype Auditory Midbrain Implant in a Guinea Pig Model. JARO. 7, 383-398 (2006).
- Lim, H. H. Auditory Cortical Responses to Electrical Stimulation of the Inferior Colliculus: Implications for an Auditory Midbrain Implant. Journal of Neurophysiology. 96, 975-988 (2006).
- Otto, K. J., Rousche, P. J., Kipke, D. R. Microstimulation in auditory cortex provides a substrate for detailed behaviors. Hearing research. 210, 112-117 (2005).
- Gai, Y. Detection of Tones in Reproducible Noise Maskers by Rabbits and Comparison to Detection by Humans. JARO. 8, 522-538 (2007).
- Miller, C. A., Woodruff, K. E., Pfingst, B. E. Functional responses from guinea pigs with cochlear implants. I. Electrophysiological and psychophysical measures. Hearing Research. 92, 85-99 (1995).
- Beitel, R. E., Vollmer, M., Snyder, R. L., Schreiner, C. E., Leake, P. A. Behavioral and neurophysiological thresholds for electrical cochlear stimulation in the deaf cat. Audiology & Neurotology. 5, 31-38 (2000).
- Beitel, R. E., Snyder, R. L., Schreiner, C. E., Raggio, M. W., Leake, P. A. Electrical cochlear stimulation in the deaf cat: comparisons between psychophysical and central auditory neuronal thresholds. J. Neurophysiol. 83, 2145-2162 (2000).
- Vollmer, M., Beitel, R. E., Snyder, R. L. Auditory detection and discrimination in deaf cats: Psychophysical and neural thresholds for intracochlear electrical signals. Journal of Neurophysiology. 86, 2330-2343 (2001).
- LeDoux, J. E., Cicchetti, P., Xagoraris, A., Romanski, L. M. The lateral amygdaloid nucleus: sensory interface of the amygdala in fear conditioning. Journal of Neuroscience. 10, 1062-1069 (1990).
- McCreery, D. B., Yuen, T. G., Agnew, W. F., Bullara, L. A. A characterization of the effects on neuronal excitability due to prolonged microstimulation with chronically implanted microelectrodes. IEEE Transactions on Biomedical Engineering. 44, 931-939 (1997).
- Liu, X., McPhee, G., Seldon, H. L., Clark, G. M. Histological and physiological effects of the central auditory prosthesis: surface versus penetrating electrodes. Hearing Research. 114, 264-274 (1997).
- Polikov, V. S., Tresco, P. A., Reichert, W. M. Response of brain tissue to chronically implanted neural electrodes. Journal of Neuroscience Methods. 148, 1-18 (2005).



