Summary
Anvendelsen af en klassisk angst konditionering adfærdsmæssige paradigme for auditiv protese forskning i rotter er beskrevet. Dette paradigme indeholder en mekanisme til at identificere både påvisning af, og forskelsbehandling, som adskiller sig akustiske og elektriske stimuli ved hjælp af hjerte-rate som et resultat foranstaltning.
Abstract
Akutte dyr præparater er blevet anvendt i forskning prospektivt undersøge elektrodeudformninger og stimulering teknikker til integration i neurale auditive proteser, såsom Auditory Brainstem implantater 1-3 og auditive midterhjernedopaminerge implantater 4,5. Mens akutte forsøg kan give første indsigt i virkningen af implantatet, teste kronisk implanterede og vågen dyr tilvejebringer den fordel, at undersøge psykofysiske egenskaber fornemmelser induceret ved hjælp af implanterede anordninger 6,7.
Adskillige teknikker, såsom belønning baseret operant betingning 6-8, betinget undvigelsesrefleks 9-11, eller klassisk angst konditionering 12 er blevet anvendt til at tilvejebringe adfærdsmæssige bekræftelse af detektion af en relevant stimulus egenskab. Valg af en teknik involverer balancering aspekter, herunder tidseffektivitet (ofte fattige i belønning tilgange), mulighed for at teste en flerhed afstimulus tilskriver samtidigt (begrænset i betinget undgåelse), og måle pålideligheden af gentagne stimuli (en potentiel begrænsning, når fysiologiske foranstaltninger er ansat).
Her er en klassisk angst konditionering adfærdsmæssige fremgangsmåde præsenteres som kan anvendes til samtidigt at teste både påvisning af en stimulus, og diskriminering mellem to stimuli. Heart-rate bruges som et mål af frygt reaktion, som reducerer eller eliminerer behovet for tidskrævende video koder for freeze adfærd eller andre sådanne foranstaltninger (selv om sådanne foranstaltninger kan medtages for at give samstemmende beviser). Dyrene blev konditioneret ved hjælp af disse teknikker i tre 2-timers conditioning sessioner, der hver giver 48 vækstpakker forsøg. Efterfølgende 48-afprøvning sessioner blev derefter anvendt til at teste for påvisning af hver stimulus i præsenteret parvis, og test forskelsbehandling mellem medlemslandene stimuli af hvert par.
Denne adfærdsmæssige fremgangsmåde er præsenteret ifor rammerne af sin anvendelse i auditiv protese forskning. Implantation af elektrokardiogram telemetri indretninger er vist. Efterfølgende implantation af hjernen elektroder ind i Cochlear Nucleus, styret af overvågning af neurale reaktioner på akustiske stimuli, og fiksering af elektroden på plads til kronisk brug er ligeledes vist.
Protocol
1. Elektrokardiogram telemetrianordningen Implantation
- En time forud for implantering påbegyndelse, administrere Carprofen (4 mg / kg sc) for at tilvejebringe post-operativ smertelindring.
- Injicér Ketamin / xylazin (Ke: 70 mg / kg, XY: 10 mg / kg, ip) for anæstesi at muliggøre den første dyr, forberedelse, herunder barbering og indsætte øre barer, før du skifter til Isofluran anæstesi, som er mere stabil under en operation muliggør en bedre regulering af dybde og forkorter efter kirurgi genvinding fra anæstesi.
- På anæstesi debut, gælder øjet smøremiddel til dyrets øjne, og derefter barbere maven brystkassen, og hals. Tør eksponeret hud ved hjælp af kirurgisk skrubning, efterfulgt af alkoholisk huden præparat, efterfulgt af antiseptisk opløsning. Placer hjem bur på et varme tæppe til at varme.
- Sende dyret i rygleje på en homøoterme plade. Sæt vat under nakken til at løfte og udsætter halsen.
- Placer næse-samarbejdetne (levere 1-3% vol / vol Isofluran i oxygen, 2 L per minut) over næsen af dyret og fiksere keglen på plads.
- Fastsætte forende lemmer i en semi-udstrakt stilling til at generere huden spænding over brystkassen og hals, og for at forhindre næsen glider fri af næse-keglen.
- Indsætte sonden i homøoterme tæppet ind i endetarmen i dyret.
- Gøre en midtlinie-incision i huden som strækker sig fra formet som et sværd processen 20 mm caudalt at blotlægge muskellag. Foretag en matchende snit langs linea alba, og derefter det peritoneale hulrum.
- Indsæt EKG telemetrianordningen i den peritoneale kavitet med ledninger strækker sig fra den rostrale ende af åbningen, og suturere den caudale 15 mm af åbningen i peritoneum.
- Lav en midtliniesnit i halsen overliggende luftrøret, udsætte sternohyoid musklen.
- Indsætte krokodillenæb øre pincet i det subkutane rum rostral indsnit vendende caudalt, og anvende disse til dannelse af en subkutantaneous tunnel fra rostral til kaudal incision. Grip den positive (røde) bly i tang og træk føringen gennem tunnelen.
- Løfte sternohyoid musklen med pincet og spidsen af den positive ledning dorsalt mod højre forreste mediastinum, hvilket efterlader omkring en 1 mm sløjfe af kabel rostral til indsættelse. Suturere ledningen, hvor den strækker sig fra brysthulen og ved toppen af løkken til den underliggende muskel.
- Udsætte den dorsale væg formet som et sværd, og suturen spidsen af den negative ledning den eksponerede overflade.
- Se den implanterede indretning signal for at sikre en tilstrækkelig EKG kan opnås.
- Foder overskydende kabel ind i bughulen. Sutur lukket bugvæggen, linea alba, og den abdominale hud.
- Sutur lukket hud af halsen.
- Ophøre med levering af Isofluran, og fortsætte med at levere ilt, indtil spontan bevægelse der observeres.
- Når bevægelsen er observeret, slipper forbens end sende dyret tilbage til sit hjem bur. Bevæge hjembur, således at omtrent halvdelen af buret er på varmepude. Dette vil tillade dyret, når mobil til at bevæge sig mellem varmere og koldere områder af buret. Overvåg dyret indtil ambulant, og forlade hjemmet bur på den varme tæppe for 24 timer.
- Administrere Carprofen (4 mg / kg sc) hver 24 timer i 3-5 dage.
2. Brain Elektrode Implant
- En time før implantation påbegyndelse, administrere Carprofen (4 mg / kg sc) for postoperativ analgesi.
- Injicere Ketamin / Xylazin (Ke: 70 mg / kg, XY: 10 mg / kg, ip) til anæstesi.
- På anæstesi debut, gælder øjensalve til at beskytte øjnene, så barbere hovedet af dyret. Tør eksponeret hud med Betadine krat, efterfulgt af alkohol, efterfulgt af betadin.
- Placere dyret i den liggende stilling på en homøoterme plade.
- Placer en hul øre bar i ca den forventede endelige position,og løfte og placere dyret, så øret bar er placeret i de ydre øregang.
- Skub den anden hule øret bar i den kontralaterale ydre øregang.
- Anvendelse af rotte-tand pincet, dyrets kæbe åbne og krogen de øvre fortænder over tanden holderen.
- Skubbe næse-keglen over næsen, og påbegynde levering af isofluran (1-3% vol / vol i oxygen). Dyrene nu opretholdes under hele operationen med denne bedøvelse.
- Lave et snit i huden på hovedet, cirka 1 mm til venstre for midterlinien og strækker sig fra 3-4 mm rostralt for 2-3 mm caudalt i lambda.
- Trække huden og musklen sideværts fra indsnittet, og udsætter parietal knogle og interparietal knoglen. Skrubbe overfladen af den eksponerede knoglen under anvendelse af 20% hydrogenperoxidopløsning og en gazepude.
- Bore et lille hul i den venstre og højre parietale knogler, og skrue en kirurgisk stålskrue i hvert hul efterlader et lille (0,5 mm) mellemrum mellem HEAd af hver skrue og dygtighed. Forbind disse skruer til jorden og reference elektrode punkter af høj-impedans hovedtrin.
- Bore et hul omtrent 2 mm kvadrat i lateral mest omfang interpariental knoglen. Skyl hullet med sterilt saltvand for at fjerne enhver knogle støv eller knoglefragmenter, som kan beskadige elektroden.
- Fastgør kobling højttaleren til venstre hule øre bar.
- Under anvendelse af spidsen af en nål, et snit gør i dura på sagittalplanet.
- Bringe elektroden manipulatoren på plads over åbningen med en caudorostral vinkel på 10 °. Indsætte elektroden manuelt omkring 2 mm ind i overfladen af hjernen. Sikre forstærkeren er tændt, og derefter forsegle optagelsen kammeret.
- Begynd cyklisk levering af lav (2-8 kHz), mid-range (16-24 kHz) og høj (32 kHz-44 kHz) frekvensbåndet-pass filtreret støj. Den maksimale hastighed, hvormed brister skal leveres, er en burst hver 200 ms. Overvåg neurale aktivitet ent hver kanal at detektere responser over for støj præsentation.
- Fortsætte indføringen af elektroden indtil enten total indsat afstand nærmer 8 mm. Hvis 8 mm grænsen er nået, uden at neurale reaktioner at blive opdaget, hæve og flytte elektroden for en anden indsættelse. Hvis den cochleare nucleus (CN) er nået, skal steder ved enden af elektroden blive udført reaktioner primært højfrekvente stimuli. Hvis elektroderne er placeret i den ventrale cochleare nucleus (VCN), reaktioner på akustisk stimulus, bør have en stærk indtræden komponent (1-5 ms), efterfulgt af et hurtigt fald i aktivitet.
- Fortsæt med at indsætte elektroden, indtil spidsen af elektroden finde svar på lav frekvens stimuli, eller auditive-drevet aktivitet ophører med at forekomme (i hvilket tilfælde, kan elektroden er gået helt igennem CN, og det kan være nødvendigt at revidere elektroden placering).
- Konstruere en frekvens-amplitude respons kort over neuronerne ved elektrode sITES. Dette opnås ved præsenteres lyd over det ønskede frekvensområde (typisk 1-44 kHz eller 1-80 kHz) ved amplituder 1-70 dB, med 10 gentagelser af hver stimulus. Et stimulus kan leveres hver 300 ms ved kortlægning af KN. Hvis kortet er utilstrækkelig, overveje at revidere placeringen af elektroden.
- Et tyndt lag af siliciumdioxid elastomer lidt over de blottede elektrodeområde skafterne, således at elastomeren vil strømme ned skafterne og overtrække både skafterne og den blottede overflade af hjernen.
- Anvende et første lag af tandprotesen cement polymere omkring elektroden. Cementen skal være minimalt viskos, for at reducere risikoen for elektroden bevæges i processen anvendelse. Sørg for, at polymeren ikke dækker skruerne i den parietale knogler eller de vedlagte kabler. Vente på acryl at hærde, hvilket typisk tager 5-10 minutter.
- Tag jorden og reference ledninger af hovedtrin fra skruerne i de parietale knogler. Ved hjælp af pincetter, gstændigt baggrund jordledningen af elektroden omkring skruen i den venstre parietal knogle.
- Påfør et andet lag af protese cement polymer. Dette andet lag bør indkapsle begge skruer, og strømme ind i rummet mellem skruehovedet og kraniet. Derved vil skruerne holde acryl-og elektroden til kraniet. Vente på acryl at hærde.
- Fjerne hovedtrin fra elektroden konnektoren.
- Ved hjælp af rotte tand pincet huden lateralt i forhold til polymeren i løbet af polymeren løfte og anvende en pung-streng sutur for at lukke huden omkring den blotlagte elektrode konnektoren.
- Fjern øre barer, frigiver hovedet.
- End levering af isofluran, og fortsætte med at levere oxygen gennem næsekeglen indtil spontan bevægelse observeres.
- Sende dyret til hjembur. Bevæge hjembur, således at omtrent halvdelen af buret er på varmepude. Dette vil tillade dyret, når mobil til at bevæge sig mellem varmere og koldere områder afbur.
- Overvåg dyret indtil ambulant. Lade hjembur på varmepude i 24 timer.
- Administrere Carprofen (4 mg / kg sc) hver 24 timer i 3-5 dage.
3. Conditioning
- Placere dyret i testkammeret.
- Aktivere EKG telemetrianordningen.
- Tillade dyret at akklimatisere til testkammeret i fem minutter før påbegyndelse af konditionering. Dette vil tillade puls til at vende tilbage til en baseline, som håndtering fører til hjertefrekvens højde.
- Udfør konditionering procedure:
- Lever en tilfældigt udvalgt medlem af den akustiske stimulus par gange i 250 ms udbrud adskilt af 250 ms stilhed for 80-170 s. Hver stimulus præsentation skal have en stigning og fald tid på 10 ms for at undgå et 'klik' bliver opfattet, som perceptuelt dækker en række af lydfrekvenser.
- Påbegynde skiftevis det andet medlem af den akustiske stimulus parret med den første, der viser each tonen for 250 ms efterfulgt af en 250 ms stilhed.
- Efter 9,5 s fra 10 s periode skiftevis tone præsentation, administration af en 0,5 ms mund-chok (0,7 mA).
- Ophøre tone præsentationer i 30 s at tillade puls til at stabilisere sig.
- Påbegynde tone par levering (fra 3.4.1). Tone par optimalt bør præsenteres i en tilfældig rækkefølge, og mindst 12 tone par bør anvendes til at sikre, at condition generaliserer til alle frekvenser par og er ikke specifikke for tone anvendte frekvenser. Fortsæt denne proces, indtil 48 cykler af proceduren (forsøg) er afsluttet.
- Deaktiver EKG enheden, og sende dyret tilbage til hjemmet bur.
4. Test
- Anesthetise dyret ved hjælp af isofluran (1-3% vol / vol i oxygen).
- Fastgør neurale stimulation kabel til udsatte elektroden stikket.
- Placere dyret i testkammeret.
- Aktiver EKG telemetrianordningen. </ Li>
- Lad dyret for at tilbagesøge den Isofluran anæstesi og vænnes til testkammeret i ti minutter før påbegyndelse af testen. Dette vil tillade puls til at vende tilbage til en baseline og genrejsning efter den korte bedøvende effekt.
- Udføre testprocedure.
- Lever en tilfældigt udvalgt medlem af en akustisk stimulus par gange i 250 ms udbrud adskilt af 250 ms stilhed for 80-170S. Hver stimulus præsentation skal have en stigning og fald tid på 10 ms for at undgå et 'klik' bliver opfattet, som perceptuelt dækker en række af lydfrekvenser.
- Påbegynde skiftevis det andet medlem af den akustiske stimulus parret med den første, der viser hver tone til 250 ms, efterfulgt af 250 ms af stilhed.
- Efter 9,5 s fra 10 s periode skiftevis tone præsentation, administration af en 0,5 ms mund-chok.
- Ophøre tone præsentationer i 30 s at tillade puls til at stabilisere sig.
- Påbegynde levering af et tilfældigt selected medlem af en elektrisk hjernestimulation par gange under anvendelse af 250 ms perioder stimulering adskilt af 250 ms af ikke-stimulering for 80-170 sek.
- Påbegynde skiftevis det andet medlem af stimulus parret med den første, der viser hver stimulus for 250 ms, efterfulgt af en 250 ms ikke-stimulering periode. Fortsætter alternerende stimulering i 10 sek.
- Hold op med stimuli præsentationer i 30 s at tillade puls til at stabilisere sig.
- Påbegynde stimulus par levering (fra 4.6.5 eller 4.6.1). Stimulus par bør præsenteres i en tilfældig rækkefølge, og mindst 20 forsøg med hver stimulus par skal afleveres for at sikre tilstrækkelige hjerte-rate data indsamles at give en klar gennemsnitlige resultat og minimere variabilitet. Distribuerer forsøg med akustiske stimuli hele testsession reducerer sandsynligheden for, at udryddelse vil forekomme under proceduren.
- Frigør stimulering kablet fra dyret.
- Deaktiver EKG DEVIce.
- Sende dyret til hjembur.
5. Repræsentative resultater
En prøve EKG taget ved anvendelse af implanterede telemetrianordningen en uge efter implantation er vist i fig 1. En sådan optagelse kan typisk opnås fra implanterede anordninger, og indretningerne fortsætte med at fungere tilfredsstillende til registrering af ud over seks måneder, selv om opløselige sutur anvendes til at anbringe kabler til muskel. EKG'et optagelse vist i figur 2 blev opnået fra et dyr over otte måneder efter implantation.
Figur 3 viser placeringen af en vellykket implantering. Elektroden placering har mange elektrode steder i posteroventral cochlear kerne (PVCN), der giver stimulering og optagelse adgang til en stor del af dorsoventral aspekt. Frekvens-responser i hver elektrode sted for denne implantation er vist i figur 4. Den lange område af PVCN hvori elektroderne er fordelt fører til cellepopulationer tilgængelige til optagelse og stimulering "tunet" til et bredt område af frekvenser. Desuden er de befolkningerne selv snævert tunet - de reagerer kun på et smalt bånd af lydfrekvenser (se figur 5).
I modsætning hertil er en dårlig placering er vist i figur 6. I dette tilfælde, blev elektroden placeres for medialt, og ikke indsat tilstrækkeligt dybt at trænge ind i PVCN. Som en konsekvens, at kun elektrodestederne nær spidsen viser responser lyde, som vist i figur 7. Desuden er det frekvensområde, som er tilgængelige cellepopulationer er tunet meget begrænset. Indstillingen af populationerne selv er snæver (se figur 8), men klynger fordelingen af de centrale frekvenser af cellepopulationer gør stimulere forskellige frekvensområder umulig.
_content "> Baseline pulsdata varierede mellem betingede akustiske stimulus præsentationer. tage højde for denne variation, blev rå hjertefrekvens (HR) data normaliseret som en andel af HR observeret, når stimulus vekslen påbegyndt (tid 0). Figur 9 viser data i forskellige former indsamlet under den første condition session. Et eksempel på HR opnåede resultater i et andet dyr i den sidste del af de indledende conditioning sessioner er præsenteret i figur 10. Den crimpningsproces til akustiske stimuli er hurtig, og stærke ændringer i HR kan observeres med få forsøg. 7 i tilfælde af figur 9 og 10 Ændringen i HR observeret umiddelbart efter påbegyndelsen af stimulus alternerende (se 3.4.1 og 3.4.2) beviser, at dyret er i stand til at skelne mellem gentaget oprindelige stimulus og den anden stimulus tilsættes efterfølgende.Efter begynder testsessioner, hvor strømriske neurale stimuli snarere end akustiske stimuli kan typisk leveres, inddragelse af akustiske stimulus præsentationer giver bekræftelse på, at conditioning virkninger er stadig til stede. En generel ændring i HR som reaktion på påbegyndelsen af akustisk stimulus præsentation bekræfter, at et konditioneret virkning akustiske stimuli er til stede, som vist i figur 11. Tilsvarende Figur 12 viser den gennemsnitlige HR proportional ændring omkring begyndelsen af akustiske tone skiftevis den første testsession. Som med fig 9 og 10 tilvejebringer en relativt stabil HR før indføring af den anden stimulus i modsætning til den hurtige ændring i HR efter indførelsen af den anden stimulus bevis for, at diskriminering mellem de to toner har fundet sted.
I modsætning hertil kan fraværet af detektion ses i figur 13, hvor elektrisk stimulation påbegyndes. Den gennemsnitlige proportional HR Chan ge i 10 forsøg viser ingen tegn på fast hurtige fald iagttages, når påvisning sker som i figur 11.. Tilsvarende fraværet af en konsistent og hurtige ændringer i hjertefrekvens i figur 14 viser, at de to elektriske stimuli blev leveret ikke er tilstrækkeligt forskellige til diskriminering at forekomme. Både forud for påbegyndelsen af den vekslende periode (før tid 0), og efter vekslen begynder, den gennemsnitlige proportional ændring i HR forbliver tæt på den linje, ingen ændring.
Et mønster mere karakteristisk for forskelsbehandling mellem de to medlemmer af et neuralt stimulus par er vist i figur 15. Et fald i hjertefrekvens forekommer hurtigt efter påbegyndelsen af stimulus vekslen af en betydelig stigning i hjertefrekvens følges. Den særlige stimulering anvendte strategi i dette tilfælde var vellykket til at frembringe en adfærdsmæssig relevant respons.
"Src =" / files/ftp_upload/3598/3598fig1.jpg "/>
Figur 1. En EKG opnået ved anvendelse af implanterede telemetrianordningen en uge efter implantation. Signalet ses på denne optagelse er i høj grad typisk for de optagelser der er opnået ved hjælp af disse enheder.

Figur 2. En EKG opnået ved anvendelse af implanterede telemetrianordningen seks måneder efter implantation. Der er ubetydelig forringelse af signalet, der optages i løbet af denne periode, og dette signal er bestemt tilstrækkelig til beregning af dyret hjertefrekvensen.

Figur 3. Et 3D rekonstruktion af en vellykket elektrodeplacering under anvendelse kombineret røntgen CT og histologiske snit. Begge elektrode skafter gennemtrængt posteroventral cochleare nucleus med elektroder orienTED til ansigt strukturen.

Figur 4. Kortet over elektrofysiologiske responser optaget med elektroden placering af figur 3. Hvert histogram viser data for aktivitet på en elektrode sted som svar på præsentationen af en akustisk frekvens, hver kolonne repræsenterer en 25 ms periode. På begge skafter af elektrodesæt, der responser detekteres ved hver enkelt elektrode sted kun som svar på en ganske smalt bånd af frekvenser, men disse smalle bånd er fordelt over et bredt område af frekvenser. En sådan fordeling er ideelt, da mange forskellige frekvens-associerede regioner af hjernen kan stimuleres uafhængigt.

Figur 5. Den elektrofysiologiske respons på kanal 10 fra implantatet vist i figur 3 og erp; 4. Ideelt set bør elektrode placeringer føre til neurale svar på akustiske stimulus blive opdaget på flere kanaler med lyd amplitude så lavt som 10 dB, som vises i dette eksempel.

Figur 6. En 3D-rekonstruktion af en dårlig elektrodeplacering. Mens caudorostral vinkel af elektroden var korrekt, var det for mediale. Endvidere blev elektroden ikke sat tilstrækkelig dyb, resulterer det i sites nærmest spidsen af elektroden er placeret inden i dorsale cochleare nucleus.

Figur 7. Kortet over elektrofysiologiske responser optaget med elektroden placering som vist i figur 6. Aktivitet forekommer ved spidserne af hver skaft elektrodesættet, men der er en lille variation i den akustiske stimulus frefrekvens, der fremkalder aktivitet ved hver elektrode sted. En sådan implantation ikke giver stimulation af forskellig frekvens lag for diskrimination test.

Figur 8. Den elektrofysiologiske respons på kanal 28 på elektroden placeringen vist i figur 6 og 7. Akustisk stimulus frembringe stærke bursts af aktivitet og lignende i piggen frekvens, der ses i meget vellykket implantation (figur 3). Threshold er også meget lav, med svar at blive opdaget som reaktion på toner ved 20 dB. Hvis der var en større variation i de frekvenser som de stærkeste reaktion forekom på tværs af andre kanaler i arrayet denne kanal helt sikkert være tilstrækkelig til stimulering.
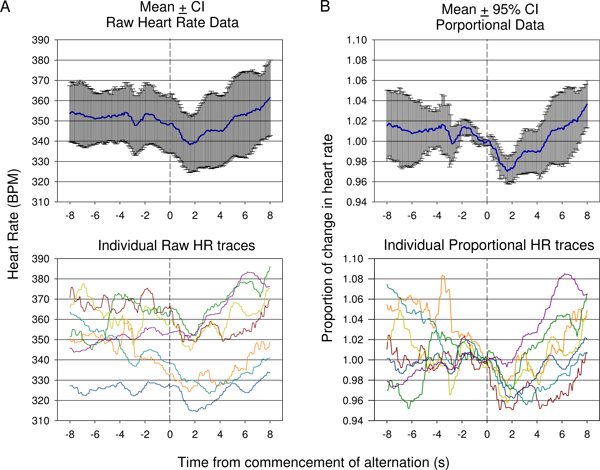
Figur 9. Sammenligning af rå puls (A) verses betyder proportionale (B) data der er indsamlet under den første condition session i et dyr. Svar fra 7 præsentationer er vist. På grund af variationen i at starte hjertefrekvens forud for påbegyndelsen af tonen ændring, betyder rå puls (± 95% konfidensintervaller) ikke i tilstrækkelig grad viser graden af ændring af en indledende fald i hjertefrekvens efterfulgt af stigning, som angivet i de enkelte rå spor (A, nederst). Betyder proportional ændring i hjertefrekvens data, hvor hjertefrekvensen er opdelt af hjertefrekvensen på tidspunktet for konditioneret akustisk stimulus præsentation for hvert spor er vist i (B). Det viser en statistisk signifikant fald efter betinget stimulus præsentation med en sen betydelig stigning afspejles ved hjælp af 95% konfidensintervaller. Individuelle proportionale puls spor er vist (B, nederst).
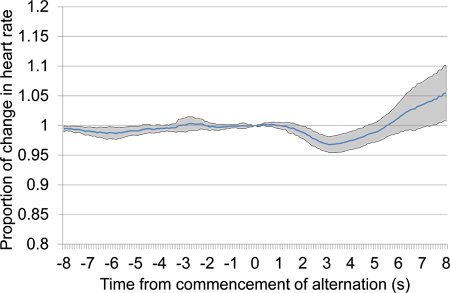
Figur 10. Gennemsnitlige proportional hjerte r spiste ændring fra 8 s før til 8 sekunder efter påbegyndelse af skiftevis akustiske stimulus præsentation, der kombinerer data fra andet og tredje conditioning sessioner. De præsenterede data omfatter syv forsøg, der præsenteres i løbet af de to conditioning sessioner, fire i den første condition session og tre i den anden. Som reaktion på skiftende stimulus præsentation en stor initial fald i hjertefrekvens indtrådte efterfulgt af en forsinket stigning i hjertefrekvens.
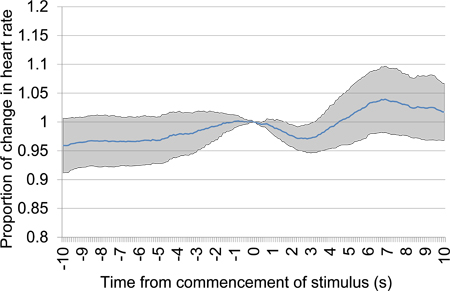
Figur 11. Gennemsnitlige proportional puls ændring fra 10 s før 10 sekunder efter påbegyndelsen af akustiske stimulus præsentation efter en 30 stilhed periode. Forsøgsdata blev taget fra den første test session og omfatter seks akustiske stimulus præsentationer. En klar tidligt fald i hjertefrekvens giver beviser på forskelsbehandling mellem de akustiske præsenterede stimuli.
es/ftp_upload/3598/3598fig12.jpg "/>
Figur 12. Gennemsnitlige proportional puls ændring fra 8 s før til 8 sekunder efter påbegyndelse af skiftevis akustiske stimulus præsentation, taget fra den første test session og med fem akustiske stimulus præsentationer. En klar tidligt fald i hjertefrekvens giver beviser på forskelsbehandling mellem de akustiske præsenterede stimuli.
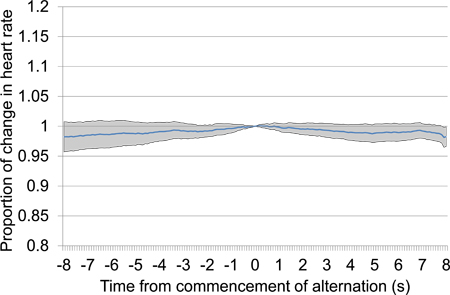
Figur 13. Gennemsnitlige proportional puls ændring fra 10 s før 10 s efter påbegyndelsen af elektrisk hjernestimulation efter en 30 stilhed periode. Forsøgsdata blev taget fra den første og anden test sessioner og indeholder 18 elektrisk stimulering præsentationer, der alle bruger samme stimulerende indstillinger. Fraværet af nogen bestemt fald i hjertefrekvens, især proximalt til tid 0, hvor stimulation påbegyndes, tyder på, at dyret er i stand til at detektere stimulos.

Figur 14. Gennemsnitlige proportional puls ændring fra 8 s før til 8 sekunder efter påbegyndelse af vekslende elektrisk stimulus præsentation (se 4.6.5 og 4.6.6), taget fra den første test session og med 33 elektrisk påvirkning præsentationer. Ingen konsistent mønster af ændringer i hjertefrekvensen opstår i nærheden tid 0, hvilket tyder på, at de skiftende stimuli ikke er tilstrækkeligt anderledes for forskelsbehandling sted.
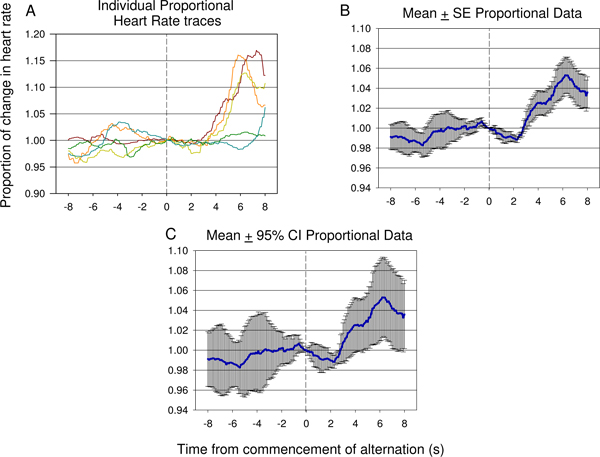
Figur 15. Repræsentative eksempler på individuelle spor (A) og gennemsnitlig proportionale pulsdata (B, C) fra 8 er inden for 8 sekunder efter påbegyndelsen af alternerende elektrisk stimulus præsentation, taget fra den syvende testsession et andet dyr, og herunder 12 elektrisk påvirkning præsentationer. Et signifikant fald i HR forekommer hurtigt efter indførelsen af det andet neurale stimulus efterfulgt af en betydelig stigning i hjertefrekvens afspejlede antyder forskellen mellem den første og den anden stimulus er blevet detekteret af dyret. Graden af fejl og varians af reaktionen kan ses i den proportionale middelværdien ± standardafvigelse (SE) plot er vist i (B). Betydningen af dypningen og stigningen efter den anden stimulus præsentation kan kontrolleres ved hjælp af 95% konfidensintervaller anvendt på de data der er vist i (C). Den reaktion, der ses i (C) svarer til reaktionen se i figur 9 B.
Discussion
De teknikker der er beskrevet her, tilvejebringer et middel til at teste en række diskrimination opgaver hurtigt med korte træning gange og muliggør væsentlig automatisering, hvilket minimerer forsker nødvendige tid til databehandling. Ved hjælp af data fra den implanterede EKG, beregning af hjerte-rate (HR) ændring i tider med stimulus præsentation kan automatiseres. Fejl i EKG behandling (såsom glip af en eneste hjerte-beat), let kan identificeres, da de producerer spuriously store ændringer i tilsyneladende hjerte-sats for en meget kort periode, og så let fejlfinding minimerer behovet for tidskrævende manuel indtastning af data review .
Den beskrevne teknik til implantering af EKG telemetrianordningen faste frembringer optagelser med ringe eller ingen interferens (se figur 1 og 2). Dog kan relativt små variationer i placeringen af bly i mediastinum regionen føre til interferens fra nærliggende musklers og især respiration-associeret støj. Kontrol af korrekt placering af ledningerne under implantation processen, især efter suturering ledninger på plads, giver mulighed for fine justeringer af bly placering for at minimere interferens.
Processen af hjernen implantation i den cochleare nucleus er vanskelig. Ved anvendelse af serielle præsentationer af båndpasfiltrerede støj flere frekvensområder, snarere end bredbåndet støj, som tidligere er blevet anvendt tre, kan reaktioner cellepopulationer ved elektrode steder hurtigt revideret med hensyn til frekvens-respons end de mindre specifikke støj reaktion. Evnen til hurtigt at identificere, hvornår en tilstrækkelig frekvensområde optimerede cellepopulationer er tilgængelige, er kritisk i forskning, når elektrisk stimulus diskrimination testes. Hvis utilstrækkelig frekvens-fordeling er opnået, derefter sammenligning mellem stimulering af forskellige frekvensområder er simpelthen ikke muligt. Ikke desto mindre, jo længere processenaf frekvens-amplitude respons kortlægning fortsat kritisk at give detaljer om den bredde af tuning af cellepopulationer og bør udføres før fastsættelse af elektroden på plads.
I adfærdsmæssige træning og test, giver mulighed for optagelse af et ikke-stimulus (eller tavs) perioden mellem forsøg, før stimulus debut, svar på første stimulus debut, der skal undersøges. Ved anvendelse af elektrisk neural stimulation, en reaktion på stimulus debut er bevis for den simple påvisning af stimulus. Således, når der ikke er nogen stimulus indtræden reaktion, men en reaktion, når det andet alternerende stimulus indføres, kan det udledes, at kun den sidstnævnte stimulus kan detekteres. Uden inddragelse af en sådan tavs periode, ville der ikke være nogen måde at fastslå, at den tidligere stimulus ikke blev opdaget.
En begrænsning i denne adfærdsmæssige test teknik er, at fraværet af mund-stød leveres efter fremlæggelsen af neural stimulation kan føre til udvikling af specificitet i konditioneret angst, sådan at frygt kun udtrykkes, når akustisk stimulus er præsenteret. Dvs., kan dyret få, at de særlige sensoriske virkninger neural stimulering er forbundet med ikke modtager en stød i foden. I modsætning hertil kunne levere mund-chok efter fremlæggelsen af neurale stimulation føre til en betinget frygt for den neurale stimulus selv, adskiller sig fra enhver lyd-lignende egenskaber neurale stimulus måtte have. Resultater opnået når der korrigeres for en mund-chok efter neural stimulation sikkert give stærkere beviser for neurale stimuli lyd-agtige end dem der bruger en mund-chok efter neural stimulation, som i førstnævnte tilfælde betingede frygt er generaliseret fra akustisk til neural stimulation. Ikke desto mindre er risikoen for at udvikle specificitet til akustisk stedet neurale stimulation er til stede. Anvendelsen af båndpasfiltrerede støj som akustisk stimulus end rene tonestød, tidligere derbedre kan afspejle den perceptuelle oplevelse af neural stimulation, kan reducere risikoen for en sådan specificitet udvikling. En sådan fremgangsmåde introducerer yderligere variabel båndbredden af filtret, hvilket vil påvirke diskrimination opgaver.
En yderligere begrænsning i forbindelse med enhver kronisk neural implantation, som krævet for adfærdsmæssig testning, er ændringen i funktion af elektroden og det tilknyttede nervevæv over tid. Stimulering af neuralt væv kan både midlertidig suppression af neural aktivitet 13 og vævsforandringer, såsom celletab 14 og direkte hjernevæv reaktion på elektroden. 15
Den beskrevne tilgang til implantation og adfærdsmæssige test giver et middel til at teste både detektion og diskrimination af akustiske og elektriske stimuli med kort uddannelse, og evnen til at udøve kontrol med forsøget frekvens. Teknikken at anvende ændringen i HR som en målinge af konditioneret angst kan anvendes til ikke kun auditive test, men mere generelt enhver sensorisk analyse som stimuli kan blive præsenteret for en diskret tidsrum, og hvor detektion af sensorisk diskrimination ønskes.
Disclosures
Dr. Antonio Paolini er en direktør for Bioengenesis Technologies Pty Ltd, som er de australske repræsentanter for Tucker Davis Technologies og den australske distributør af NeuroNexus Probes.
Acknowledgments
Finansieringen af denne forskning blev leveret af Garnett Adgangskort og Rodney Williams Memorial Foundation og La Trobe University.
Materials
| Name | Company | Catalog Number | Comments |
| PowerLab |  ADInstruments ADInstruments |
ML880 | Records data received from the implanted TR40 transmitter |
| SmartCtrl controller card | Med Associates, Inc. | DIG-716B | Controls the behavioral test chamber, including foot shock |
| Modular behavioral test chamber | Med Associates, Inc. | ENV-009 | Test chamber size: 30.5cm x 39.4cm |
| Aversive stimulus generator | Med Associates, Inc. | ENV-410B | Delivers aversive foot-shock to metal-bar floor of the cage through a Solid State Scrambler unit |
| Programmable Attenuator | TDT | PA5 | Controls the amplitude of delivered acoustic signal to ensure stable amplitude across frequencies |
| Electrostatic speaker driver | TDT | ED1 | Drives the electrostatic speakers (EC1, ES1) |
| Free-field electrostatic speaker | TDT | ES1 | Sounds are presented using this speaker in the behavioral test chamber |
| Coupled electrostatic speaker | TDT | EC1 | Sounds are presented using this speaker during neural implant surgery |
| Stimulator Base Station | TDT | RX7 | Controls delivery of electrical neural stimulation (used with MS16) |
| Microstimulator | TDT | MS16 | Delivers multichannel electrical neural stimulation |
| Processing base station | TDT | RZ2 | Records neural activity during brain implantation (using PZ2 preamplifier) |
| Preamplifier | TDT | PZ2-256 | 256-channel high impedance preamplifier |
| Telemetry device receiver | Telemetry Research | TR162 | Receives digital signal from TR40, and converts to amplified analogue output |
| Implantable electrocardiogram telemetry device | Telemetry Research | TR40 | The implanted transmitter device, sampling at 2kHz |
| Multifunction Processor | Tucker-Davis Technologies | RX6 | Used to generate acoustic stimuli |
| Vertex Castavaria | Vertex Dental | Dental acrylic used to fix the electrode in place | |
| Kwik-Sil Adhesive, low viscosity | World Precision Instruments, Inc. | Silicon elastomer used to coat the electrode shanks | |
| Multichannel electrode | NeuroNexus Technologies | a2x16-10mm 100-500-413 | The 2-shank 32-channel extracellular electrode array used for implantation. The electrode sites have been activated to produce a coating of iridium oxide in preparation for stimulation. |
References
- Mauger, S. J., Shivdasani, M. N., Rathbone, G. D., Argent, R. E., Paolini, A. G. An in vivo investigation of first spike latencies in the inferior colliculus in response to multichannel penetrating auditory brainstem implant stimulation. Journal of Neural Engineering. 7, 036004-036004 (2010).
- Shivdasani, M. N., Mauger, S. J., Argent, R. E., Rathbone, G. D., Paolini, A. G. Inferior colliculus responses to dual-site intralamina stimulation in the ventral cochlear nucleus. J. Comp. Neurol. 518, 4226-4242 (2010).
- Shivdasani, M. N., Mauger, S. J., Rathbone, G. D., Paolini, A. G. Inferior colliculus responses to multichannel microstimulation of the ventral cochlear nucleus: Implications for auditory brain stem implants. Journal of Neurophysiology. 99, 1-13 (2007).
- Lenarz, M., Lim, H. H., Patrick, J. F., Anderson, D. J., Lenarz, T. Electrophysiological Validation of a Human Prototype Auditory Midbrain Implant in a Guinea Pig Model. JARO. 7, 383-398 (2006).
- Lim, H. H. Auditory Cortical Responses to Electrical Stimulation of the Inferior Colliculus: Implications for an Auditory Midbrain Implant. Journal of Neurophysiology. 96, 975-988 (2006).
- Otto, K. J., Rousche, P. J., Kipke, D. R. Microstimulation in auditory cortex provides a substrate for detailed behaviors. Hearing research. 210, 112-117 (2005).
- Gai, Y. Detection of Tones in Reproducible Noise Maskers by Rabbits and Comparison to Detection by Humans. JARO. 8, 522-538 (2007).
- Miller, C. A., Woodruff, K. E., Pfingst, B. E. Functional responses from guinea pigs with cochlear implants. I. Electrophysiological and psychophysical measures. Hearing Research. 92, 85-99 (1995).
- Beitel, R. E., Vollmer, M., Snyder, R. L., Schreiner, C. E., Leake, P. A. Behavioral and neurophysiological thresholds for electrical cochlear stimulation in the deaf cat. Audiology & Neurotology. 5, 31-38 (2000).
- Beitel, R. E., Snyder, R. L., Schreiner, C. E., Raggio, M. W., Leake, P. A. Electrical cochlear stimulation in the deaf cat: comparisons between psychophysical and central auditory neuronal thresholds. J. Neurophysiol. 83, 2145-2162 (2000).
- Vollmer, M., Beitel, R. E., Snyder, R. L. Auditory detection and discrimination in deaf cats: Psychophysical and neural thresholds for intracochlear electrical signals. Journal of Neurophysiology. 86, 2330-2343 (2001).
- LeDoux, J. E., Cicchetti, P., Xagoraris, A., Romanski, L. M. The lateral amygdaloid nucleus: sensory interface of the amygdala in fear conditioning. Journal of Neuroscience. 10, 1062-1069 (1990).
- McCreery, D. B., Yuen, T. G., Agnew, W. F., Bullara, L. A. A characterization of the effects on neuronal excitability due to prolonged microstimulation with chronically implanted microelectrodes. IEEE Transactions on Biomedical Engineering. 44, 931-939 (1997).
- Liu, X., McPhee, G., Seldon, H. L., Clark, G. M. Histological and physiological effects of the central auditory prosthesis: surface versus penetrating electrodes. Hearing Research. 114, 264-274 (1997).
- Polikov, V. S., Tresco, P. A., Reichert, W. M. Response of brain tissue to chronically implanted neural electrodes. Journal of Neuroscience Methods. 148, 1-18 (2005).



