Summary
היישום של הפרדיגמה התניה קלאסית פחד התנהגותי על השמיעה תותבת מחקר בחולדות מתואר. פרדיגמה זו מספקת מנגנון לזיהוי הן גילוי של, ואפליה בין, אקוסטית ברורים גירויים חשמליים באמצעות קצב הלב כמדד התוצאה.
Abstract
הכנות בעלי החיים חריפה שימשו במחקר פרוספקטיבי חוקרת עיצובים אלקטרודה וטכניקות גירוי להשתלבות פרוטזות שמיעה עצביים, כמו גזע המוח השמיעתית שתלים 1-3 ואת המוח התיכון השמיעה שתלים 4.5. בעוד ניסויים חריפה יכול לתת תובנה ראשונית ליעילות של השתל, בודקים את בעלי החיים המושתלים כרוניים ער מספקת את היתרון של בדיקת המאפיינים פסיכופיסיות של התחושות הנגרמת באמצעות התקנים מושתלים 6,7.
מספר טכניקות כגון מיזוג זכתה מבוסס אופרנטית 6-8, הימנעות מותנה 9-11, או מיזוג פחד קלאסית 12 שימשו ספק אישור התנהגותי של גילוי של תכונות הגירוי הרלוונטי. בחירת הטכניקה כוללת היבטים איזון כולל יעילות זמן (לעתים קרובות עניים בשכר בסיס גישות), את היכולת לבחון ריבויגירוי מייחס בו זמנית (מוגבל הימנעות אוויר), ואמינות מידה של גירויים חוזרים ונשנים (אילוץ הפוטנציאל כאשר אמצעים פיזיולוגיים מועסקים).
הנה, פחד קלאסית מיזוג השיטה ההתנהגותית מוצגת אשר עשוי לשמש בעת ובעונה אחת מבחן הן גילוי של גירוי, ואפליה בין שני גירויים. קצב הלב משמש כאמצעי של תגובת הפחד, אשר מפחית או מבטל את הדרישה וידאו זמן רב המקודד התנהגות הקפאה או אמצעים אחרים (אם כי צעדים כאלה יכולים לכלול לספק ראיות מתכנסת). בעלי חיים היו מותנים באמצעות טכניקות אלה בשלוש שעות 2 פגישות מיזוג, כל מתן 48 ניסויים גירוי. לאחר מכן 48-ניסיון הפעלות בדיקות שימשו לבדיקת זיהוי של גירוי כל זוגות שהוצגו, ואפליה בין גירויים מבחן החברות של כל זוג.
שיטה זו התנהגות מוצגבהקשר של ניצול שלה במחקר תותבת השמיעה. השתלה של התקנים טלמטריה רל מוצג. לאחר השתלת אלקטרודות במוח לתוך הגרעין שבלול, מונחה על ידי ניטור של תגובות עצביות לגירויים אקוסטיים, ואת הקיבעון של האלקטרודה למקום לשימוש כרונית מוצג באופן דומה.
Protocol
1. טלמטריה רל התקן השרשה
- שעה לפני תחילת ניתוח ההשתלה, לנהל Carprofen (4 מ"ג / ק"ג SC) כדי לספק שיכוך כאבים לאחר הניתוח.
- להזריק קטמין / Xylazine (קה: 70 מ"ג / ק"ג, XY: 10 מ"ג / ק"ג, IP) עבור הרדמה, כדי לאפשר הכנת החיה הראשונית כולל גילוח ברים אוזניים הוספת לפני המעבר הרדמה Isoflurane שהוא יציב יותר במהלך הניתוח ומאפשר ויסות טוב יותר של עומק ומקצר שלאחר הניתוח ההתאוששות מן ההרדמה.
- עם תחילת ההרדמה, החל סיכה עין עיניים של בעלי חיים ואחר כך לגלח את החזה הבטן, והגרון. נגב את עור חשוף באמצעות שיחים כירורגית, ולאחר מכן הכנת העור אלכוהולי, ואחריו פתרון חיטוי. מניחים את הכלוב הביתה על השמיכה חום כדי לחמם.
- מניחים את חיה במצב שכיבה על צלחת homeothermic. הכנס מוך מתחת צוואר להעלות ולחשוף את הגרון.
- מניחים את האף שיתוףנה (מתן% 1-3 כרך / כרך Isoflurane חמצן, 2 ליטר לכל דק ') על האף של בעל החיים ולתקן את הקונוס במקומו.
- לתקן את האסיפות הגפיים במצב חצי המורחבת ליצור מתח העור על בית החזה והגרון, ולמנוע את האף חומק ללא חרוט האף.
- הכנס את החללית השמיכה homeothermic לתוך פי הטבעת של החיה.
- לעשות חתך קו האמצע בעור המשתרעת מ"מ xiphoid תהליך 20 caudally לחשוף את שכבת השריר. לעשות חתך לאורך התאמה Linea alba, ואז חלל הצפק.
- הכנס את התקן טלמטריה א.ק.ג. לתוך חלל הצפק עם מוביל הארכת מסוף מקורי של הפתח, ו לתפור מ"מ הזנב 15 של הפתח הצפק.
- לעשות חתך קו האמצע בגרון שמעל קנה הנשימה, חושפים את השריר sternohyoid.
- הכנס אוזניים מלקחיים תנין לחלל תת עורית של החתך מקורי מול caudally, ולהשתמש בהם כדי ליצור subcutהמנהרה aneous מ מקורי כדי חתך הזנב. גריפ להוביל חיובי (אדום) מלקחיים את לסגת להוביל דרך המנהרה.
- הרם את השריר sternohyoid באמצעות מלקחיים והכנס את קצה עופרת חיובית dorsally לכיוון חלל החזה הקדמי מימין, והשאיר כ 1 מ"מ לולאה של כבל מקורי כדי הכניסה. לתפור את ההובלה בו משתרע בין חלל בית החזה לבין בחלק העליון של הלולאה לשריר הבסיסית.
- לחשוף את הקיר הגבי של xiphoid, ואת לתפור קצה להוביל שלילית משטח חשוף.
- בדוק את האות מכשיר מושתל כדי להבטיח א.ק.ג. נאותה ניתן להשיג.
- להאכיל את כבל עודף לתוך חלל הצפק. תפר וסגר את קיר הבטן, Linea alba, ואת עור הבטן.
- תפר וסגר את העור של הגרון.
- להפסיק את אספקת Isoflurane, ולהמשיך לספק חמצן עד תנועה ספונטנית הוא ציין.
- כאשר התנועה הוא ציין, שחרר את forelimbsד להחזיר את החיה לכלוב בבית שלו. להעביר את הכלוב הביתה כדי כמחצית הכלוב על משטח חום. זה יאפשר את החיה, כאשר הנייד, כדי לעבור בין אזורים חמים יותר וקר של הכלוב. לפקח על בעלי חיים עד אמבולטורי, ולהשאיר את הכלוב הביתה על השמיכה חום במשך 24 שעות.
- ניהול Carprofen (4 מ"ג / ק"ג sc) כל 24 שעות למשך 3-5 ימים.
2. אלקטרודה למוח שתל
- שעה לפני תחילת ההשתלה, לנהל Carprofen (4 מ"ג / ק"ג SC) על כאבים שלאחר הניתוח.
- להזריק קטמין / Xylazine (קה: 70 מ"ג / ק"ג, XY: 10 מ"ג / ק"ג, IP) עבור הרדמה.
- עם תחילת ההרדמה, החל משחת עיניים להגן על העיניים, אז לגלח את ראשו של בעל החיים. נגב את עור חשוף באמצעות שיחים בבטאדין, ואחריו אלכוהול, ואחריו בבטאדין.
- מניחים את חיה במצב נוטה על צלחת homeothermic.
- עמדה אחת באוזן בר חלול במצב כ הסופית הצפויה,ולהרים ומקם את בעל החיים, כך האוזן בר ממוקם meatus אקוסטיים חיצוניים.
- החלק את האוזן בר 2 חלול לתוך meatus הנגדי אקוסטיים חיצוניים.
- באמצעות עכבר שיניים מלקחיים, פתח הלסת של החיה לחבר את החותכות העליונות מעל בעל שיניים.
- החלק את האף חרוט על האף, ולהתחיל מסירת Isoflurane (% בנפח 1-3 / כרך ב חמצן). בעלי חיים נשמרים כעת ברחבי ניתוח עם הרדמה זו.
- לעשות חתך בעור של הראש, כ 1 מ"מ שנותר קו האמצע והארכת מ 3-4 מ"מ מקורי ל 2-3 מ"מ הזנב של למבדה.
- לחזור בו עור ושריר רוחבית מן התפרים, חשיפת עצם הקודקודית ואת עצם interparietal. לשפשף את פני השטח של העצם חשופה באמצעות 20% מי חמצן פתרון תחבושת.
- לקדוח חור קטן עצמות הקודקודית על ימין ועל שמאל, ואת בורג בורג פלדה כירורגית לתוך כל חור עוזב שטח קטן (0.5 מ"מ) בין heaד של בורג כל מיומנות. חבר את הברגים על הקרקע אלקטרודה נקודות התייחסות של headstage גבוהה impedence.
- לקדוח חור כ 2 מ"מ מרובע במידה לרוחב, ביותר של העצם interpariental. לרוקן את החור באמצעות מי מלח סטרילית כדי להסיר כל אבק עצם או שברים בעצמות, אשר עשויה לפגוע האלקטרודה.
- חבר את הרמקול צימוד לבר אוזן שמאל חלול.
- באמצעות קצה המחט, עושים חתך דורה במטוס sagittal.
- להביא מניפולטור האלקטרודה למקום לעיל הפתיחה, עם זווית של 10 מעלות caudorostral. הכנס את האלקטרודה באופן ידני כ -2 מ"מ לתוך השטח של המוח. להבטיח את המגבר דולק, ואז לאטום את חדר ההקלטה.
- להתחיל משלוח מחזורית נמוכה (2-8 קילוהרץ), באמצע טווח (16-24 קילוהרץ) וגבוה (32 kHz-44KHz) הלהקה עוברים בתדירות הרעש מסונן. השיעור המרבי שבו פורצת צריכה להיות מועברת היא אחת פרץ כל 200 מילישניות. מעקב אחר פעילות עצביתלא כל ערוץ לזהות תגובות למצגת רעש.
- המשך החדרת אלקטרודה עד מרחק או מוכנס הכולל מתקרב 8 מ"מ. אם ההגבלה 8 מ"מ מגיע ללא תגובות עצביות להתגלות, לסגת לשנות את מיקום האלקטרודה להכנסה נוספת. אם הגרעין שבלול (CN) הושג, אתרי בקצה האלקטרודה שאמור להציג תגובות בעיקר בתדירות גבוהה בגירויים. אם אלקטרודות נמצאים בגרעין השבלול הגחוני (VCN), תגובות לגירוי אקוסטי צריכה להיות מרכיב התפרצות חזקה (1-5 MS), ואחריו ירידה מהירה בפעילות.
- ממשיכים להוסיף את האלקטרודה עד קצות האלקטרודה לזהות התגובות בתדירות נמוכה לגירויים שמיעתיים, או מונע פעילות חדל להופיע (ובמקרה זה, אלקטרודה עשויה חלפו לחלוטין באמצעות CN ו ייתכן שיהיה צורך לתקן את האלקטרודה מיקום).
- לבנות מפת בתדירות משרעת התגובה של הנוירונים על האלקטרודה שלites. זו מושגת על ידי קול הציג על פני טווח התדר הרצוי (בדרך כלל 1-44 kHz או 1-80 kHz) dB ב 1-70 אמפליטודות, עם 10 חזרות על כל גירוי. אחד התמריצים עשויה להיות מועברת בכל 300 אלפיות בעת מיפוי CN. אם המפה אינה מספקת, כדאי לשקול תיקון המיקום של האלקטרודה.
- למרוח שכבה דקה של סיליקון אלסטומר מעט מעל שאנקס אלקטרודה שנחשפו, כך אלסטומר יזרמו במורד שנקס ואת המעיל הן את שנקס ואת משטח חשוף של המוח.
- למרוח שכבה 1 של התותבת בטון פולימר סביב האלקטרודה. הבטון צריך להיות צמיגה מינימלית, כדי להפחית את הסיכון של האלקטרודה מועברים בתהליך של יישום. ודא הפולימר אינו מכסה את הברגים בעצמות הקודקודית או הכבלים המצורפים. חכו אקריליק להתקשות, אשר נמשכת בדרך כלל 5-10 דקות.
- לנתק את הקרקע חוטי התייחסות של headstage מן הברגים בעצמות הקודקודית. באמצעות מלקחיים, Gently הרוח חוט הקרקע של אלקטרודות סביב הבורג בעצם הקודקודית השמאלית.
- למרוח שכבה 2 של התותבת מלט פולימרי. זו השכבה השנייה צריך לתמצת את שני הברגים, ותזרים לחלל בין ראש הבורג ואת הגולגולת. בעשותו כן, ברגים תקיים אקריליק אלקטרודות לגולגולת. חכו אקריליק להתקשות.
- הסר את headstage מהמחבר האלקטרודה.
- באמצעות מלקחיים שיניים חולדה, להרים את העור לרוחב הפולימר על פולימר, ולהשתמש תפר תיק מיתרים כדי לסגור את העור סביב מחבר את האלקטרודה חשוף.
- להסיר את הסורגים האוזן, משחררים את הראש.
- סיום מסירת Isoflurane, ולהמשיך לספק חמצן דרך האף עד חרוט התנועה הספונטנית הוא ציין.
- להחזיר את החיה לכלוב בבית. להעביר את הכלוב הביתה כדי כמחצית הכלוב על משטח חום. זה יאפשר את החיה, כאשר הנייד, כדי לעבור בין אזורים חמים יותר וקר שלהכלוב.
- לפקח על בעלי חיים עד אמבולטורי. לעזוב את הכלוב בבית על משטח חום במשך 24 שעות.
- ניהול Carprofen (4 מ"ג / ק"ג sc) כל 24 שעות למשך 3-5 ימים.
3. התניה
- מניחים את החיה בחדר הבדיקה.
- להפעיל את המכשיר טלמטריה אק"ג.
- אפשר חיה כדי להסתגל אל חדר הבדיקה במשך חמש דקות לפני תחילת מיזוג. זה יאפשר קצב הלב לחזור לקו הבסיס, כמו טיפול מוביל העלאת קצב הלב.
- בצע את ההליך מיזוג:
- לספק 1 חבר נבחר באופן אקראי זוג לגירוי אקוסטי שוב ושוב 250 התפרצויות מילי מופרדות 250 ms השתיקה של 80-170 s. כל מצגת הגירוי חייב להיות על עלייה לבין זמן הנפילה של 10 מילישניות, כדי למנוע "קליק" נתפס, מבחינה תפיסתית אשר מכסה מגוון רחב של תדרי קול.
- להתחיל לסירוגין חבר השני של הצמד לגירוי אקוסטי עם 1, הצגת EAהטון עבור CH 250 ms ואחריו 250 ms של שתיקה.
- לאחר 9.5 של של התקופה של 10 מתוך לסירוגין מצגת הטון, לנהל 0.5 MS מטר הלם (0.7 mA).
- להפסיק את הטון עבור מצגות של 30 כדי לאפשר את קצב הלב עד שהוא יתייצב.
- ולחדש זוג משלוח טון (מ 3.4.1). זוגות הטון צריך להיות מוצג בצורה אופטימלית ברצף אקראי, ולפחות 12 זוגות צליל יש להשתמש על מנת להבטיח כי מיזוג generalises לכל זוגות התדירות אינה ספציפית את התדרים המשמשים הטון. המשך בתהליך זה עד 48 מחזורים של ההליך (ניסויים) הושלמו.
- לבטל את המכשיר א.ק.ג., ולהחזיר את בעל החיים לכלוב בבית.
4. בדיקות
- Anesthetise חיים באמצעות Isoflurane (% בנפח 1-3 / כרך ב חמצן).
- חבר את הכבל גירוי עצבי למחבר האלקטרודה חשוף.
- מניחים את החיה בחדר הבדיקה.
- להפעיל את המכשיר טלמטריה אק"ג. </ Li>
- לאפשר חיים להתאושש הרדמה Isoflurane ו להסתגל אל חדר הבדיקה במשך עשר דקות לפני תחילת הבדיקה. זה יאפשר קצב הלב לחזור לקו הבסיס והתאוששות מהשפעת הרדמה קצרה.
- בצע את ההליך בדיקות.
- לספק 1 חבר נבחר באופן אקראי זוג לגירוי אקוסטי שוב ושוב 250 התפרצויות מילי מופרדות 250 ms השתיקה של 80 170s. כל מצגת הגירוי חייב להיות על עלייה לבין זמן הנפילה של 10 מילישניות, כדי למנוע "קליק" נתפס, מבחינה תפיסתית אשר מכסה מגוון רחב של תדרי קול.
- להתחיל לסירוגין חבר השני של הצמד לגירוי אקוסטי עם 1, הצגת כל הטון 250 ms 250 ms ואחריו שתיקה.
- לאחר 9.5 של של התקופה של 10 מתוך לסירוגין מצגת הטון, לנהל 0.5 MS מטר בהלם.
- להפסיק את הטון עבור מצגות של 30 כדי לאפשר את קצב הלב עד שהוא יתייצב.
- להתחיל משלוח של אחד באופן אקראי Seleחבר cted של זוג גירוי חשמלי במוח שוב ושוב, באמצעות 250 תקופות עם MS גירוי מופרדות 250 ms של גירוי שאינו עבור 80-170 ים.
- להתחיל לסירוגין חבר 2 של זוג גירוי עם 1, מציג כל גירוי אחר 250 MS על ידי 250 תקופת גירוי שאינן-MS. המשך לסירוגין על גירוי של 10.
- להפסיק מצגות גירוי של 30 כדי לאפשר את קצב הלב עד שהוא יתייצב.
- ולחדש זוג משלוח גירוי (מ 4.6.5 או 4.6.1). זוגות גירוי יש להציג רצף אקראי, ולפחות 20 ניסויים של כל זוג הגירוי צריך להיות מועברת על מנת להבטיח מספיק קצב הלב איסוף הנתונים כדי לספק תוצאה הממוצע ברורה למזער שונות. ניסויים הפצת באמצעות גירויים אקוסטיים לאורך כל הדיון בדיקות מפחית את הסיכוי להכחדה תתרחש במהלך ההליך.
- לנתק את כבל גירוי מן החיה.
- בטל דווי א.ק.ג.לספירה.
- להחזיר את החיה לכלוב בבית.
5. נציג תוצאות
ההקלטה נלקחה דגימת א.ק.ג. באמצעות מכשיר טלמטריה מושתל שבוע לאחר ההשתלה מוצג באיור 1. הקלטה כזו ניתן לבצע בדרך כלל לקבל את התקנים מושתלים, והתקנים ממשיכים לתפקד כראוי להקלטת עבור העולה על שישה חודשים, גם אם תפר מסיסים משמש כבלים מדביקים עליה את השריר. רישום א.ק.ג. שמוצג באיור 2 התקבל חיה יותר משמונה חודשים לאחר ההשתלה.
דמויות 3 מראה את המיקום של ההשתלה המוצלחת. מיקום האלקטרודה יש אתרים רבים אלקטרודה בגרעין שבלול posteroventral (PVCN), מתן גירוי וגישה ההקלטה הרבה היבט dorsoventral. את תדר התגובות של כל אתר האלקטרודה להשתלה זה מוצגים באיור 4. אזור ארוכה של PVCN שבו אלקטרודות מופצים מוביל אוכלוסיות תאים נגישים להקלטה גירוי "מכוון" למגוון רחב של תדרים. יתר על כן, האוכלוסיות עצמם מכוונים צר - הם מגיבים רק פס צר של תדרי קול (ראה תרשים 5).
לעומת זאת, מיקום עניים מוצגת באיור 6. במקרה זה, אלקטרודה הוצב גם מדיאלית, ולא הכניס מספיק עמוק לחדור PVCN. כתוצאה מכך, רק אתרים אלקטרודה ליד התגובות הצג את הטיפ להישמע כפי שמוצג באיור 7. בנוסף, מגוון של תדרים שבו אוכלוסיות תאים נגישים מכוונים מוגבל מאוד. כוונון של האוכלוסיות עצמן צר (ראה איור 8), אבל ההפצה אשכולות של התדרים המרכזיים של אוכלוסיות תאים גורם גירוי אזורים שונים בתדירות בלתי אפשרית.
_content "> לב קו בסיס נתונים הדולר נעו בין מיזוג מצגות גירוי אקוסטי. לחשבון של השונות הזאת, קצב הלב גלם (HR) הנתונים מנורמל כאחוז מסך HR נצפתה כאשר לסירוגין גירוי החלה (זמן 0). איור 9 מציג נתונים שונים הטפסים אשר נאסף במשך מיזוג 1. דוגמה לתוצאות משאבי אנוש שהושגו בעל חיים אחר במחצית השנייה של המפגשים הראשונים מיזוג מוצגת באיור 10. תהליך מיזוג לגירויים אקוסטיים היא מהירה, שינויים חזקים HR ניתן לצפות עם משפטים ספורים, 7. במקרה של איורים 9 ו 10 שינוי HR נצפתה מיד לאחר תחילתו של גירוי לסירוגין (עיין 3.4.1 ו 3.4.2) מספק הוכחה לכך חיה מסוגל להבחין בין חזר הראשונית הגירוי גירוי 2 הוסיף לאחר מכן.לאחר הבדיקה החל הפעלות, בו ציודגירויים עצביים ical ולא גירויים אקוסטיים מועברים בדרך כלל, שילוב של מצגות גירוי אקוסטי מאפשר אישור לכך השפעות מיזוג עדיין קיימות. שינוי כללי HR בתגובה תחילת המצגת לגירוי אקוסטי מאשר כי ההשפעה מותנית לגירויים אקוסטיים נותר כיום, כפי שמוצג באיור 11. באופן דומה, איור 12 מציג את השינוי הממוצע משאבי אנוש יחסי סביב תחילת לסירוגין צליל אקוסטי בישיבה המבחן הראשון. כמו איור 9 ו 10, HR יציב יחסית לקראת כניסתה של גירוי 2 לעומת השינוי המהיר של משאבי אנוש, לאחר כניסתה של גירוי 2 מספק ראיות כי אפליה בין שני צלילים התרחשה.
לעומת זאת, בהיעדר גילוי שניתן לראות באיור 13 בו גירוי חשמלי הוא החל. ממוצע יחסי אנוש צ'אן GE על פני 10 מחקרים מראה שום סימן של ירידה מהירה ועקבית נצפתה כאשר זיהוי מתרחשת, כמו באיור 11. כמו כן, העדר שינוי עקבית ומהירה של קצב הלב באיור 14 עולה כי שני גירויים חשמליים להישלח אינם שונים במידה מספקת לאפליה להתרחש. גם לפני תחילת תקופת לסירוגין (לפני זמן 0) ואחרי לסירוגין מתחילה, השינוי היחסי הממוצע ב HR נשאר קרוב לקו של שינוי.
דפוס אופייני יותר של אפליה בין שני בני זוג גירוי עצבי מוצגת באיור 15. ירידה בקצב הלב מתרחשת במהירות לאחר תחילת הגירוי לסירוגין, ואחריה עלייה משמעותית בקצב הלב. האסטרטגיה גירוי מסוים נעשה שימוש במקרה זה הצליחה לייצר מענה רלוונטי behaviourally.
"Src =" / files/ftp_upload/3598/3598fig1.jpg "/>
באיור 1. ההקלטה א.ק.ג. להשיג באמצעות מכשיר טלמטריה מושתל שבוע לאחר ההשתלה. האות לראות הקלטה זו היא אופיינית בעיקר את הקלטות שהושגו באמצעות המכשירים האלו.

איור 2. ההקלטה א.ק.ג. להשיג באמצעות מכשיר טלמטריה מושתל שישה חודשים לאחר ההשתלה. יש ירידה זניחה של אות מוקלט על אותה תקופת זמן, ואת האות הזאת היא בהחלט מספקת לצורך חישוב קצב הלב החי.

איור 3. שחזור 3D של מיקום האלקטרודה מוצלחת, תוך שימוש משולב רנטגן טומוגרפיה ממוחשבת וחתכים היסטולוגית. שני שאנקס אלקטרודה חדרה הגרעין שבלול posteroventral עם אלקטרודות orienטד אל פנים המבנה.

איור 4. מפה של תגובות אלקטרו שהוקלטו עם מיקום האלקטרודה של תרשים 3. ההיסטוגרמה מראה כל נתוני הפעילות באתר 1 אלקטרודה בתגובה למצגת של תדר אחד אקוסטי, כל עמודה מייצגת תקופה 25 ms זמן. משני שאנקס של מערך אלקטרודות, תגובות מזוהים בכל אתר האלקטרודה הפרט רק כתגובה צר מאוד של תדרים, אבל אלה להקות צרים מפוזרים על פני מגוון רחב של תדרים. הפצה כזו הוא אידיאלי, כמו רבים שונים בתדירות הקשורים אזורים של המוח יכול להיות מגורה באופן עצמאי.

איור 5. בתגובה אלקטרו בערוץ 10 מ השתל מוצגים איורים 3 ו בבוקרp; 4. באופן אידיאלי, מיקומים אלקטרודה צריך להוביל תגובות עצביות לגירוי אקוסטי שיראו על כמה ערוצים עם אמפליטודה צליל נמוך כמו 10 dB, כפי שמופיע בדוגמה זו.

איור 6. שחזור 3D של מיקום האלקטרודה עניים. בעוד זווית caudorostral של האלקטרודה היתה נכונה, היה המדיאלי מדי. יתר על כן, האלקטרודה לא הוכנס עמוק מספיק, וכתוצאה מכך באתרים הקרובים קצה האלקטרודה להיות ממוקם בתוך הגרעין שבלול הגב.

איור 7. מפה של תגובות אלקטרו שהוקלטו עם מיקום האלקטרודה כפי שמוצג באיור 6. הפעילות מתרחשת בקצות שוק כל אחד מערך אלקטרודות, אבל יש וריאציה קצת גירוי אקוסטי frequency זה מעורר פעילות בכל אתר האלקטרודה. כגון השתלת אינו מאפשר גירוי של השכבה בתדירות שונה לבדיקה אפליה.

איור 8. תגובה אלקטרו בערוץ 28 על מיקום האלקטרודה מוצגים איורים 6 & 7. גירוי אקוסטי להפיק התפרצויות חזקות של פעילות, בדומה בתדירות ספייק לזה לראות השתלה מוצלחת מאוד (איור 3). סף הוא גם נמוך למדי, עם תגובות שיראו בתגובה לצלילים ב dB 20. אם היו וריאציה יותר את התדרים אליהם את התגובות החזקות ביותר שהתרחשו על פני הערוצים האחרים של המערך באפיק זה בהחלט יהיה מספיק גירוי.
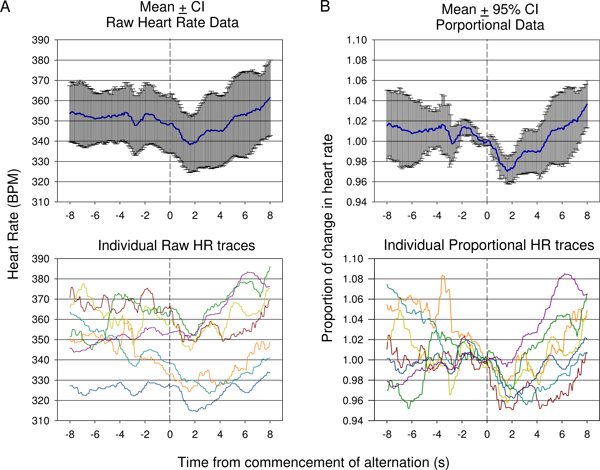
איור 9. השוואה בין קצב הלב גלם () Verses אומר פרופורציונליים (ב) מידע אשר נאסף במשך מיזוג הראשונה חיה 1. התגובות של 7 מצגות מוצגים. בגלל השינוי החל ב קצב הלב לפני תחילתו של שינוי הטון, כלומר קצב הלב גלם (± רווח סמך 95%) אינה מספקת להראות את מידת השינוי של הירידה הראשונית בקצב הלב בעקבות עלייה כמפורט גלם הפרט עקבות (למטה,). משמעות השינוי היחסי בקצב הלב הנתונים שבו קצב הלב מחולק קצב הלב בזמן של המצגת מותנה לגירוי אקוסטי על כל זכר מובא (ב '). זה מציג ירידה משמעותית סטטיסטית בעקבות מצגת גירוי מותנה עם עלייה משמעותית מאוחר לידי ביטוי באמצעות רווח סמך 95%. אישיות יחסיות שיעור עקבות לב מוצגים (ב ', למטה).
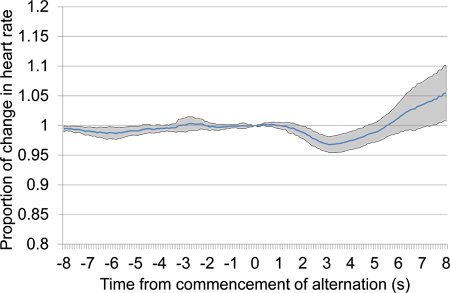
איור 10. ממוצע הלב r מידתית אכלו שינוי בין 8 של לפני של 8 לאחר תחילת לסירוגין מצגת לגירוי אקוסטי, שילוב של נתוני הפגישות מיזוג שנייה ושלישית. הנתונים המוצגים כולל שבעה מחקרים שהוצגו במהלך שני מפגשים מיזוג, ארבעה בפגישה מיזוג 1 ו 3 ב 2. בתגובה למצגת גירוי לסירוגין, ירידה ראשונית גדולה בקצב הלב קרתה בעקבות עלייה מאוחרת בקצב הלב.
איור 11. ממוצע הלב ביחס שיעור השינוי לעומת 10 של לפני 10 שניות לאחר תחילת ההצגה לגירוי אקוסטי לאחר תקופת שתיקה של 30. נתונים ניסיון נלקח הפגישה בדיקות הראשונה כוללת שישה מצגות גירוי אקוסטי. טיפה מוקדם ברורה בקצב הלב מספק ראיות של אפליה בין גירויים אקוסטיים שהוצגו.
es/ftp_upload/3598/3598fig12.jpg "/>
איור 12. ממוצע הלב ביחס שיעור השינוי לעומת 8 של ערב של 8 לאחר תחילת לסירוגין מצגת לגירוי אקוסטי, נלקחו בדיקות הפגישה הראשונה ביניהם חמישה מצגות גירוי אקוסטי. טיפה מוקדם ברורה בקצב הלב מספק ראיות של אפליה בין גירויים אקוסטיים שהוצגו.
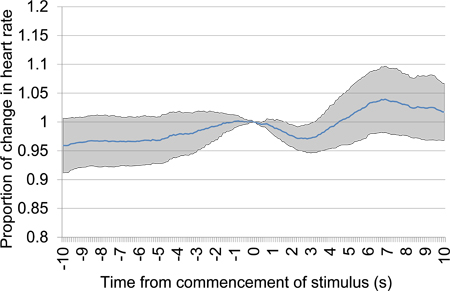
איור 13. ממוצע הלב ביחס שיעור השינוי לעומת 10 של לפני זה 10 לאחר תחילתו של גירוי חשמלי במוח לאחר תקופת שתיקה של 30. נתונים ניסיון נלקח הפגישות בדיקות הראשון והשני כולל 18 מצגות גירוי חשמלי, כל שימוש בהגדרות גירוי אותם. העדר ירידה מסוימת בקצב הלב, במיוחד בקרבה 0 המועד שבו מתחיל הגירוי, עולה כי בעל החיים אינו מסוגל לזהות את stimulאותנו.

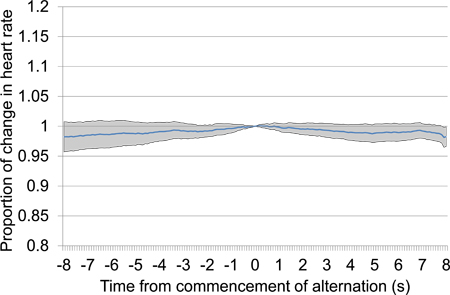
איור 14. ממוצע הלב ביחס שיעור השינוי לעומת 8 של ערב של 8 לאחר תחילת לסירוגין מצגת גירוי חשמלי (עיין 4.6.5 ו 4.6.6), נלקחו בדיקות הפגישה הראשונה, כולל 33 מצגות גירוי חשמלי. אין דפוס עקבי של שינוי בקצב הלב מתרחשת כמעט בזמן 0, אשר טוען כי הגירויים מתחלפים שונים מספיק לאפליה להתרחש.
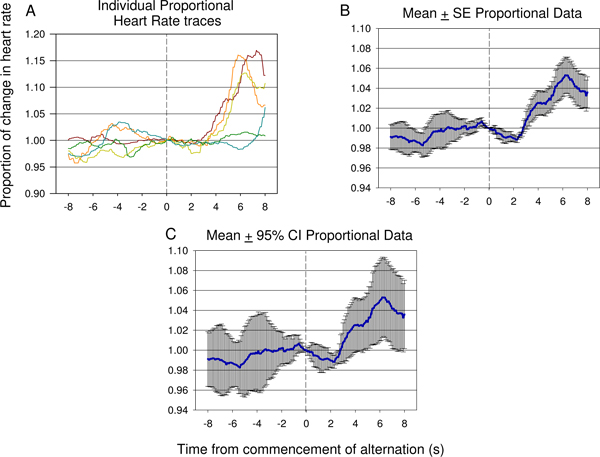
איור 15. דוגמאות מייצגות של עקבות בודדים (א) ו מתכוון פרופורציונליים קצב הלב הנתונים (ב ', ג') בין 8 של לפני 8 של אחרי תחילת ההצגה לסירוגין גירוי חשמלי, מתוך מפגש 7 בדיקות של בעלי חיים 2, ו כולל 12 מצגות גירוי חשמלי. ירידה משמעותית HR מתרחשת במהירות לאחר המבוא של גירוי עצבי 2 ואחריו עלייה משמעותית בקצב הלב לידי ביטוי המצביע על ההבדל בין הגירוי הראשון והשני זוהה על ידי בעל חיים. מידת השגיאה השונות של התגובה ניתן לראות בחלקה היחסי ממוצע ± טעות תקן (SE) שמוצג (ב '). המשמעות של טבילה ועליית בעקבות הצגת גירוי 2 ניתן לאמת באמצעות רווח סמך 95% להחיל את הנתונים המוצגים (C). בתגובה לראות (C) דומה לתגובה לראות ב איור 9.
Discussion
הטכניקות המתוארות כאן לספק אמצעי לבדיקת מגוון רחב של משימות אפליה במהירות, עם זמני אימונים קצרים המאפשר אוטומציה משמעותית, ובכך לצמצם זמן החוקר נדרש לעיבוד נתונים. באמצעות נתונים המתקבלים בחישוב מושתל, א.ק.ג. קצב לב (HR) שינוי בשעת הצגת הגירוי יכול להיות אוטומטי. טעויות א.ק.ג. עיבוד (כגון חסר לב פעימה אחת) ניתן לזהות בקלות כמו שהם מייצרים שינויים גדולים spuriously ב לכאורה קצב הלב לתקופה קצרה מאוד, שגיאה כזאת איתור קל מצמצם את הדרישה לבדיקה זמן עתירי נתונים ידנית .
הטכניקה המתוארת להשתלה של המכשיר טלמטריה אק"ג באופן עקבי מייצרת הקלטות עם הפרעה קטנה או לא (ראה איורים 1 ו 2). עם זאת, שינויים קטנים יחסית למיקום של עופרת באזור חלל החזה עלול לגרום להפרעות שריר הסמוךוה במיוחד הנשימה הקשורים רעש. אימות המיקום הנכון של מוביל במהלך תהליך ההשתלה, במיוחד אחרי תפירת מוביל במקום, מאפשר התאמות קנס של מיקום עופרת כדי למזער הפרעה.
תהליך השתלת מוח לתוך הגרעין שבלול קשה. באמצעות מצגות סדרתי של רעש הלהקה לעבור סינון של תדרים שונים, ולא רעש פס רחב כפי שבעבר שימשו 3, תגובות של אוכלוסיות תאים באתרים אלקטרודה ניתן לסקור במהירות רבה יותר מאשר פחות רעש ספציפי מבחינת התגובה בתדירות די בתגובה. היכולת לזהות במהירות כאשר מגוון מספיק של תדר מכוון אוכלוסיות תאים נגישים הוא קריטי במחקר כאשר אפליה גירוי חשמלי הוא נבדק. אם די בתדירות הפצה מתקבל, אז ההשוואה בין גירוי של אזורי תדרים שונים הוא פשוט לא אפשרי. עם זאת, כבר בתהליךשל משרעת בתדר מיפוי בתגובה נשאר קריטי לספק פרטים לגבי הרוחב של כוונון של אוכלוסיות תאים ו יש לבצע לפני תיקון האלקטרודה במקום.
באימון בדיקות התנהגותיות, הכללת גירוי אי (או דומם) התקופה שבין הניסויים, לפני תחילת הגירוי, מאפשר בתגובה הופעת הגירוי הראשוני לבדיקה. בעת השימוש בגירוי עצבי חשמלי, בעקבות הופעת גירוי מספק ראיות זיהוי פשוט של גירוי. לכן, כאשר אין הופעת הגירוי לתגובה, אבל התגובה כאשר גירוי לסירוגין 2 הוא הציג, ניתן להסיק כי רק תמריץ האחרון ניתן לאתר. ללא הכללת תקופה כה שקט, לא תהיה שום דרך לקבוע כי גירוי לשעבר לא זוהה.
מגבלה בטכניקה זו בדיקה התנהגותית היא היעדר רגל זעזועים נמסר לאחר הצגת neuraגירוי אני עלול להוביל להתפתחות של סגוליות בפחד ממוזג, כגון פחד באה לידי ביטוי רק כאשר גירוי אקוסטי מוצג. כלומר, בעלי חיים יכולים ללמוד כי ההשפעות חושיים מסוימים של גירוי עצבי קשורים לא מקבל הלם ברגל. לעומת זאת, אספקת מטר זעזועים לאחר הצגת הגירוי העצבי יכול להוביל לפחד ממוזג הגירוי העצבי עצמו, להבדיל מכל צליל, כמו תכונות הגירוי העצבי יכול להיות. התוצאות המתקבלות כאשר לא כולל רגליים בהלם לאחר גירוי עצבי בהחלט מספקים עדות חזקה יותר לגירוי עצבי להיות קול דמוי מאלה באמצעות מטר בהלם לאחר הגירוי העצבי, כמו במקרה הקודם הפחד המותנית יש להכליל מן אקוסטית לגירוי עצבי. עם זאת, את הסיכון לפתח הספציפיות כדי אקוסטית ולא גירוי עצבי קיים. השימוש pass-band סינון רעש כמו גירוי אקוסטי ולא התפרצויות צליל טהור, לשעבר אשריכול לשקף טוב יותר את החוויה התפיסתית של הגירוי העצבי, יכול להפחית את הסיכון לפתח ייחוד כזה. עם זאת, הליך כזה מכניס את המשתנה הנוסף של רוחב פס של מסנן, אשר ישפיע על משימות אפליה.
מגבלה נוספת קשורה ההשתלה כל עצבי כרוני, כגון נדרש לבדיקה התנהגותית, הוא השינוי בתפקוד של האלקטרודה או רקמה עצבית הקשורה לאורך זמן. גירוי של רקמה עצבית יכול להוביל גם דיכוי זמני של 13 פעילות עצבית ושינויים רקמות כגון אובדן התא בתגובה 14 ישיר ברקמת המוח על האלקטרודה. 15
הגישה תיאר ההשתלה ובדיקה התנהגותית מספק אמצעי לבחון הן איתור אפליה של גירויים אקוסטיים וחשמליים עם אימון קצר, ואת היכולת להפעיל שליטה על תדר המשפט. הטכניקה של שימוש שינוי HR כמו measurהדואר של פחד מותנה עשויות לחול על בדיקות השמיעה לא רק, אבל כללי יותר בדיקות כל החושים בו גירויים יכול להיות מוצג לכל תקופה דיסקרטית, ובו גילוי של אפליה חושית היא הרצוי.
Disclosures
ד"ר אנטוניו פאוליני הוא מנהל טכנולוגיות Bioengenesis Pty Ltd, אשר הם נציגי האוסטרלי טאקר דייויס טכנולוגיות המפיצה האוסטרלי של בדיקות NeuroNexus.
Acknowledgments
המימון למחקר זה סופק על ידי עובר גארנט ורודני וויליאמס הזיכרון קרן La Trobe האוניברסיטה.
Materials
| Name | Company | Catalog Number | Comments |
| PowerLab |  ADInstruments ADInstruments |
ML880 | Records data received from the implanted TR40 transmitter |
| SmartCtrl controller card | Med Associates, Inc. | DIG-716B | Controls the behavioral test chamber, including foot shock |
| Modular behavioral test chamber | Med Associates, Inc. | ENV-009 | Test chamber size: 30.5cm x 39.4cm |
| Aversive stimulus generator | Med Associates, Inc. | ENV-410B | Delivers aversive foot-shock to metal-bar floor of the cage through a Solid State Scrambler unit |
| Programmable Attenuator | TDT | PA5 | Controls the amplitude of delivered acoustic signal to ensure stable amplitude across frequencies |
| Electrostatic speaker driver | TDT | ED1 | Drives the electrostatic speakers (EC1, ES1) |
| Free-field electrostatic speaker | TDT | ES1 | Sounds are presented using this speaker in the behavioral test chamber |
| Coupled electrostatic speaker | TDT | EC1 | Sounds are presented using this speaker during neural implant surgery |
| Stimulator Base Station | TDT | RX7 | Controls delivery of electrical neural stimulation (used with MS16) |
| Microstimulator | TDT | MS16 | Delivers multichannel electrical neural stimulation |
| Processing base station | TDT | RZ2 | Records neural activity during brain implantation (using PZ2 preamplifier) |
| Preamplifier | TDT | PZ2-256 | 256-channel high impedance preamplifier |
| Telemetry device receiver | Telemetry Research | TR162 | Receives digital signal from TR40, and converts to amplified analogue output |
| Implantable electrocardiogram telemetry device | Telemetry Research | TR40 | The implanted transmitter device, sampling at 2kHz |
| Multifunction Processor | Tucker-Davis Technologies | RX6 | Used to generate acoustic stimuli |
| Vertex Castavaria | Vertex Dental | Dental acrylic used to fix the electrode in place | |
| Kwik-Sil Adhesive, low viscosity | World Precision Instruments, Inc. | Silicon elastomer used to coat the electrode shanks | |
| Multichannel electrode | NeuroNexus Technologies | a2x16-10mm 100-500-413 | The 2-shank 32-channel extracellular electrode array used for implantation. The electrode sites have been activated to produce a coating of iridium oxide in preparation for stimulation. |
References
- Mauger, S. J., Shivdasani, M. N., Rathbone, G. D., Argent, R. E., Paolini, A. G. An in vivo investigation of first spike latencies in the inferior colliculus in response to multichannel penetrating auditory brainstem implant stimulation. Journal of Neural Engineering. 7, 036004-036004 (2010).
- Shivdasani, M. N., Mauger, S. J., Argent, R. E., Rathbone, G. D., Paolini, A. G. Inferior colliculus responses to dual-site intralamina stimulation in the ventral cochlear nucleus. J. Comp. Neurol. 518, 4226-4242 (2010).
- Shivdasani, M. N., Mauger, S. J., Rathbone, G. D., Paolini, A. G. Inferior colliculus responses to multichannel microstimulation of the ventral cochlear nucleus: Implications for auditory brain stem implants. Journal of Neurophysiology. 99, 1-13 (2007).
- Lenarz, M., Lim, H. H., Patrick, J. F., Anderson, D. J., Lenarz, T. Electrophysiological Validation of a Human Prototype Auditory Midbrain Implant in a Guinea Pig Model. JARO. 7, 383-398 (2006).
- Lim, H. H. Auditory Cortical Responses to Electrical Stimulation of the Inferior Colliculus: Implications for an Auditory Midbrain Implant. Journal of Neurophysiology. 96, 975-988 (2006).
- Otto, K. J., Rousche, P. J., Kipke, D. R. Microstimulation in auditory cortex provides a substrate for detailed behaviors. Hearing research. 210, 112-117 (2005).
- Gai, Y. Detection of Tones in Reproducible Noise Maskers by Rabbits and Comparison to Detection by Humans. JARO. 8, 522-538 (2007).
- Miller, C. A., Woodruff, K. E., Pfingst, B. E. Functional responses from guinea pigs with cochlear implants. I. Electrophysiological and psychophysical measures. Hearing Research. 92, 85-99 (1995).
- Beitel, R. E., Vollmer, M., Snyder, R. L., Schreiner, C. E., Leake, P. A. Behavioral and neurophysiological thresholds for electrical cochlear stimulation in the deaf cat. Audiology & Neurotology. 5, 31-38 (2000).
- Beitel, R. E., Snyder, R. L., Schreiner, C. E., Raggio, M. W., Leake, P. A. Electrical cochlear stimulation in the deaf cat: comparisons between psychophysical and central auditory neuronal thresholds. J. Neurophysiol. 83, 2145-2162 (2000).
- Vollmer, M., Beitel, R. E., Snyder, R. L. Auditory detection and discrimination in deaf cats: Psychophysical and neural thresholds for intracochlear electrical signals. Journal of Neurophysiology. 86, 2330-2343 (2001).
- LeDoux, J. E., Cicchetti, P., Xagoraris, A., Romanski, L. M. The lateral amygdaloid nucleus: sensory interface of the amygdala in fear conditioning. Journal of Neuroscience. 10, 1062-1069 (1990).
- McCreery, D. B., Yuen, T. G., Agnew, W. F., Bullara, L. A. A characterization of the effects on neuronal excitability due to prolonged microstimulation with chronically implanted microelectrodes. IEEE Transactions on Biomedical Engineering. 44, 931-939 (1997).
- Liu, X., McPhee, G., Seldon, H. L., Clark, G. M. Histological and physiological effects of the central auditory prosthesis: surface versus penetrating electrodes. Hearing Research. 114, 264-274 (1997).
- Polikov, V. S., Tresco, P. A., Reichert, W. M. Response of brain tissue to chronically implanted neural electrodes. Journal of Neuroscience Methods. 148, 1-18 (2005).



