Summary
ويمكن استخدام عينات الأنسجة المجمدة غير المثبتة جزءا لا يتجزأ من قطع متوسطة درجة الحرارة المثلى (OCT) لدراسة توزيع الطبيعية وارتباط بالغليكوزيل من المخاط يفرز. في هذا النهج معالجة الأنسجة هو الحد الأدنى ويتم الاحتفاظ العرض الطبيعي للmucins، السكرية وغليكان الحواتم. ويمكن تحليل المقاطع النسيجية المناعية باستخدام الكشف من قبل مضان أو مولد اللون.
Abstract
Mucins معقدة والغليكوزيلاتي بشكل كبير O-المرتبطة البروتينات السكرية التي تحتوي على الكربوهيدرات أكثر من 70٪ وزنا 1-3. mucins يفرز، التي تنتجها الخلايا الكأسية والغشاء المخاطي في المعدة، وتوفير سقالة لطبقة المخاط ميكرومتر سميكة التي خطوط ظهائر للامعاء والجهاز التنفسي 3،4. بالإضافة إلى mucins، طبقات تحتوي أيضا على مخاط الببتيدات المضادة للميكروبات، السيتوكينات، والمناعية 5-9. طبقة المخاط هو جزء مهم من الحصانة الفطرية المضيفة، ويشكل خط الدفاع الأول ضد غزو الكائنات الدقيقة 8،10-12. على هذا النحو، فإن المخاط يخضع لتفاعلات عديدة مع الميكروبات، سواء مسببات الأمراض والمتكافلة، ويفرز mucins تشكل واجهة مهمة لهذه التفاعلات. دراسة التفاعلات البيولوجية مثل هذه الأساليب عادة ما ينطوي النسيجي لجمع الأنسجة وتلطيخ. وطريقتين النسيجي الأكثر استخداما لجمع الأنسجة وpreservأوجه في العيادة ومختبرات البحوث في ما يلي: تثبيت الفورمالين تليها تضمين البارافين، وتجميد الأنسجة، تليها التضمين في البرد حاصن سائل الإعلام.
عينات الأنسجة جزءا لا يتجزأ من البارافين إنتاج المقاطع مع الصفات المثلى لرؤية النسيجية بما في ذلك الوضوح والتشكل واضحة المعالم. ومع ذلك، أثناء عملية دمج البارافين عدد من الحواتم تصبح غيرت ومن أجل دراسة هذه الحواتم، أقسام الأنسجة يجب أن تتم معالجتها كذلك مع واحدة من العديد من الطرق استرجاع حاتمة 13. يتم استخراج mucins يفرز الدهون والأنسجة من خلال خطوة المقاصة البارافين، تضمين، الأمر الذي يتطلب إطالة الحضانة مع المذيبات العضوية (الزيلين أو Citrisolv). لذلك هذا النهج هو دون المستوى الأمثل للدراسات تركز على طبيعة وتوزيع mucins والمخاط في الجسم الحي.
في المقابل، الأنسجة التجمد في درجة الحرارة المثلى للقطع (OCT) لتضمين المتوسطةالفراغات الجفاف والمقاصة من العينة، ويحافظ على ترطيب العينة. وهذا يسمح لتحسين الحفاظ على طبقة المخاط رطب، وبالتالي يسمح دراسة العديد من الأدوار في علم الأحياء mucins الظهارية. لأن هذا الأسلوب يتطلب معالجة الحد الأدنى من الأنسجة، ويتم الاحتفاظ الأنسجة في حالة أكثر طبيعية. تجميد الأنسجة لذلك أقسام لا تتطلب أي معالجة إضافية قبل تلطيخ ويمكن تحليلها بسهولة باستخدام أساليب المناعية.
علينا أن نبرهن للحفاظ على طبقة سميكة ميكرومتر مخاط يفرز في عينات القولون المجمدة. هو انخفاض شديد عند هذه الطبقة هي جزء لا يتجزأ من الأنسجة نفسها في البارافين. علينا أن نبرهن أيضا تلطيخ المناعي من الحواتم غليكان عرض على mucins باستخدام يكتينس النبات. وميزة هذا النهج هو أنه لا يتطلب استخدام مثبتات خاصة ويسمح باستخدام الأنسجة المجمدة التي قد يتم الاحتفاظ بالفعل في المختبر.
Protocol
1. التضمين الأنسجة في أكتوبر
- إعداد حمام تجميد بإضافة الثلج الجاف ل2-الميثيل البوتان في مربع الستايروفوم الضحلة.
- حصاد الأنسجة، ورطب برفق على المناديل الورقية لتجفيف السائل الزائد. في حالة استخدام الأداة الإضافية المجمدة الأنسجة (الأنسجة التي تم تجميدها في النيتروجين السائل)، والسماح للأنسجة في عملية الاحماء إلى -20 ° C عن طريق وضعها في غرفة البرد مشراح.
- إضافة كمية صغيرة من أكتوبر إلى قالب التقشير-A-طريقة التجميد، ما يكفي لتغطية الجزء السفلي من العفن.
- وضع الأنسجة في العفن، وتأكد من راحة الأنسجة على الجزء السفلي من القالب في اتجاه المطلوب. تجميد مرة واحدة، وسوف تكون كتلة الأنسجة مقطوع إما من أسفل أو من الجوانب.
- تغطية الأنسجة مع OCT، ووضع القالب في حمام التجميد. سوف يتحول مجمع أكتوبر أبيض والأنسجة يتجمد.
- تجميد مرة واحدة، قشر قبالة العفن كتلة المجمدة ومكان في كيس تجميد ملحوظ.
- يمكن أن تظل الكتل المجمدةفي -80 درجة مئوية حتى الاستخدام.
2. الأنسجة باجتزاء
- كتل الأنسجة مكان في غرفة البرد مشراح، والسماح لهم للوصول -20 ° C (حوالي 30 دقيقة).
- قطع 3-5 ميكرون سميكة القسم، ووضع شريحة زجاجية موجبة الشحنة على رأس القسم. فإن الأنسجة الانضمام إلى الشريحة.
- الهواء تجفيف الأنسجة لمدة 30-60 دقيقة.
- ويمكن استخدام الشرائح في هذه المرحلة، أو أنها يمكن أن تظل في -80 ° C للاستخدام في المستقبل.
3. تلوين الأنسجة
- الشرائح التي تم تخزينها في -80 درجة C: تسمح الشرائح في حدوث تقارب والهواء الجاف في درجة حرارة الغرفة لمدة 30 دقيقة.
- إصلاح الشرائح مع 10٪ مخزنة الفورمالين لمدة 30 دقيقة في درجة حرارة الغرفة.
- يغسل ثلاث مرات في برنامج تلفزيوني أو المخزن المؤقت TBST، لكل غسل تراجع الشرائح العازلة 10 مرات في 250 مل. ويمكن استخدام PBS عازلة للتلوين المناعي، ومع ذلك، من أجل الكشف عن مولد اللون مع القلوية الفوسفاتيز-conjugated الأجسام المضادة، ينبغي أن تستخدم TBST منذ الفوسفات القلوية في PBS يمنع نشاط الفوسفاتيز.
- أقسام الأنسجة الشرائح هي الآن جاهزة للملطخة.
4. باستخدام البقع الكيمو مثل الأزرق وAlcian الدوري شيف حمض لكشف مخاط
- زرقة الألسيان وصمة عار:
- شطف الشرائح في الماء، حمض الخليك في احتضان 3٪ لمدة 3 دقائق في درجة حرارة الغرفة.
- وصمة عار مع الأزرق Alcian حل 2،5 درجة الحموضة لمدة 30 دقيقة في درجة حرارة الغرفة.
- غسل الشرائح في إدارة مياه الصنبور لمدة 10 دقيقة، شطف في الماء DI.
- ملون مباين في الأحمر سريعة النووية لمدة 5 دقائق في درجة حرارة الغرفة.
- يغسل ثلاث مرات في الشرائح المياه DI.
- الدوري شيف صمة عار حمض:
- شطف الشرائح في الماء، واحتضان في حامض الطازجة الدوري 1٪ لمدة 5 دقائق.
- يغسل ثلاث مرات في الماء DI، وتراجع مرة واحدة في miliQ المياه.
- وصمة عار مع كاشف شيف لمدة 15 دقيقة في درجة حرارة الغرفةه.
- غسل الشرائح في إدارة مياه الصنبور لمدة 10 دقيقة، شطف في الماء DI.
- ملون مباين في الهيماتوكسيلين Surgipath لمدة 30 ثانية في درجة حرارة الغرفة.
- يغسل ثلاث مرات في الشرائح المياه DI.
- احتضان الشرائح 30 ثانية في مياه الحنفية سكوت في درجة حرارة الغرفة.
- يغسل ثلاث مرات في الماء DI.
- يذوى واضحة من قبل شرائح يحتضنها 1 دقيقة في الايثانول 95٪، تليها ثلاثة تغييرات سريعة في الإيثانول بنسبة 100٪، وثلاثة تغييرات في Citrisolv، 2 دقيقة لكل منهما. جميع في درجة حرارة الغرفة.
- تحميل الشرائح المتوسطة على coverslips مع راتنجية (Cytoseal 60).
5. والأجسام المضادة باستخدام يكتينس (الجدول 1) إلى الكشف عن طرق الحواتم غليكان بواسطة الكيمو
- للكشف مضان من الحواتم غليكان الثلاث باستخدام يكتينس، منع الشرائح مع BSA 1٪ في برنامج تلفزيوني لمدة 10-30 دقيقة في درجة حرارة الغرفة.
- منذ يستخدم كتين المعقدة البيروكسيديز، منع من البيوتين الذاتية تفرخ 15 دقيقة مع 0.1٪أفيدين، تليها الحضانة 15 دقيقة مع البيوتين 0.01٪ في درجة حرارة الغرفة.
- غسل الشرائح في برنامج تلفزيوني بعد كل خطوة حظر.
- إعداد طازجة خليط من 1 ميكروغرام / مل رودامين مترافق-succinylated القمح الجرثومية راصة (sWGA)، 1.3 ميكروغرام / مل المعقدة البيروكسيديز خمان؛ بلسان أسود راصة (SNA) وميكروغرام / 5 مل فلوريسئين، مترافق Jacalin في HEPES / كلوريد الصوديوم العازلة (HEPES 10 مم، 150 ملي كلوريد الصوديوم درجة الحموضة 7.5).
- الشرائح مكان على سطح مستو أو في مربع تلطيخ، وطبقة الخليط كتين على القمة. ويمكن تخفيض حجم الخليط بلطف عن طريق وضع parafilm على السائل، ويسطح parafilm السائل ويمنع التبخر.
- احتضان 1 ساعة في درجة حرارة الغرفة في الظلام.
- يغسل ثلاث مرات مع الشرائح PBS.
- طبقة الشرائح مع 0.7 ميكروغرام / مل، مترافق streptavidin CY5 (للكشف عن المعقدة البيروكسيديز-SNA)، واحتضان لمدة 30 دقيقة في درجة حرارة الغرفة في الظلام.
- يغسل ثلاث مرات مع الشرائح PBS.
- ملون مباين النوى بنسبة 0.1 & Mش؛ ز / مل دابي.
- تحميل الشرائح على coverslips مع وسط مائي مثل VectaMount سائل الإعلام تركيب (أو بأية وسيلة مائي).
6. السيطرة على خصوصية تلوين كتين
- يتم التحكم كتين خصوصية تلطيخ إما عن طريق الانقسام الأنزيمية محددة الهدف غليكان حاتمة قبل تلطيخ أو عن طريق المنافسة مع جزيئات صغيرة.
- الأنزيمية لخمان؛ بلسان أسود الانقسام راصة (SNA) خصوصية ملزمة
- تمييع الفصلاء ureafaciens سياليداز (AUS) إلى 250 MU / مل في 50 ملي الصوديوم الهيدروجيني خلات 5.5.
- إضافة الماء إلى أسفل فارغة بلاغ مربع، وهذا تشكيل غرفة الرطبة خلال الحضانة.
- الشرائح مكان مواجهة على أعلى الدرج طرف بالغرف، طبقة 150-200 ميكرولتر حل AUS على الشريحة والغطاء مع ساترة. تجنب الهواء فقاعة تشكيل.
- إغلاق الغطاء واحتضان مربع في C ° 37 لمدة 2.5 ساعة.
- يغسل ثلاث مرات في الشرائح PBS في غرفة المزاجature لإزالة جميع الأحماض الحرة اللعابي. يجب أن تكون هذه الشرائح السلبية لتلطيخ SNA.
- مثبطات تنافسية للJacalin وsuccinylated القمح الجرثومية راصة خصوصية (sWGA)
- قسامة 200 ميكرولتر من خليط كتين أعدت في الخطوة 5.4 و 2 قارورة إيبندورف.
- أضف 200 ملم مليبيوز (Jacalin المانع) إلى واحدة من قوارير وكيتين حلامة-في التخفيف 01:10 (sWGA المانع) إلى قارورة أخرى.
- تراكب الشرائح المراقبة السلبية مع مثبطات التي تحتوي على خليط واحتضان 1 ساعة في درجة حرارة الغرفة في نفس الوقت كما بقية الشرائح. يجب أن تكون هذه الشرائح السلبية لJacalin أو تلطيخ sWGA، على التوالي.
7. ممثل النتائج
وكشفت المقارنة بين عينات الأنسجة جزءا لا يتجزأ من البارافين في الأنسجة المجمدة لمضمن في البرد حاصن وسائل الإعلام (OCT) فرق صارخ في حفظ وجودة تلطيخ لmuciجليكوبروتينات ن. تلطيخ الأنسجة النسيجية مع الأصباغ، مثل الأزرق وAlcian الدوري شيف حمض، تعطي نتائج مختلفة جدا في أقسام الأنسجة المجمدة أو قابلة للمقارنة من البارافين جزءا لا يتجزأ من العينات (الشكل 1). يبدو أن المذيبات العضوية (الزيلين أو Citrisolv) التي يتم استخدامها خلال عملية التضمين البارافين يؤثر على توزيع mucins يفرز على ظهائر وكذلك إزالة الكثير من السكرية من العينات (الشكل 2). ونتيجة لذلك، وطبقة المخاط يبدو انهارت على خلايا الغشاء المخاطي ويتركز في الخلايا الكأسية. فلاش تجميد الأنسجة في البرد حاصن وسائل الإعلام (OCT) الحفاظ على الماء والحفاظ على عينة طبقة mucins الأبعاد يفرز. عملية التضمين البارافين تتأثر الأخرى المرتبطة المخاط glycans والسكرية بطريقة مماثلة. تم فحص غليكان توزيع باستخدام يكتينس، والتي تستخدم بشكل روتيني للكشف غليكان (الشكل 3) والأجسام المضادة ضد العثور على الحواتمmucins والسكرية (الشكل 6). لأنه غير ملزم كتين محددة جيدا، ويتأثر التوزيع المكاني للglycans فضلا عن هيكل غليكان 14،15، من المهم لتطبيق الضوابط المناسبة لتلطيخ كتين. هنا علينا أن نبرهن طريقتين للسيطرة على تلطيخ كتين على أنسجة اختبار: الانقسام الأنزيمية وتثبيط المنافسة. وقد تم انشقاق من الحواتم غليكان من هضم قسم الأنسجة مع غليكان محددة الانزيمات، على سبيل المثال سياليداز البكتيرية والرقابة على الحامض اللعابي ملزمة SNA (الشكل 4). في الحالات التي يكون فيها انزيم معين (على سبيل المثال غليكوزيداز) غير قابل للإزالة حاتمة غليكان درس، يمكن تأكيد خصوصية كتين بإضافة المانع تنافسية مثل مليبيوز لتلطيخ Jacalin أو كيتين حلامة مقابل تلطيخ sWGA (الشكل 5).
نبين هنا أن عينات الأنسجة الإضافية المجمدة، والتي هي ROUحصلت tinely في العيادة ويمكن في مختبرات الأبحاث، تكون جزءا لا يتجزأ في أكتوبر وأخرى تستخدم لدراسة جليكوبروتينات الميوسين والعديد من glycans الحالية عليها.
| كتين / أب | مصدر | الرئيسية خصوصية |
| LFA | الكسولة فلافس (سبيكة صفراء) | محطة سيا |
| MAA * | Maackia amurensis (آمور Maackia) | Siaα2-3Galβ1-R / 3-O-سلفات على Galβ1-R |
| SNA | خمان؛ بلسان أسود (البلسان نبات) | Siaα2-6Gal / Siaα2-6GalNAc |
| WGA | تريتيكوم الشائع (جرثومة القمح) | GlcNAcβ1-4GlcNAcβ1-4GlcNAc / سيا |
| sWGA | Succinylated الشائع الحنطة (القمح الجرثومية) | GlcNAc وبايتا؛ 1-4GlcNAcβ1-4GlcNAc |
| PNA | hypogaea السوداني (الفستق) | Galβ1-3GalNAc (معدلة T-المستضد) |
| Jacalin | Artocarpus integrifolia (Jacalin) | Galβ1-3GalNAc العثور على O-المرتبطة glycans |
| اللجنة الاقتصادية لأفريقيا | الحمرية cristagalli (كورال شجرة) | Galβ1-4GlcNAc |
| TKH2 | الجسم المضاد | Siaa2-6GalNAc (STN) على O-المرتبطة glycans |
| CA19-9 | الجسم المضاد | Siaa2-3Galβ1-4 (Fuca1-3) GlcNAc (SLE أ) |
| SNH3 | الجسم المضاد | Siaa2-3Galβ1-3 (Fuca1-4) GlcNAc (SLE X) |
الاختصارات: AB، الأجسام المضادة، سيا، الحامض اللعابي؛ غال، سكر اللبن؛ GalNAc،
الجدول 1. A قائمة جزئية من يكتينس والأجسام المضادة لالحواتم غليكان.
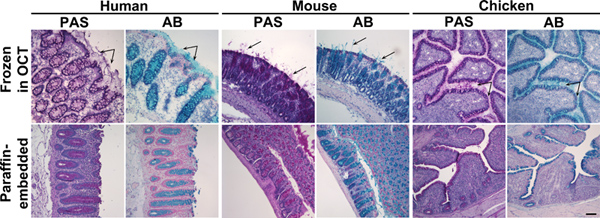
الشكل 1. كانت ملطخة زرقة الألسيان وتلطيخ شيف الدوري للأنسجة القولون حمض المجمدة وجزءا لا يتجزأ من البارافين. أقسام الأنسجة من الماوس، أو العينات البشرية القولون الدجاج المجمد في أكتوبر (اللوحة العليا) جزءا لا يتجزأ من البارافين أو (اللوحة السفلى) مع حمض شيف الدوري (PAS) أو زرقة الألسيان (AB). هذه الكواشف وصمة عار المخاط الوردي أو الأزرق، على التوالي. اللوحة العليا: في الأنسجة المجمدة، بالإضافة إلى mucins في الخلايا الكأسية، كان مخفي المخاط أيضا فيماible (الأسهم). اللوحة السفلى: في البارافين جزءا لا يتجزأ من الأنسجة، اقتصر تلطيخ المخاط إلى الخلايا الكأسية. كانت counterstained نوى مع Surgipath (PAS) أو الهيماتوكسيلين ماير (AB). شريط مقياس يشير إلى 100 ميكرون. اضغط هنا لمشاهدتها بشكل اكبر شخصية .

الشكل 2. النتائج كانت ثابتة في الحضانة Citrisolv خسارة كبيرة في mucins. أقسام المسلسل من العينات المجمدة الدجاج الدقاق في 10٪ مخزنة الفورمالين وأبقى رطب (اللوحة اليسرى)، المجففة في الإيثانول من الحضانة متتابعة في 70٪، 90٪ والإيثانول بنسبة 100٪ لمدة 20 دقيقة كل (لوحة الأوسط)، أو المجففة في الإيثانول وتطهيرها مع Citrisolv ل1 ساعة (اللوحة اليمنى). وميهت عينات المجففة إلى PBS قبل hematoxylin و eosin (H & E) أو تلطيخ الأزرق Alcian. الجفاف الإيثانول وتحسين تبادل المعلومات Citrisolv مور الأنسجةphology (على سبيل المثال، الصف العلوي والصور الأوسط والحق مقابل الصورة إلى اليسار). كان الجفاف الإيثانول أي تأثير كبير على تلطيخ الأزرق Alcian (الصف الأوسط، قارن الصور اليسار والوسط). في المقابل، خفضت Citrisolv الحضانة تلطيخ الأزرق Alcian ويقتصر على الخلايا الكأسية (الصف الأوسط، الصورة الصحيحة) في النمط الذي كان شبيهة بتلك التي شوهدت في الأنسجة جزءا لا يتجزأ من البارافين، (الشكل 1). هذه البيانات تعني أن تلطيخ قوية من حبيبات المخاط في عينات-البارافين جزءا لا يتجزأ من المقرر أن تتقلص والتكثيف من المخاط في الخلايا الكأسية خلال خطوة المقاصة. وتلطيخ خفوتا وأقل كثافة من المخاط في الأنسجة المجمدة جزءا لا يتجزأ من OCT-يعكس توزيع أكثر من المخاط الطبيعي في الأنسجة. يتم وضع علامة أعلى من المجالات تكبير محاصر مع السهام. تشير على نطاق والحانات 50 ميكرومتر (الصفوف العليا والمتوسطة) و 10 ميكرون (الصف السفلي).

الشكل 3. الملزمة لليكتينس لالحواتم غليكان على الأنسجة المجمدة وجزءا لا يتجزأ من البارافين. الدجاج الصغيرة الأمعاء (اللفائفي) العينات المجمدة في أكتوبر (وحات العليا) جزءا لا يتجزأ من البارافين أو (أقل وحات) تم بحث مع Jacalin (الأزرق)، sWGA (الخضراء) وSNA (أحمر ). يتم وضع علامة أعلى من المجالات تكبير محاصر مع السهام. في الأنسجة المجمدة كشفت Jacalin ملزمة لO-glycans المرتبطة الهياكل التي يبدو أن ناز من الخلايا الكأسية في التجويف (Jacalin، اللوحة العليا، السهام). في المقابل، اقتصرت Jacalin ملزمة للأنسجة، جزءا لا يتجزأ من البارافين إلى الخلايا الكأسية (Jacalin، اللوحة السفلى والسهام) وإلى الحدود فرشاة الزوائد (الصورة أسفل اليسار، السهم). sWGA تلطيخ من 4GlcNAc-β1 جزئيا شارك في ترجمة مع الربط من كتين Jacalin في كل الأنسجة المجمدة (اللوحة العليا، السهام)، وجزءا لا يتجزأ من البارافين في الأنسجة (اللوحة السفلى، السهام). في المقابل، SNA كتين ملزمة للأحماض α2-6 اللعابي مرتبط داخل الخلايا (SNA، رؤوس سهام)، وشارك في لا حصر مع Jacalin (لونتميز الصورة، SNA في رأس السهم الأحمر مع، Jacalin في الزرقاء التي تحمل علامة سهم منقط). تشير على نطاق والحانات 100 ميكرون (الصور اليسرى) و 20 ميكرون (المناطق محاصر تضخيم).

الشكل 4. وحضنت الأنزيمية للتحكم الانقسام تلطيخ مع الحامض اللعابي SNA. عينات الدجاج الأمعاء الدقيقة مع 250 MU / مل الفصلاء ureafaciens سياليداز (AUS) أو خلات الصوديوم مع 50 ملي العازلة 5،5 درجة الحموضة لمدة 2.5 ساعة في C. ° 37 AUS العلاج يلغي تلطيخ مع SNA المعقدة البيروكسيديز، مؤكدا SNA خصوصية ملزمة للأحماض اللعابي. شريط مقياس يشير إلى 100 ميكرون.

الشكل 5. وحضنت تنافسية السيطرة تثبيط لتلطيخ غليكان مع Jacalin وsWGA. الدجاج الصغيرة الأمعاء (اللفائفي) العينات مع خليط Jacalin وsWGA في وجود LEC محددةمثبطات القصدير: مليبيوز (العمود الأوسط)، كيتين، حلامة (العمود الأيمن) أو بدون المانع (A و D). لوحة العلوي: (يسار) Jacalin تلطيخ دون مثبطات. وقد منعت (وسط) من قبل مليبيوز Jacalin تلطيخ. (يمين) لم كيتين، لا تمنع حلامة Jacalin تلطيخ. اللوحة السفلى: (يسار) sWGA تلطيخ دون المانع. (وسط) لم مليبيوز لا تمنع sWGA تلطيخ. (يمين) وتحول دون تلطيخ sWGA من الكيتين، حلامة. هذا يؤكد تثبيط التفاعل مع يكتينس معينة من الأنسجة. العلامات النجمية علامة صورة تثبيط تلطيخ. شريط مقياس يشير إلى 100 ميكرون.

الشكل 6. الكشف عن mucins إفرازية، والسكرية الحواتم غليكان في الأنسجة البشرية المجمدة سرطان القولون والمستقيم. كانت الخزعات سرطان القولون والمستقيم سرطان الزغابي من سرطان المخاطية والأداة الإضافية المجمدة في النيتروجين السائل والمدمجة في أكتوبر وحضنت المقاطع النسيجية لمدة 1 ساعةمع الأجسام المضادة ضد الميوسين يفرز MUC5AC، sialyl لويس - غليكان حاتمة العثور على gangliosides (سرطان القولون والمستقيم علامة CA 19-9)، وsialyl-TN - وفرة غليكان حاتمة على mucins (الكشف عن الأجسام المضادة مع TKH2)، تليها الحضانة 30 دقيقة مع الأجسام المضادة مفتش المعقدة البيروكسيديز حمار مكافحة الماوس الثانوي، و 30 حضانة دقيقة مع البيروكسيديز، مترافق streptavidin. وحضنت أنسجة إضافية لمدة 1 ساعة مع SNA يكتينس المعقدة البيروكسيديز وsWGA، تليها الحضانة 30 دقيقة مع البيروكسيديز، مترافق streptavidin. وقد وضعت تلطيخ البيروكسيديز باستخدام عدة AEC. شريط أسود يشير مقياس 200 ميكرومتر.
Discussion
الحفاظ على المخاط والحواتم غليكان في الأنسجة المجمدة أعلى من الأنسجة التي تم تضمينها في البارافين. أثبتنا الحفاظ على طبقة مخاط (الشكلان 1 و 3) وتوزيع الهياكل glycans الثلاثة (الشكل 3) في الأنسجة المجمدة مقارنة مع الأنسجة البارافين، جزءا لا يتجزأ من. مثبتات المتخصصة، مثل حل Carnoy ل(الإيثانول 60٪، 30٪ كلوروفورم، وحامض الخليك 10٪) وضعت 17 لحفظ الأمثل للطبقة المخاط في عينات الأنسجة. على النحو الأمثل، يجب استخدام هذا الحل لجمع عينات من الأنسجة التي هي مخصصة للدراسات المخاط، وتبين للحفاظ على المظهر الناعم للطبقة المخاط 16-17. طبقة المخاط في العينات المجمدة جزءا لا يتجزأ من غير المثبت في أكتوبر الوعرة ويظهر في بعض المناطق قد فصل من الأنسجة، ولكن سمك الطبقة العامة ما يتفق مع تلك التي لوحظت في الأنسجة التي تم إصلاحها مع حل Carnoy وembeddإد في البارافين 16-17. على سبيل المثال، طبقة المخاط في المجمدة الإنسان القولون هو الجزء الأنسجة ~ 100 ميكرون (الشكل 1)، والذي هو ضمن نطاق الإبلاغ عن Carnoy's الثابتة عينة القولون الإنسان 55،4 ± 2.5 ميكرومتر (المدى 7،7 حتي 204،8 ميكرومتر) 16.
وقد كان من المعروف منذ عشرات السنين أن نتائج الجفاف في الإيثانول ~ انكماش 30٪ من العينات البيولوجية 18، والتي المذيبات العضوية مثل الزيلين، والدهون Citrisolv استخراج كلوروفورم، والسكرية، إلى حد ما، والبروتينات من الأنسجة 13. معالجة الأنسجة لتضمين البارافين يتضمن الخطوات التالية: تثبيت (10٪ مخزنة الفورمالين)، والجفاف (زيادة تركيز الإيثانول)، والمقاصة (Citrisolv أو الزيلين). عن طريق محاكاة هذه الخطوات على غير المثبتة أقسام الأنسجة المجمدة، أثبتنا أن Citrisolv مقتطفات من المخاط أقسام الأنسجة المجمدة مما أدى إلى مورفولوجيا الأنسجة التي هي مماثلة لتلك الأنسجة، جزءا لا يتجزأ من البارافين (الارقام ..ه 2، اللوحة اليمنى). في المقابل، لم يتم تغييرها طبقة المخاط من الحضانة مع الفورمالين أو الإيثانول (الشكل 2، يسار ووسط لوحات). هذا يشير إلى أن الخطوة المقاصة على مستوى الإجراء تضمين البارافين، الأمر الذي يتطلب فترة طويلة في الحضانة Citrisolv / الزيلين، والنتائج في انهيار طبقة المخاط. تثبيت الفورمالين لا تضر بطبقة المخاط والمجمدة أقسام الأنسجة التي تم إصلاحها مع الفورمالين يمكن بسهولة أن ملطخة يكتينس والأجسام المضادة ضد السكرية، glycans والبروتينات (أرقام 2 و 3 و 6). قد تكون هذه الآثار تافهة لدراسة غشاء محدد البروتينات والأنسجة علم الأمراض، لكنها مدمرة للهياكل رطب للغاية مثل طبقة المخاط يفرز. وتجرى الدراسات النسيجية لا تزال مع ذلك من mucins في الغالب مع عينات جزءا لا يتجزأ من البارافين، والتي طبقة المخاط المحافظة هو دون المستوى الأمثل. في عمق التحليلات تكوين طبقة المخاط مثل هوية الدقيق لذاتهcreted أو غشاء محدد بروتين سكري تركيبات الأجسام المضادة تتطلب MUC محددة وقياس الطيف الكتلي لتحديد العمود الفقرى البروتين. الحفاظ على طبقة المخاط ولكن شرط أولي لمثل هذه الدراسات.
مختبرات العديد من عينات الأنسجة المجمدة في أكتوبر التي تم جمعها في الماضي لمشاريع مختلفة، ويمكن استخدامها بسهولة هذه الأنسجة لدراسة mucins، السكرية وتوزيع غليكان مما يلغي الحاجة لجمع الأنسجة في مثبتات خاصة التي تم تصميمها بشكل فريد لحفظ المخاط. الأنسجة المجمدة تخضع لمعالجة الحد الأدنى، وبالتالي فإن التوزيع الطبيعي من glycans، والتي هي في الطبيعة المائية، والحفاظ عليها و. هذا مهم بشكل خاص في مجال الجراثيم في استضافة التفاعلات. ومعرفة توزيع طبيعي وفرة من mucins يفرز والهياكل غليكان العديد من تزيين هذه "الحاجز" الجزيئات تكون المفتاح لفهم دفاع المضيف، والاستغلال الميكروبية وpathogenesهو.
Disclosures
الإعلان عن أي تضارب في المصالح.
Acknowledgments
فإن الكتاب أود أن أشكر نيكول M. نيميث (جامعة جورجيا) وجين M. معرض (LANL) لمساعدتهم في حصاد الأنسجة الدجاج، وستيفن A. سبرينغر لمساعدته أثناء التصوير. كان رعاية جميع الطيور في هذه الدراسة وفقا للمعاهد القومية للصحة المبادئ التوجيهية لاستخدام الحيوانات المختبرية الإنسانية للجميع والبروتوكولات وافق عليها رعاية الحيوان المؤسسية واللجان الوطنية في استخدام لوس ألاموس الأمن، LLC، مشغل لوس ألاموس المختبر الوطني بموجب العقد رقم DE-AC52-06NA25396 مع وزارة الطاقة في الولايات المتحدة. رعاية الفئران في هذه الدراسة هو في الامتثال لبروتوكول جامعة كاليفورنيا سان دييغو الحيوان المعتمدة. تم الحصول على الأنسجة البشرية كجزء من بروتوكول جامعة كاليفورنيا سان دييغو IRB المعتمدة. وأيد هذا العمل من قبل منحة من جامعة 118645 رسوم كاليفورنيا مختبر رئيس برنامج (PG) وNS047101 منحة من المعهد الوطني للاضطرابات العصبية والسكتة الدماغية (علم الأعصاب الميكروسكوب مرفق مشترك، جامعة كاليفورنيا في سان دييغو).
Materials
| Name | Company | Catalog Number | Comments |
| 2-methyl butane | Fisher Scientific | 03551-4 | |
| AEC peroxidase substrate kit | Vector Labs | SK-4200 | |
| Alcian Blue | Sigma-Aldrich | A3157 | |
| Anti-CA 19-9 monoclonal antibody | Calbiochem | CA1003 | |
| Anti-MUC5AC monoclonal antibody | Millipore | MAB2011 | |
| Avidin-Biotin blocking kit | Vector Labs | SP-2001 | |
| Biotinylated donkey anti-mouse antibody | Jackson Immunoresearch | 90863 | |
| Biotinylated SNA | Vector Labs | B-1305 | |
| Bovine serum albumin | Sigma-Aldrich | A4503 | |
| Chitin-hydrolysate | Vector Labs | SP-0090 | |
| Cryostat microtome | Leica Microsystems | Leica CM 1800 | |
| Hematoxylin | Surgipath Medical Ind. | 3801570 | |
| Hydrogen peroxide 30% | Fisher Scientific | H325-100 | |
| Jacalin-FITC | Vector Labs | FL-1151 | |
| Mayer's Hematoxylin | Sigma-Aldrich | MHS32 | |
| Melibiose | Sigma-Aldrich | M5500 | |
| Nuclear Fast Red | Vector Labs | H-3403 | |
| OCT compound | VWR International | 25608-930 | |
| Peroxidase conjugated streptavidin | Jackson Immunoresearch | 94638 | |
| Schiff reagent | Electron microscopy sciences | 26052 | |
| sWGA-Rhodamine | Vector Labs | RL1022S | |
| TKH2 monoclonal antibody | ATCC | HB-9654 | |
| VectaMount aqueous mounting media | Vector Labs | H-5501 | |
| Cytoseal 60 | Thermo Scientific | 8310-4 | |
| Peel-A Way molds | Polysciences Inc. | 18646A-1 |
References
- Slayter, H. S., Wold, J. K., Midtvedt, T. Intestinal mucin of germ-free rats. Biochemical and electron-microscopic characterization. Carbohydr. Res. 222, 1-9 (1991).
- Lamblin, G. The carbohydrate diversity of human respiratory mucins: a protection of the underlying mucosa. Am. Rev. Respir. Dis. 144, S19-S24 (1991).
- Corfield, A. P., Carroll, D., Myerscough, N., Probert, C. S. Mucins in the gastrointestinal tract in health and disease. Front. Biosci. 6, D1321-D1357 (2001).
- Turner, J. R. Intestinal mucosal barrier function in health and disease. Nat. Rev. Immunol. 9, 799-809 (2009).
- Lievin-Le Moal, V., Servin, A. L. The front line of enteric host defense against unwelcome intrusion of harmful microorganisms: mucins, antimicrobial peptides, and microbiota. Clin. Microbiol. Rev. 19, 315-337 (2006).
- Kim, Y. S., Ho, S. B. Intestinal goblet cells and mucins in health and disease: recent insights and progress. Curr. Gastroenterol. Rep. 12, 319-330 (2010).
- Nochi, T., Kiyono, H. Innate immunity in the mucosal immune system. Curr. Pharm. Des. 12, 4203-4213 (2006).
- Vareille, M., Kieninger, E., Edwards, M. R., Regamey, N. The airway epithelium: soldier in the fight against respiratory viruses. Clin. Microbiol. Rev. 24, 210-229 (2011).
- McGuckin, M. A., Linden, S. K., Sutton, P., Florin, T. H. Mucin dynamics and enteric pathogens. Nat. Rev. Microbiol. 9, 265-278 (2011).
- Knowles, M. R., Boucher, R. C. Mucus clearance as a primary innate defense mechanism for mammalian airways. J. Clin. Invest. 109, 571-577 (2002).
- Johansson, M. E. The inner of the two Muc2 mucin-dependent mucus layers in colon is devoid of bacteria. Proc. Natl. Acad. Sci. U.S.A. 105, 15064-15069 (2008).
- Hooper, L. V., Macpherson, A. J. Immune adaptations that maintain homeostasis with the intestinal microbiota. Nat. Rev. Immunol. 10, 159-169 (2010).
- Hayat, M. A. Microscopy, Immunohistochemistry, and Antigen Retrieval Methods: For Light and Electron Microscopy. Hayat, M. A. , Kluwer Academic/Plenum Publishers. New York, NY. 53-70 (2002).
- Cohen, M., Hurtado-Ziola, N., Varki, A. ABO blood group glycans modulate sialic acid recognition on erythrocytes. Blood. 114, 3668-3676 (2009).
- Cohen, M., Varki, A. The sialome--far more than the sum of its parts. OMICS. 14, 455-464 (2010).
- Ota, H., Katsuyama, T. Alternating laminated array of two types of mucin in the human gastric surface mucous later. Histochemical J. 24, 86-92 (1992).
- Matsuo, K., Ota, H., Akamatsu, T., Sugiyama, A., Katsuyama, T. Histochemistry of the surface mucous gel layer of the human colon. Gut. 40, 782-789 (1997).
- Boyde, A., Maconnachie, E. Treatment with lithium salts reduces ethanol dehydration shrinkage of glutaraldehyde fixed tissue. Histochemistry. 66, 181-187 (1980).



