Summary
嵌入在的最优切削温度介质(OCT)的未定影的冰冻组织标本可用于研究自然分布和糖基化的分泌粘液。在这种方法中组织处理是最小的,自然呈现的糖脂,粘蛋白和糖基表位被保留。组织切片,可以用荧光或发色检测用免疫组织化学分析。
Abstract
粘蛋白是复杂的,高度糖基化的O-连接的糖蛋白,其中含有超过70%的碳水化合物,按重量计1-3。杯状细胞及胃黏膜分泌的粘蛋白,产生的脚手架,提供一个微米厚的粘液层的上皮细胞,肠道和呼吸道3,4线。在除了粘蛋白,粘液层还含有抗微生物肽,细胞因子,和免疫球蛋白5-9。粘液层是宿主先天免疫的重要组成部分,形成第一线的防御入侵的微生物8,10-12。 ,粘液是受到众多与微生物的相互作用,这些相互作用,病原体和共生体,分泌的黏蛋白形成的一个重要接口。这种生物的相互作用的研究通常需要组织收集和染色的组织方法。最常用的两种组织学方法组织收集和preserv的ATION在临床和研究实验室:福尔马林固定,石蜡包埋组织冷冻,然后嵌入在冷冻保护媒体。
石蜡包埋组织样本的部分进行组织学可视化与最佳的品质,包括清晰和明确的形态。然而,在石蜡包埋过程中的一些改变,为了研究这些抗原决定簇的抗原表位成为许多表位检索方法13与一个被进一步处理,组织切片。分泌的粘蛋白和类脂物进行石蜡包埋的结算步骤,该步骤需要延长孵育与有机溶剂(二甲苯或Citrisolv)的过程中从组织中提取的。因此,这种方法是次优的研究着眼于在体内的粘蛋白和粘液的性质和分布。
相反,最佳切削温度的冷冻组织包埋剂(OCT)一导致脱水和清洁的样品,并保持样品水化。这允许更好的保存水合粘液层,并由此允许的粘蛋白在上皮生物学研究的许多角色。由于这种方法需要最少的处理的组织,该组织被保留在一个更自然的状态。因此冻结的组织部分并不需要任何额外的处理,染色前,可以很容易地使用免疫组织化学方法分析。
我们展示了保存在冷冻结肠癌样本微米厚的分泌粘液层。急剧减少时,该层被相同的组织包埋在石蜡中。我们还演示了用植物凝集素上粘蛋白的糖链抗原表位的免疫荧光染色。这种方法的优点是,它不要求使用特殊的固定剂,并允许利用冷冻组织,可能已经被保留在实验室。
Protocol
1。组织包埋在OCT
- 准备的冷冻浴添加干冰,2 - 甲基丁烷,在一个浅的聚苯乙烯泡沫塑料方块。
- 收获的组织,并轻轻受潮上过量的液体干燥的薄棉纸。如果使用卡扣冰冻组织(组织在液氮中冷冻的),允许该组织升温至-20℃下,通过将其放置在冷冻切片机室。
- 添加少量OCT皮尔-A路冻结的模具,就足以覆盖模具底部。
- 组织放置在模具中,确保组织休息的模具的底部上,在所需的取向。冻结后,将组织块切片从底部或从侧面。
- 覆盖的组织与华侨城的凝固浴中,将模具。 OCT化合物会变成白色组织冻结。
- 一旦冻结,剥离模具关闭冻结块和一个显着的冷冻袋。
- 将冷冻的块可以被保持在-80℃下直至使用。
2。组织切片
- 将组织块冷冻切片机室,并让他们达到-20°C(约30分钟)。
- 剪切3-5微米厚的部分,放置一个带正电荷的该部分顶部的玻璃上滑动。该组织将坚持以幻灯片。
- 风干的组织30-60分钟。
- 的幻灯片可以在此阶段使用,或者它们可被保持在-80℃下以供将来使用。
3。组织切片染色
- 相片数被储存在-80°C允许在幻灯片解冻和空气干燥,在室温下30分钟。
- 修复的幻灯片,用10%福尔马林缓冲液中,在室温下的30分钟。
- 在PBS或TBST缓冲液洗三次,每次洗涤蘸幻灯片250毫升缓冲液中的10倍。 PBS缓冲液中,可用于免疫荧光染色,但是,显色检测碱性磷酸酶conjugated抗体,TBST应该使用,因为在PBS磷酸盐,抑制碱性磷酸酶的活性。
- 现在已准备好被染色组织切片幻灯片。
4。使用检测粘液组织化学污渍如阿尔辛蓝和碘酸雪夫
- 阿尔新蓝染色:
- 冲洗在水中滑动,为3分钟,在室温下孵育3%乙酸中。
- 色斑与经Alcian Blue pH 2.5的溶液,在室温下30分钟。
- 自来水洗净幻灯片10分钟,在去离子水冲洗。
- 在核固红染液在室温下5分钟。
- 洗涤滑动三次,在去离子水中。
- 碘酸雪夫染色:
- 冲洗水的滑动,在新鲜制备的1%高碘酸5分钟孵育。
- 在去离子水清洗三次,蘸一次在miliQ水。
- Schiff试剂染色15分钟,在室温气温E。
- 自来水洗净幻灯片10分钟,在去离子水冲洗。
- 染液在Surgipath苏木精,持续30秒,在室温下。
- 洗涤滑动三次,在去离子水中。
- 孵育滑动scott的自来水中,在室温下30秒。
- 在DI水洗涤三次。
- 脱水和清除通过温育1分钟,然后在95%乙醇由[3]在100%乙醇中快速变化,3在Citrisolv变化,每次2分钟,滑动。所有在室温下。
- 挂载盖玻片与树脂介质(Cytoseal 60)上滑动。
5。使用外源凝集素组织化学方法检测糖链抗原表位的抗体(表1)
- 用于荧光检测的3使用外源凝集素的糖链抗原表位,则阻止该幻灯片,用1%BSA的PBS在室温下10-30分钟。
- 由于使用生物素标记的凝集素,温育15分钟,用0.1%阻断内源性生物素抗生物素蛋白,随后在室温下用0.01%的生物素孵育15分钟。
- 中的幻灯片PBS洗净后每个阻挡步骤。
- 新鲜制备的混合物的1微克/毫升罗丹明共轭 琥珀酰化小麦胚芽凝集素(sWGA),1.3μg/ ml的生物素化的西洋接骨木凝集素(SNA)和5微克/毫升的荧光素共轭的Jacalin HEPES / NaCl缓冲液(10mM的HEPES, 150mM NaCl的pH为7.5)。
- 将平坦的表面上滑动,或在染色方块,以及层之上的外源凝集素的混合物。该混合物的体积可减少轻轻放置在液体石蜡膜,石蜡膜变平的液体和防止蒸发。
- 在黑暗中在室温下孵育1小时。
- 用PBS洗涤滑动三次。
- 层幻灯片用0.7μg/ ml的链霉抗生物素蛋白共轭CY5(来检测生物素化-SNA),并在黑暗中在室温下孵育30分钟。
- 用PBS洗涤滑动三次。
- 染液核0.1Μ克/毫升DAPI。
- 如VectaMount安装媒体(或任何含水介质)与水性介质挂载盖玻片上滑动。
6。控制外源凝集素染色特异性
- 外源凝集素染色的特异性控制或者由特定的酶裂解目标聚糖抗原决定簇染色前或小分子的竞争。
- 西洋接骨木凝集素(SNA)结合特异性的酶裂解
- 稀释: 节杆菌ureafaciens唾液酸酶(AUS)250亩/毫升50mM醋酸钠pH值5.5。
- 加水至一个空尖盒的底部,这将形成一个潮湿的孵化室中。
- 广场的幻灯片面对的顶部托盘的头箱,层150-200微升AUS解决方案,在幻灯片上,并盖上盖玻片。避免气泡的形成。
- 关闭盒盖,在37°C孵育2.5小时。
- 洗涤滑动三次在PBS中,在室温脾气ATURE,删除全部免费唾液酸。这些幻灯片应该是否定的SNA染色。
- 竞争性抑制剂jacalin所和琥珀酰麦胚凝集素(sWGA)特异性
- 等分200μl的外源凝集素的混合物的制备在步骤5.4至2的Eppendorf小瓶。
- 加入200mM的蜜二糖(jacalin所抑制剂)一个小瓶和几丁质水解物的1:10稀释液(sWGA抑制剂)其他小瓶。
- 叠加阴性对照幻灯片与抑制剂的混合物中,并在室温下孵育1小时,作为在幻灯片的其余部分在同一时间。这些幻灯片应该是否定的,分别为jacalin所或sWGA染色。
7。代表性的成果
嵌入石蜡冷冻组织嵌入在冷冻保护媒体(OCT)的组织样本之间的比较发现显着的差异,在保存和质量的染色穆齐Ň糖蛋白。组织化学染料的染色,如阿尔新蓝和碘酸雪夫,产生非常不同的结果,在可比的组织切片冷冻或石蜡包埋标本( 图1)。出的有机溶剂(二甲苯或Citrisolv的)期间所使用的石蜡包埋过程影响上皮细胞分泌的粘蛋白上的分布,以及除去大部分从样品( 图2)的糖脂。因此,出现粘液层倒塌的粘膜细胞和杯状细胞主要分布在。组织冷冻保护媒体的Flash冻结(OCT)保持样品的水化和保存分泌的粘蛋白层尺寸。石蜡包埋过程中以类似的方式影响到其他相关的粘液聚糖和糖脂。聚糖分布,检查使用的外源凝集素,这是常规用于糖链的检测( 图3)和上发现的抗原表位的抗粘蛋白和糖脂( 图6)。由于凝集素结合不能很好定义和聚糖以及聚糖结构14,15的空间分布的影响,重要的是应用适当的外源凝集素染色的控制。在这里,我们展示了两种方法的测试组织,控制外源凝集素染色:酶裂解和竞争性抑制。聚糖抗原表位的裂解是通过消化组织切片与聚糖特异性酶,例如细菌的唾液酸酶唾液酸结合由SNA( 图4)作为对照。在特定的酶的情况下( 如糖苷酶),不提供用于除去聚糖表位研究,外源凝集素的特异性,可以确认通过添加如蜜二糖jacalin所染色或的甲壳素水解产物为sWGA染色( 图5)的竞争性抑制剂。
我们在这里展示,快速冷冻的组织样本,这是柔tinely中获得的临床和研究实验室,可以进一步嵌入式OCT用于研究粘蛋白的糖蛋白和多聚糖存在于他们。
| 外源凝集素/抗 体 | 源 | 主要特异性 |
| LFA | 蛞蝓黄曲霉菌 (黄蛞蝓) | 终端死啊 |
| MAA * | 怀槐 (阿穆尔怀) | Siaα23Galβ1-R / 3-O-硫酸在Galβ1-R |
| SNA | 西洋接骨木 (接骨木) | Siaα26Gal /Siaα26GalNAc |
| WGA | 小麦柏 (小麦胚芽) | GlcNAcβ14GlcNAcβ1-4GlcNAc / SIA |
| sWGA | 的琥珀小麦寻常 (小麦胚芽) | 葡萄糖&BETA 14GlcNAcβ14GlcNAc |
| PNA | 花生 (花生) | Galβ13GalNAc(未修改T-抗原) |
| jacalin所 | 白桂integrifolia(jacalin所) | Galβ13GalNAc发现O-聚糖 |
| ECA | :刺桐cristagalli(珊瑚树) | Galβ1-4GlcNAc |
| TKH2 | 抗体 | Siaa2-O-聚糖6GalNAc(STN) |
| CA19-9 | 抗体 | siaa2-3Galβ1-4(FUCA1-3)的GlcNAc(SLE 一个 ) |
| SNH3 | 抗体 | siaa2-3Galβ1-3(FUCA1-4)GlcNAc的(SLE x) |
缩写:抗体 ,抗体; SIA,唾液酸半乳糖 ,半乳糖, 半乳糖胺 ,
表1。聚糖抗原决定簇的外源凝集素和抗体的部分列表。
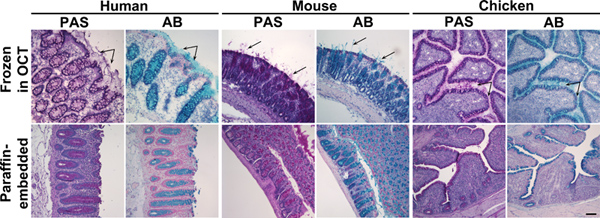
图1。经Alcian Blue和碘酸雪夫冷冻和石蜡包埋的结肠组织染色。冻结在OCT(上面板),或嵌入在石蜡(下面板)的人,小鼠或鸡结肠标本的组织切片进行染色与碘酸雪夫(PAS)或经Alcian Blue(AB)。这些试剂染色粉红色或蓝色粘液。上面板:在冷冻组织,除了杯状细胞的粘蛋白在,分泌粘液也对IBLE(箭头)。下图:在石蜡包埋组织仅限于杯状细胞,粘液染色。核复染与Surgipath(PAS)和迈耶(AB)苏木。比例尺显示为100微米。 点击此处查看大图 。

图2。 citrisolv孵育的查询结果的粘蛋白上的重大损失。冷冻鸡肉回肠标本的连续切片固定在10%福尔马林缓冲液中,并保持水合(左面板),在乙醇中脱水,在70%,90%和100%乙醇通过顺序孵育20分钟(中间面板),或在乙醇脱水,清除与Citrisolv为1小时(右图)。脱水复水回PBS之前苏木精和曙红(H&E)或阿尔辛蓝染色。的乙醇脱水和Citrisolv的结算改进的组织铁道部phology( 例如 ,顶行,中间和右图像相对于左图像)。乙醇脱水了爱茜蓝染色(中间行中,比较左眼图像和中间图像)没有显着的影响。相反,Citrisolv孵育减少经Alcian Blue染色和密闭杯状细胞(中间行,右图像)的图案中,石蜡包埋的组织( 图1)中所看到的类似的。这些数据意味着,强染色的石蜡包埋标本中的粘液颗粒是由于粘液的杯状细胞的收缩和凝结在清除步骤。在冰冻的OCT包埋组织反映较暗和较不密集的染色粘液的粘液组织中的分布更自然的。标有箭头的放大倍率越高,盒装地区。比例尺表示为50μm(顶部和中间行)和10微米(底行)。

图3。结合外源凝集素糖链抗原表位的冰冻和石蜡包埋组织在OCT(上图)。鸡小肠(回肠)标本冷冻或石蜡包埋(下图),探讨与jacalin所(蓝色)sWGA的(绿色)和SNA(红)。标有箭头的放大倍率越高,盒装地区。在冷冻组织jacalin所透露的结构O-聚糖结合,出现渗出杯状细胞进入管腔(jacalin所,上图,箭头所示)。相比之下,jacalin所结合石蜡包埋组织局限于杯状细胞(jacalin所,下面板,箭头)和绒毛刷状缘(底部左图像,箭头)。 sWGA染色β1-4GlcNAc部分共同定位jacalin所结合的外源凝集素与在两个冷冻组织(上面板,箭头),并在石蜡包埋组织(低级面板,箭头)。相比之下,SNA凝集素结合的α2-6链接唾液酸是细胞内的(SNA,箭头),并且不共同本地化jacalin所(彩色图像,SNA中红色标记的箭头,jacalin所在蓝色标示虚线箭头)。比例尺表示100微米(左侧图像)和20微米(放大盒装区域)。

图4。 250亩/毫升, 节杆菌ureafaciens唾液酸酶(AUS),或50mM醋酸钠pH 5.5的缓冲液为2.5小时,在37℃, 酶裂解SNA的唾液酸染色与控制。鸡的小肠标本培养AUS治疗废除与生物素SNA染色,证实SNA唾液酸结合特异性。比例尺显示为100微米。

图5。在存在特定的液封直拉法, 竞争性抑制控制用于 聚糖染色jacalin所和sWGA。鸡小肠(回肠)标本用jacalin所和sWGA混合物孵育锡抑制剂:蜜二糖(中柱),几丁质水解产物(右列)或无抑制剂(A,D)。上图:(左)无抑制剂的jacalin所染色。 (中心)jacalin所“染色抑制蜜二糖。 (右)几丁质水解物不抑制jacalin所染色。下图:(左)无抑制剂的sWGA染色。 (中心),蜜二糖没有抑制sWGA染色。 (右)sWGA染色抑制几丁质水解产物。这种抑制作用确认与组织中的外源凝集素的特异性相互作用。星号标记的染色抑制图像。比例尺显示为100微米。

图6。检测分泌的粘蛋白,糖脂和冷冻人结直肠癌组织中的糖链抗原表位。大肠癌的活检,从绒毛癌和粘液癌快速冷冻在液氮中,并嵌入在OCT。组织切片,温育1小时抗分泌的粘蛋白MUC5AC,唾液酸基路易斯一个 - 聚糖抗原表位发现神经节苷脂(大肠癌标记CA 19-9),唾液酸-Tn的 - 丰富聚糖上粘蛋白(检测与TKH2抗体)的抗原表位,其次是30分钟孵育生物素化的驴抗小鼠IgG抗体的第二抗体,并与过氧化物酶结合的链霉抗生物素蛋白孵育30分钟。额外的组织,温育1小时,随后孵育30分钟,用过氧化物酶结合的链霉抗生物素蛋白与生物素化凝集素SNA和sWGA的。过氧化物酶染色的开发使用AEC套件。黑色比例尺表示200微米。
Discussion
优于石蜡包埋的组织保存在冷冻组织的粘液和聚糖抗原决定簇。我们证明分泌粘液层( 图1和图3)和三聚糖结构的分布( 图3)相比,石蜡包埋组织的冷冻组织的保存。专门固定剂,如卡诺溶液(60%乙醇,30%氯仿,10%乙酸)17已经开发了用于在组织样本的粘液层的最佳保存。理想情况下,这种解决方案应该被用来收集组织样品,专用于粘液研究,结果表明,以保留粘液层16-17的平滑的外观。不固定的冷冻样品中的粘液层出现在OCT嵌入坚固耐用,在某些地区可能脱离组织,但总体层的厚度是一致的卡诺的解决方案,内含的固定的组织中观察到的ED的石蜡16-17。例如,在冷冻的人结肠癌组织切片的粘液层〜100微米( 图1),这是报告为Carnoy's固定人结肠癌样品55.4±2.5微米(范围7.7 - 204.8微米)16的范围内。
人们已经知道了几十年,在生物样品的收缩率18〜30%,并且,有机溶剂,如二甲苯,Citrisolv和氯仿提取物脂质,糖脂,并在一定程度上,从组织13的蛋白质的乙醇脱水结果。石蜡包埋的组织处理包括以下步骤:固定(10%福尔马林缓冲液中),脱水(乙醇浓度增加),和结算(Citrisolv或二甲苯)。通过模仿这些步骤不固定的冰冻切片中,我们发现Citrisolv提取粘液冰冻切片组织形态类似的石蜡包埋组织(FIGURE 2,右图)。与此相反,在粘液层并没有改变培养用福尔马林或乙醇( 图2中 ,左侧和中心板)。这表明,标准的石蜡包埋程序的清除步骤,这需要长时间培养在Citrisolv /二甲苯,粘液层的崩溃的结果。福尔马林固定不损坏的粘液层和冷冻组织部分,用福尔马林固定,可以很容易地对聚糖,糖脂和蛋白质( 图2,图3和6)的外源凝集素和抗体染色。这些影响可能是微不足道的膜结合蛋白和组织病理学的研究,但它们是毁灭性高度水合的结构,例如分泌的粘液层。然而,组织学研究仍在进行粘蛋白主要是用石蜡包埋标本,其中的粘液层的保存是次优的。在粘液层等组成的确切身份,本身的深入分析跨膜或膜结合的的MUC糖蛋白的组合所需要的特异性抗体和质谱鉴定的蛋白质主链。粘液层的保护,但最初的要求,这样的研究。
许多实验室都在OCT冻结的组织样本,收集在过去为不同的项目,但这些组织能够很容易地用于研究粘蛋白,糖脂和糖链分布,消除了需要收集到特殊的固色剂,设计独特的黏液保护组织。冷冻组织进行最低限度的处理,因此聚糖的天然分布,这是水合性质,保存。微生物 - 宿主相互作用的境界,这一点尤其重要。知识的自然分泌的粘蛋白和多聚糖结构装饰这些“障碍”分子的分布和数量将是关键,理解宿主防御,微生物剥削和发病机制是。
Disclosures
没有利益冲突的声明。
Acknowledgments
作者要感谢他们的帮助下收割鸡组织中的妮可·内梅斯(乔治亚大学)和Jeanne M.展览会(LANL)的,和史蒂芬A.斯普林格在拍摄过程中他的帮助。在这项研究中,所有的鸟的护理是在符合美国国立卫生准则的人性化使用的实验动物和所有的协议获得批准的机构动物管理和使用委员会在洛斯阿拉莫斯国家安全,有限责任公司,运营商的洛斯阿拉莫斯国家实验室的国家实验室的合同号DE-,AC52-06NA25396与美国能源部。在这项研究中,小鼠的护理是符合加州大学圣地亚哥分校的动物批准的协议。人体组织获得了加州大学圣地亚哥分校认可IRB协议的一部分。这项工作得到了补助金118645从大学加州实验室费先生计划(PG)和美国国家神经疾病研究所授予NS047101和中风(神经显微共用设施,加州大学圣地亚哥分校)。
Materials
| Name | Company | Catalog Number | Comments |
| 2-methyl butane | Fisher Scientific | 03551-4 | |
| AEC peroxidase substrate kit | Vector Labs | SK-4200 | |
| Alcian Blue | Sigma-Aldrich | A3157 | |
| Anti-CA 19-9 monoclonal antibody | Calbiochem | CA1003 | |
| Anti-MUC5AC monoclonal antibody | Millipore | MAB2011 | |
| Avidin-Biotin blocking kit | Vector Labs | SP-2001 | |
| Biotinylated donkey anti-mouse antibody | Jackson Immunoresearch | 90863 | |
| Biotinylated SNA | Vector Labs | B-1305 | |
| Bovine serum albumin | Sigma-Aldrich | A4503 | |
| Chitin-hydrolysate | Vector Labs | SP-0090 | |
| Cryostat microtome | Leica Microsystems | Leica CM 1800 | |
| Hematoxylin | Surgipath Medical Ind. | 3801570 | |
| Hydrogen peroxide 30% | Fisher Scientific | H325-100 | |
| Jacalin-FITC | Vector Labs | FL-1151 | |
| Mayer's Hematoxylin | Sigma-Aldrich | MHS32 | |
| Melibiose | Sigma-Aldrich | M5500 | |
| Nuclear Fast Red | Vector Labs | H-3403 | |
| OCT compound | VWR International | 25608-930 | |
| Peroxidase conjugated streptavidin | Jackson Immunoresearch | 94638 | |
| Schiff reagent | Electron microscopy sciences | 26052 | |
| sWGA-Rhodamine | Vector Labs | RL1022S | |
| TKH2 monoclonal antibody | ATCC | HB-9654 | |
| VectaMount aqueous mounting media | Vector Labs | H-5501 | |
| Cytoseal 60 | Thermo Scientific | 8310-4 | |
| Peel-A Way molds | Polysciences Inc. | 18646A-1 |
References
- Slayter, H. S., Wold, J. K., Midtvedt, T. Intestinal mucin of germ-free rats. Biochemical and electron-microscopic characterization. Carbohydr. Res. 222, 1-9 (1991).
- Lamblin, G. The carbohydrate diversity of human respiratory mucins: a protection of the underlying mucosa. Am. Rev. Respir. Dis. 144, S19-S24 (1991).
- Corfield, A. P., Carroll, D., Myerscough, N., Probert, C. S. Mucins in the gastrointestinal tract in health and disease. Front. Biosci. 6, D1321-D1357 (2001).
- Turner, J. R. Intestinal mucosal barrier function in health and disease. Nat. Rev. Immunol. 9, 799-809 (2009).
- Lievin-Le Moal, V., Servin, A. L. The front line of enteric host defense against unwelcome intrusion of harmful microorganisms: mucins, antimicrobial peptides, and microbiota. Clin. Microbiol. Rev. 19, 315-337 (2006).
- Kim, Y. S., Ho, S. B. Intestinal goblet cells and mucins in health and disease: recent insights and progress. Curr. Gastroenterol. Rep. 12, 319-330 (2010).
- Nochi, T., Kiyono, H. Innate immunity in the mucosal immune system. Curr. Pharm. Des. 12, 4203-4213 (2006).
- Vareille, M., Kieninger, E., Edwards, M. R., Regamey, N. The airway epithelium: soldier in the fight against respiratory viruses. Clin. Microbiol. Rev. 24, 210-229 (2011).
- McGuckin, M. A., Linden, S. K., Sutton, P., Florin, T. H. Mucin dynamics and enteric pathogens. Nat. Rev. Microbiol. 9, 265-278 (2011).
- Knowles, M. R., Boucher, R. C. Mucus clearance as a primary innate defense mechanism for mammalian airways. J. Clin. Invest. 109, 571-577 (2002).
- Johansson, M. E. The inner of the two Muc2 mucin-dependent mucus layers in colon is devoid of bacteria. Proc. Natl. Acad. Sci. U.S.A. 105, 15064-15069 (2008).
- Hooper, L. V., Macpherson, A. J. Immune adaptations that maintain homeostasis with the intestinal microbiota. Nat. Rev. Immunol. 10, 159-169 (2010).
- Hayat, M. A. Microscopy, Immunohistochemistry, and Antigen Retrieval Methods: For Light and Electron Microscopy. Hayat, M. A. , Kluwer Academic/Plenum Publishers. New York, NY. 53-70 (2002).
- Cohen, M., Hurtado-Ziola, N., Varki, A. ABO blood group glycans modulate sialic acid recognition on erythrocytes. Blood. 114, 3668-3676 (2009).
- Cohen, M., Varki, A. The sialome--far more than the sum of its parts. OMICS. 14, 455-464 (2010).
- Ota, H., Katsuyama, T. Alternating laminated array of two types of mucin in the human gastric surface mucous later. Histochemical J. 24, 86-92 (1992).
- Matsuo, K., Ota, H., Akamatsu, T., Sugiyama, A., Katsuyama, T. Histochemistry of the surface mucous gel layer of the human colon. Gut. 40, 782-789 (1997).
- Boyde, A., Maconnachie, E. Treatment with lithium salts reduces ethanol dehydration shrinkage of glutaraldehyde fixed tissue. Histochemistry. 66, 181-187 (1980).



