Summary
Gefixeerde bevroren weefselmonsters ingebed in optimale snijtemperatuur medium (OCT) kan worden gebruikt om natuurlijke verspreiding en glycosylering van afgescheiden slijm bestuderen. In deze benadering weefselverwerking minimaal is en de natuurlijke presentatie van glycolipiden, en mucinen glycan-epitopen behouden blijft. Weefselcoupes kunnen worden geanalyseerd door immunohistochemie met behulp van fluorescentie of chromogene detectie.
Abstract
Mucinen zijn complex en zwaar geglycosyleerd O-gekoppelde glycoproteïnen, die meer dan 70% koolhydraten bevatten gew 1-3. Uitgescheiden mucinen, geproduceerd door slijmbekercellen en het maagslijmvlies, bieden de steiger een micrometers dikke slijm laag die het epitheel van de darm en luchtwegen 3,4. Naast mucinen, slijm lagen bevatten antimicrobiële peptiden, cytokinen en immunoglobulinen 5-9. De slijmlaag is een belangrijk onderdeel van gastheer aangeboren immuniteit, en vormt de eerste lijn van verdediging tegen binnendringende micro-organismen 8,10-12. Als zodanig, het slijm is onderhevig aan talrijke interacties met microben, zowel pathogenen en symbionten en uitgescheiden mucinen vormen een belangrijke schakel voor deze interacties. De studie van dergelijke biologische interacties gaat het meestal histologische methoden voor weefsel verzamelen en kleuring. De twee meest gebruikte methoden voor histologische weefselverzameltoestel en Preservationatie in de kliniek en in onderzoekslaboratoria zijn: formalinefixatie gevolgd door paraffine en weefsel bevriezing, gevolgd door inbedding in cryo-beschermingsmiddel media.
Paraffine-ingebed weefsel monsters te produceren secties met optimale eigenschappen voor histologische visualisatie inclusief helderheid en een goed gedefinieerde morfologie. Tijdens de paraffine inbedden een aantal epitopen worden gewijzigd en om deze epitopen te bestuderen, weefselcoupes moeten verder worden verwerkt met een van de vele methoden epitoop 13. Uitgescheiden mucinen en lipiden geëxtraheerd uit het weefsel tijdens de paraffine-inbedding clearing stap, die vereist verlengen incubatie met organische oplosmiddelen (xyleen of Citrisolv). Daarom is deze benadering niet optimaal voor studies gericht op de aard en verspreiding van mucinen en slijm in vivo.
In tegenstelling, bevriezing weefsels in optimale snijden Temperatuur (OCT) inbedding medium eenvides uitdroging en clearing van het monster, en onderhoudt het monster hydratatie. Dit maakt een betere bescherming van het gehydrateerde mucuslaag, en aldus maakt de studie van de vele rollen van mucinen in epitheliale biologie. Aangezien deze methode vereist minimale verwerking van het weefsel, wordt het weefsel verduurzaamd in een meer natuurlijke toestand. Daarom bevroren weefsels delen vereisen geen extra bewerkingen voor kleuring en kan gemakkelijk worden geanalyseerd met behulp van immunohistochemie methoden.
We tonen het behoud van micrometers dik uitgescheiden slijm laag in bevroren colon monsters. Deze laag is drastisch verminderd wanneer dezelfde weefsels ingebed in paraffine. We tonen ook aan immunofluorescentiekleuring van glycan epitopen op mucinen het gebruik van plantaardige lectines. Het voordeel van deze aanpak is dat het niet het gebruik van speciale fixatieven vereisen en maakt gebruik bevroren weefsels die al worden bewaard in het laboratorium.
Protocol
1. Tissue Embedding in OCT
- Bereid een bevriezing bad door het toevoegen van droog ijs tot 2-methyl-butaan in een ondiepe piepschuim doos.
- Oogst het weefsel en voorzichtig op een vochtig tissuepapier overmaat vloeistof drogen. Bij gebruik snel bevroren weefsel (weefsel werd bevroren in vloeibare stikstof), zodat het weefsel op te warmen tot -20 ° C door het in een cryo-microtoom kamer.
- Een kleine hoeveelheid van de LGO Peel-A-Way bevriezing vorm, net voldoende om de bodem van de vorm bedekken.
- Plaats het weefsel in de matrijs, moet het weefsel rust op de bodem van de mal op de gewenste oriëntatie. Na het invriezen zal de weefselblok doorsnede hetzij vanaf de onderkant of de zijkanten.
- Bedek het weefsel met OCT, en plaats de mal in het ijskoude bad. De OCT verbinding wordt wit als het weefsel bevriest.
- Eenmaal bevroren, schil de mal uit het diepgevroren blok bestrijkt en plaats het in een duidelijke bevriezing zak.
- Vriesblokken kunnen blijvenbij -80 ° C tot gebruik.
2. Tissue Snijden
- Weefselblokken plaats in de cryo-microtoom kamer, en hen tot -20 ° C (ongeveer 30 min) bereiken.
- Snijd een 3-5 urn dikke gedeelte en plaats een positief geladen glasplaatje bovenop de sectie. Het weefsel zal zich houden aan de dia.
- Lucht drogen de weefsels gedurende 30-60 minuten.
- De slides worden gebruikt in dit stadium, of ze kunnen worden bewaard bij -80 ° C voor toekomstig gebruik.
3. Weefselkleuring
- Dia's werden opgeslagen bij -80 ° C: laat de slides ontdooien en drogen bij kamertemperatuur gedurende 30 minuten.
- Bevestig de slides met 10% gebufferde formaline gedurende 30 min bij kamertemperatuur.
- Was driemaal in PBS of TBST buffer, voor elke wasbeurt Dompel de glaasjes 10 keer in 250 ml buffer. PBS buffer kan worden gebruikt voor immunofluorescentiekleuring echter om chromogene detectie van alkalisch fosfatase-conjugated antilichaam, TBST moet worden gebruikt, omdat het fosfaat in PBS remt alkalische fosfatase activiteit.
- Weefselcoupes dia's zijn nu klaar om te worden gekleurd.
4. Met behulp van Histochemische Vlekken zoals Alcian Blauw en Periodieke Zuur Schiff naar Slijm Detect
- Alcian Blauw vlek:
- Spoel de glaasjes in water Incubeer in 3% azijnzuur gedurende 3 min bij kamertemperatuur.
- Vlek met Alcian Blue pH 2,5 gedurende 30 min bij kamertemperatuur.
- Was de dia's in stromend leidingwater gedurende 10 minuten, spoel in DI water.
- Tegenkleuring in Nuclear Fast Red gedurende 5 min bij kamertemperatuur.
- Wash schuift drie keer in DI-water.
- Periodieke Zuur Schiff vlek:
- Spoel de glaasjes in water, incuberen in vers bereide 1% perjoodzuur gedurende 5 minuten.
- Was het residu driemaal in DI water, dompel een keer in miliQ water.
- Vlek met Schiff-reagens gedurende 15 min bij kamertemperatuur temperature.
- Was de dia's in stromend leidingwater gedurende 10 minuten, spoel in DI water.
- Tegenkleuring in Surgipath hematoxyline gedurende 30 seconden bij kamertemperatuur.
- Wash schuift drie keer in DI-water.
- Incubate schuift 30 sec in leidingwater scott's water op kamertemperatuur.
- Was het residu driemaal in DI-water.
- Uitdrogen en duidelijk dia's 1 min incuberen in 95% ethanol, gevolgd door drie snelle veranderingen in 100% ethanol en drie wijzigingen in Citrisolv, 2 minuten elk. Alle bij kamertemperatuur.
- Monteer dia's op dekglaasjes met harsachtige medium (Cytoseal 60).
5. Met lectinen en antilichamen (tabel 1) Glycan Epitopes detecteren door Histochemical Methods
- Voor fluorescentiedetectie drie glycan epitopen met lectinen, blokkeren de slides met 1% BSA in PBS gedurende 10-30 minuten bij kamertemperatuur.
- Aangezien een gebiotinyleerd lectine gebruikt, blokkeren endogene biotine door 15 min incuberen met 0,1%Avidine, gevolgd door 15 minuten incubatie met 0,01% biotine bij kamertemperatuur.
- Was de dia's in PBS na elke blokkeringsstap.
- Vers een mengsel van 1 ug / ml Rhodamine geconjugeerd gesuccinyleerd tarwekiemagglutinine (sWGA), 1,3 ug / ml gebiotinyleerd Sambucus nigra agglutinine (SNA) en 5 ug / ml fluoresceïne-geconjugeerd Jacalin in HEPES / NaCl buffer (10 mM HEPES, 150 mM NaCl pH 7,5).
- Plaats de glaasjes op een vlak oppervlak of in een kleuring box, en laag de lectine mengsel op. Het mengsel volume kan worden verminderd Hiertoe plaatst parafilm op de vloeistof, de parafilm vlakt de vloeistof en voorkomt verdamping.
- Incubeer 1 uur bij kamertemperatuur in het donker.
- Wash dia driemaal met PBS.
- Laag slides met 0,7 ug / ml streptavidine geconjugeerd CY5 (om de gebiotinyleerde-SNA detecteren), en incubeer 30 minuten bij kamertemperatuur in het donker.
- Wash dia driemaal met PBS.
- Tegenkleuring kernen met 0,1 & mu, g / ml DAPI.
- Monteer glaasjes op dekglaasjes met waterig medium zoals VectaMount fixeermiddelen (of waterige media).
6. Controlling voor lectine kleuring Specificiteit
- Lectine kleuring specificiteit wordt ofwel gecontroleerd door specifieke enzymatische splitsing van doelwit glycan epitoop voorafgaand aan kleuring of door competitie met kleine moleculen.
- Enzymatische splitsing van Sambucus nigra agglutinine (SNA) bindingsspecificiteit
- Verdun Arthrobacter ureafaciens sialidase (AUS) 250 mU / ml in 50 mM natriumacetaat pH 5,5.
- Water op de bodem van een lege tip-box, zal een vochtige kamer vormen tijdens incubatie.
- Plaats de glaasjes open op de bovenste lade van de tip-box, laag 150 tot 200 ul AUS oplossing op de dia en dek af met een dekglaasje aan. Vermijd luchtbel vorming.
- Sluit het deksel en incubeer bij 37 ° C gedurende 2,5 uur.
- Wash schuift drie keer in PBS bij kamertempeARD om alle vrije siaalzuren te verwijderen. Deze dia's moeten negatief zijn voor SNA kleuring.
- Concurrerende remmers voor Jacalin en gesuccinyleerd tarwekiem agglutinine (sWGA) specificiteit
- Aliquot 200 ul van de lectine mengsel bereid in stap 5.4 tot twee Eppendorf buisjes.
- Voeg 200 mM melibiose (Jacalin remmer) aan een van de flesjes en chitine-hydrolysaat bij 1:10 verdunning (sWGA inhibitor) aan de andere flacon.
- Overlay negatieve controle slides met de remmers bevattende mengsel en incubeer 1 uur bij kamertemperatuur op hetzelfde moment als de rest van de schuiven. Deze dia's moeten negatief zijn voor Jacalin of sWGA kleuring, respectievelijk.
7. Representatieve resultaten
Een vergelijking tussen weefselmonsters ingebed in paraffine om bevroren weefsels ingebed in cryo-beschermer media (OCT) geopenbaard opvallend verschil in het behoud en de kwaliteit van kleuring voor Mucin glycoproteïnen. Weefselkleuring met histochemische kleurstoffen zoals Alcian Blue en Periodic Acid Schiff, produceren zeer verschillende resultaten in vergelijkbare weefselsecties van bevroren of paraffine ingebedde monsters (figuur 1). Het blijkt dat het organische oplosmiddel (xyleen of Citrisolv) dat gebruikt wordt tijdens de paraffine inbedden raakt aan de uitgescheiden mucinen op epithelia en verwijderen van veel van de glycolipiden van de monsters (Figuur 2). Dientengevolge wordt de mucuslaag stortte op de mucosa cellen en wordt meestal gevonden in slijmbekercellen. Flash bevriezing van weefsels in cryo-beschermer media (OCT) onderhouden monster hydratatie en bewaard de afgescheiden mucinen sokkelafmetingen. De paraffine inbedden beïnvloed andere slijm-geassocieerde glycanen en glycolipiden op soortgelijke wijze. Glycaan verdeling werd onderzocht met behulp van lectinen, die routinematig worden gebruikt voor detectie glycan (figuur 3) en antilichamen tegen epitopen gevondenmucinen en glycolipiden (figuur 6). Omdat lectine binding is niet goed omschreven en wordt beïnvloed door de ruimtelijke verdeling van glycanen en de structuur glycan 14,15, is het van belang de juiste controles op lectine kleuring. Hier laten we zien twee methoden voor het regelen lectine kleuring op de geteste weefsels: enzymatische splitsing en competitieve remming. Splitsing van de glycan epitopen werd uitgevoerd door digestie van de weefselsectie met glycan-specifieke enzymen, bijvoorbeeld bacteriële sialidase als controle voor siaalzuur binding door SNA (figuur 4). In gevallen waarin specifieke enzym (bv. glycosidase) is niet beschikbaar voor het verwijderen van de glycan epitoop bestudeerd, lectine specificiteit worden bevestigd door toevoeging van een competitieve remmer zoals melibiose voor Jacalin kleuring of chitine-hydrolysaat sWGA kleuring (Figuur 5).
We tonen hier dat snap-bevroren weefsel monsters, die routinely verkregen in de kliniek en in onderzoekslaboratoria, kan verder worden ingebed in OCT en gebruikt om mucine glycoproteïnen en de vele glycanen aanwezig te bestuderen.
| Lectine / Ab | Bron | Major specificiteit |
| LFA | Limax flavus (geel slug) | Terminal Sia |
| MAA * | Maackia amurensis (Amur Maackia) | Siaα2-3Galβ1-R / 3-O-sulfaat op Galβ1-R |
| SNA | Sambucus nigra (vlierbes) | Siaα2-6Gal / Siaα2-6GalNAc |
| WGA | Triticum vulgaris (Tarwekiemen) | GlcNAcβ1-4GlcNAcβ1-4GlcNAc / Sia |
| sWGA | Gesuccinyleerd Triticum vulgaris (Tarwekiemen) | GlcNAc & beta, 1-4GlcNAc-4GlcNAcβ1 |
| PNA | Arachis hypogaea (pinda) | Galβ1-3GalNAc (gemodificeerd T-antigen) |
| Jacalin | Artocarpus integrifolia (Jacalin) | Galβ1-3GalNAc vinden op O-gekoppelde glycanen |
| ECA | Erythrina cristagalli (Coral boom) | Galβ1-4GlcNAc |
| TKH2 | Antilichaam | Siaa2-6GalNAc (STN) op O-gekoppelde glycanen |
| CA19-9 | Antilichaam | Siaa2-3Galβ1-4 (Fuca1-3) GlcNAc (SLE a) |
| SNH3 | Antilichaam | Siaa2-3Galβ1-3 (Fuca1-4) GlcNAc (SLe x) |
Afkortingen: Ab, antilichaam; Sia, Siaalzuur, Gal, galactose, GalNAc,
Tabel 1. Een gedeeltelijke lijst van lectinen en antilichamen voor glycan epitopen.
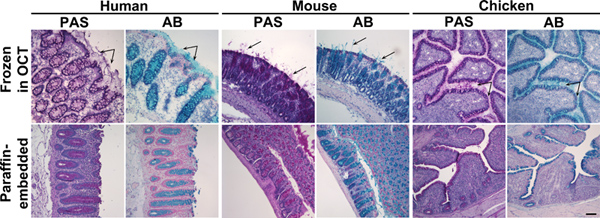
Figuur 1. Alcian Blue en Periodic Acid Schiff kleuring van bevroren en in paraffine ingebedde weefsels colon. Weefselsecties van mens, muis of kip colon specimens bevroren in OCT (bovenste paneel) of in paraffine ingebed (onderste paneel) werden gekleurd met Periodic Acid Schiff (PAS) of Alcian Blue (AB). Deze reagentia vlekken slijm roze of blauw, respectievelijk. Bovenste panel: In bevroren weefsels naast mucinen in slijmbekercellen, uitgescheiden mucus werd ook tenbaar (pijlen). Onderste paneel: In paraffine ingebedde weefsels, werd slijm vlekken beperkt tot slijmbekercellen. Kernen werden tegengekleurd met Surgipath (PAS) en Mayer (AB) Hematoxyline. Scale balk geeft 100 um. Klik hier om een grotere afbeelding te bekijken .

Figuur 2. Citrisolv incubatie leidt tot aanzienlijk verlies van mucinen. Seriecoupes van bevroren kip ileum specimens werden gefixeerd in 10% gebufferde formaline en hield gehydrateerd (linker paneel), gedehydrateerd in ethanol door opeenvolgende incubatie in 70%, 90% en 100% ethanol gedurende 20 min elke (middelste paneel), of gedehydrateerd in ethanol en gewist met Citrisolv 1 uur (rechter paneel). Gedehydrateerde monsters werden gerehydrateerd naar PBS voor hematoxyline en eosine (H & E) en Alcian Blue kleuring. Ethanol uitdroging en Citrisolv clearing verbeterde weefsel morphology (bijvoorbeeld bovenste rij, midden en rechts beelden versus linker afbeelding). Ethanol uitdroging had geen significant effect op Alcian Blue kleuring (middelste rij, vergelijk linker-en middelste foto). Daarentegen Citrisolv incubatie verminderd Alcian Blue kleuring en beperkt aan slijmbekercellen (middelste rij, rechter afbeelding) in een patroon dat vergelijkbaar was met die in paraffine ingebedde weefsels (figuur 1). Deze data impliceren dat de sterke kleuring van slijm granules in paraffine ingebedde monsters door krimpen en condensatie van slijm in de bekercellen tijdens de clearing stap. De zwakkere en minder dicht kleuring van slijm in de bevroren OCT-ingebedde weefsels weerspiegelt een meer natuurlijke verspreiding van slijm in het weefsel. Een vergroting van boxed gebieden zijn gemarkeerd met pijlen. Schaalbalken dan 50 pm (bovenste en middelste rijen) en 10 urn (onderste rij).

Figuur 3. Binding vanlectinen te glycan epitopen op bevroren en in paraffine ingebedde weefsels. Chicken dunne darm (ileum) exemplaren bevroren in OCT (bovenste panelen) of in paraffine ingebed (onderste panelen) werden onderzocht met Jacalin (blauw), sWGA (groen) en SNA (rood ). Een vergroting van boxed gebieden zijn gemarkeerd met pijlen. In bevroren weefsels Jacalin binding aan O-gekoppelde glycanen onthulde structuren die leek te sijpelen uit slijmbekercellen in het lumen (Jacalin, bovenste paneel, pijlen). Daarentegen werd Jacalin binding aan paraffine ingebedde weefsels beperkt tot slijmbekercellen (Jacalin, onderste paneel pijlen) en de villi brush border (linksonder beeld, pijl). sWGA kleuring van β1-4GlcNAc gedeeltelijke co-lokaliseren de binding van Jacalin lectine in zowel bevroren weefsel (bovenste paneel, pijlen) en in paraffine ingebedde weefsels (onderste paneel, pijlen). Daarentegen SNA lectine binding aan α2-6 gekoppelde siaalzuren intracellulair (SNA, pijlpunten) en niet co-lokaliseren met Jacalin (colorbeeld, SNA in het rood gemarkeerd met pijlpunt, Jacalin in blauw gemarkeerd met gestippelde pijl). Scale balken geven 100 micrometer (links afbeeldingen) en 20 urn (vergroot boxed gebieden).

Figuur 4. Enzymatische splitsing controle voor siaalzuur kleuring met SNA. Chicken dunne darm specimens geïncubeerd met 250 mU / ml Arthrobacter ureafaciens sialidase (AUS) of met 50 mM natriumacetaat buffer pH 5,5 gedurende 2,5 uur bij 37 ° C. AUS behandeling schaft kleuring met gebiotinyleerd SNA, bevestigt SNA bindingsspecificiteit aan siaalzuren. Scale balk geeft 100 pm.

Figuur 5. Competitieve remming controle voor glycan kleuring met Jacalin en sWGA. Chicken dunne darm (ileum) specimens werden geïncubeerd met een Jacalin en sWGA mengsel in aanwezigheid van specifieke LECtin remmers: melibiose (middelste kolom), chitine-hydrolysaat (rechterkant) of zonder inhibitor (A en D). Bovenste paneel: (links) Jacalin vlekken zonder remmers. (Midden) Jacalin kleuring werd geremd door melibiose. (Rechts) Chitine-hydrolysaat remde niet Jacalin kleuring. Onderpaneel: (links) sWGA vlekken zonder inhibitor. (Midden) melibiose remde sWGA kleuring. (Rechts) sWGA kleuring werd geremd door Chitine-hydrolysaat. Deze remming bevestigt de specifieke interactie van lectinen met de weefsels. Sterretjes merk imago van kleuring remming. Scale balk geeft 100 pm.

Figuur 6. Detectie van secretoire mucinen, glycolipiden en glycan epitopen in bevroren humane colorectale kankerweefsels. Colorectale kanker biopsies van villous carcinoom en slijmvliezen carcinoom werden snel bevroren in vloeibare stikstof en ingebed in oktober Weefselcoupes werden geïncubeerd gedurende 1 uurmet antilichamen tegen de uitgescheiden mucine MUC5AC, sialyl Lewis a - glycan epitoop gevonden op gangliosiden (darmkanker marker CA 19-9) en sialyl-Tn - overvloedig glycan epitoop op mucinen (gedetecteerd met antilichaam TKH2), gevolgd door 30 min incubatie met gebiotinyleerd ezel anti-muis IgG secundair antilichaam en 30 min incubatie met peroxidase-geconjugeerd streptavidine. Andere weefsels werden gedurende 1 uur met de gebiotinyleerde lectinen SNA en sWGA, gevolgd door 30 min incubatie met peroxidase-geconjugeerd streptavidine. Peroxidasekleuring is ontwikkeld met behulp van AEC-kit. Zwarte schaal balk geeft 200 pm.
Discussion
Behoud van slijm en glycan epitopen in bevroren weefsels superieur is aan die van weefsels die zijn ingebed in paraffine. We toonden het behoud van uitgescheiden mucuslaag (figuren 1 en 3) en de verdeling van drie glycanen structuren (figuur 3) in bevroren weefsels vergeleken met paraffine ingebedde weefsels. Gespecialiseerde fixatieven, zoals Carnoy's oplossing (60% ethanol, 30% chloroform, 10% azijnzuur) 17 ontwikkeld voor optimaal behoud van de slijmlaag in weefselmonsters. Optimaal dienen deze oplossing worden gebruikt om weefselmonsters die speciaal voor mucus studies verzamelen en bleek een goede weergave van mucuslaag 16-17 behouden. De slijmlaag in gefixeerde bevroren monsters ingebed in OCT ruwe weergegeven en in sommige gebieden kunnen losmaken van het weefsel, maar de totale laagdikte in overeenstemming met die waargenomen in weefsels die werden met Carnoy's oplossing en embedded in paraffine 16-17. Bijvoorbeeld, de slijmlaag in bevroren menselijk colon weefselsectie is ~ 100 urn (figuur 1), die binnen het interval dat voor Carnoy's gefixeerde menselijke colon monster 55,4 ± 2,5 pm (bereik 7,7 tot 204,8 pm) 16.
Het is al decennia bekend dat ethanol dehydratie resulteert in ~ 30% krimp van biologische monsters 18, en organische oplosmiddelen zoals xyleen, Citrisolv en chloroform extract lipiden, glycolipiden en tot op zekere hoogte, eiwitten van de weefsels 13. Tissue verwerking voor paraffine inbedding omvat de volgende stappen: fixatie (10% gebufferde formaline), uitdroging (toenemende ethanol concentratie), en clearing (Citrisolv of xyleen). Door het nabootsen van deze stappen losgemaakt ingevroren weefselsecties, we aangetoond dat Citrisolv slijm uit ingevroren weefselsecties resulteert in weefsel morfologie die vergelijkbaar is met die van in paraffine ingebedde weefsels extracten (Figure 2, rechter paneel). Daarentegen werd de mucuslaag niet veranderd door incubatie met formaline of ethanol (figuur 2, links en middenpanelen). Dit suggereert dat de clearing stap van standaard paraffine inbedding procedure, die langdurige incubatie nodig heeft Citrisolv / xyleen, resulteert in de ineenstorting van de slijmlaag. Formalinefixatie niet beschadigt de slijmlaag en bevroren weefsel secties werden gefixeerd met formaline kan gemakkelijk worden gekleurd met lectinen en antilichamen tegen glycanen, glycolipiden en eiwitten (figuren 2, 3 en 6). Deze effecten kunnen verwaarloosbaar voor de studie van membraangebonden eiwitten en weefsel pathologie, maar zijn verwoestend voor sterk gehydrateerde structuren zoals de afgescheiden mucuslaag. Echter histologische studies van mucinen worden nog steeds hoofdzakelijk uitgevoerd met paraffine ingebedde monsters, waarbij de mucuslaag behoud niet optimaal. Diepgaande analyses van mucuslaag samenstelling zoals de precieze identiteit van secreted of membraangebonden glycoproteïne MUC combinaties vereisen specifieke antilichamen en massaspectrometrie voor identificatie van het eiwit backbones. Behoud van de mucuslaag slechts de eerste vereiste voor dergelijke studies.
Veel laboratoria hebben weefselmonsters bevroren in OCT die werden in het verleden verzameld voor verschillende projecten, kunnen deze weefsels gemakkelijk worden gebruikt om mucinen, glycolipiden en glycan distributie waardoor de noodzaak om weefsels te verzamelen in speciale fixatieven die uniek zijn ontworpen voor slijm behoud bestuderen. Bevroren weefsels minimale verwerking ondergaan en daarom de natuurlijke verdeling van glycanen, die gehydrateerd aard, behouden blijft. Dit is bijzonder belangrijk op het gebied van microbiële gastheer interacties. Kennis van naturalistische verspreiding en de grootte van uitgescheiden mucinen en de vele glycaanstructuren decoreren van deze "barrière" moleculen zal de sleutel in het begrijpen van de afweer, microbiële uitbuiting en pathogenenis.
Disclosures
Geen belangenconflicten verklaard.
Acknowledgments
De auteurs willen graag Nicole M. Nemeth (University of Georgia) en Jeanne M. Fair (LANL) bedanken voor hun hulp bij het oogsten van kip weefsels, en Steven A. Springer voor zijn hulp tijdens het filmen. De zorg van alle vogels in deze studie in overeenstemming was met National Institutes of Health richtlijnen voor het humane gebruik van proefdieren en alle protocollen werden goedgekeurd door de Institutional Animal Care en gebruik Commissies bij Los Alamos National Security, LLC, operator van de Los Alamos National Laboratory in Contract No DE-AC52-06NA25396 met het Amerikaanse ministerie van Energie. De zorg van de muizen in dit onderzoek is in overeenstemming met UCSD dier goedgekeurde protocol. Menselijke weefsels werden verkregen als onderdeel van UCSD goedgekeurde IRB protocol. Dit werk werd ondersteund door subsidies 118645 van Universiteit van Californië Lab Fee Voorzitter Program (PG) en het verlenen van NS047101 van Nationaal Instituut voor Neurologische Aandoeningen en Stroke (Neuroscience Microscopie Shared Facility, UC San Diego).
Materials
| Name | Company | Catalog Number | Comments |
| 2-methyl butane | Fisher Scientific | 03551-4 | |
| AEC peroxidase substrate kit | Vector Labs | SK-4200 | |
| Alcian Blue | Sigma-Aldrich | A3157 | |
| Anti-CA 19-9 monoclonal antibody | Calbiochem | CA1003 | |
| Anti-MUC5AC monoclonal antibody | Millipore | MAB2011 | |
| Avidin-Biotin blocking kit | Vector Labs | SP-2001 | |
| Biotinylated donkey anti-mouse antibody | Jackson Immunoresearch | 90863 | |
| Biotinylated SNA | Vector Labs | B-1305 | |
| Bovine serum albumin | Sigma-Aldrich | A4503 | |
| Chitin-hydrolysate | Vector Labs | SP-0090 | |
| Cryostat microtome | Leica Microsystems | Leica CM 1800 | |
| Hematoxylin | Surgipath Medical Ind. | 3801570 | |
| Hydrogen peroxide 30% | Fisher Scientific | H325-100 | |
| Jacalin-FITC | Vector Labs | FL-1151 | |
| Mayer's Hematoxylin | Sigma-Aldrich | MHS32 | |
| Melibiose | Sigma-Aldrich | M5500 | |
| Nuclear Fast Red | Vector Labs | H-3403 | |
| OCT compound | VWR International | 25608-930 | |
| Peroxidase conjugated streptavidin | Jackson Immunoresearch | 94638 | |
| Schiff reagent | Electron microscopy sciences | 26052 | |
| sWGA-Rhodamine | Vector Labs | RL1022S | |
| TKH2 monoclonal antibody | ATCC | HB-9654 | |
| VectaMount aqueous mounting media | Vector Labs | H-5501 | |
| Cytoseal 60 | Thermo Scientific | 8310-4 | |
| Peel-A Way molds | Polysciences Inc. | 18646A-1 |
References
- Slayter, H. S., Wold, J. K., Midtvedt, T. Intestinal mucin of germ-free rats. Biochemical and electron-microscopic characterization. Carbohydr. Res. 222, 1-9 (1991).
- Lamblin, G. The carbohydrate diversity of human respiratory mucins: a protection of the underlying mucosa. Am. Rev. Respir. Dis. 144, S19-S24 (1991).
- Corfield, A. P., Carroll, D., Myerscough, N., Probert, C. S. Mucins in the gastrointestinal tract in health and disease. Front. Biosci. 6, D1321-D1357 (2001).
- Turner, J. R. Intestinal mucosal barrier function in health and disease. Nat. Rev. Immunol. 9, 799-809 (2009).
- Lievin-Le Moal, V., Servin, A. L. The front line of enteric host defense against unwelcome intrusion of harmful microorganisms: mucins, antimicrobial peptides, and microbiota. Clin. Microbiol. Rev. 19, 315-337 (2006).
- Kim, Y. S., Ho, S. B. Intestinal goblet cells and mucins in health and disease: recent insights and progress. Curr. Gastroenterol. Rep. 12, 319-330 (2010).
- Nochi, T., Kiyono, H. Innate immunity in the mucosal immune system. Curr. Pharm. Des. 12, 4203-4213 (2006).
- Vareille, M., Kieninger, E., Edwards, M. R., Regamey, N. The airway epithelium: soldier in the fight against respiratory viruses. Clin. Microbiol. Rev. 24, 210-229 (2011).
- McGuckin, M. A., Linden, S. K., Sutton, P., Florin, T. H. Mucin dynamics and enteric pathogens. Nat. Rev. Microbiol. 9, 265-278 (2011).
- Knowles, M. R., Boucher, R. C. Mucus clearance as a primary innate defense mechanism for mammalian airways. J. Clin. Invest. 109, 571-577 (2002).
- Johansson, M. E. The inner of the two Muc2 mucin-dependent mucus layers in colon is devoid of bacteria. Proc. Natl. Acad. Sci. U.S.A. 105, 15064-15069 (2008).
- Hooper, L. V., Macpherson, A. J. Immune adaptations that maintain homeostasis with the intestinal microbiota. Nat. Rev. Immunol. 10, 159-169 (2010).
- Hayat, M. A. Microscopy, Immunohistochemistry, and Antigen Retrieval Methods: For Light and Electron Microscopy. Hayat, M. A. , Kluwer Academic/Plenum Publishers. New York, NY. 53-70 (2002).
- Cohen, M., Hurtado-Ziola, N., Varki, A. ABO blood group glycans modulate sialic acid recognition on erythrocytes. Blood. 114, 3668-3676 (2009).
- Cohen, M., Varki, A. The sialome--far more than the sum of its parts. OMICS. 14, 455-464 (2010).
- Ota, H., Katsuyama, T. Alternating laminated array of two types of mucin in the human gastric surface mucous later. Histochemical J. 24, 86-92 (1992).
- Matsuo, K., Ota, H., Akamatsu, T., Sugiyama, A., Katsuyama, T. Histochemistry of the surface mucous gel layer of the human colon. Gut. 40, 782-789 (1997).
- Boyde, A., Maconnachie, E. Treatment with lithium salts reduces ethanol dehydration shrinkage of glutaraldehyde fixed tissue. Histochemistry. 66, 181-187 (1980).



